Proteínas: definición, estructura y funciones esenciales en biología
Diapositivas de Dra. María Fernanda Alves Rosa sobre Proteínas. El Pdf explora la definición, clasificación y las diversas estructuras proteicas, desde la primaria hasta la cuaternaria. Este material de Biología para Universidad, con ejemplos visuales y explicaciones detalladas, es ideal para el estudio autónomo.
See more25 Pages

Unlock the full PDF for free
Sign up to get full access to the document and start transforming it with AI.
Preview
PROTEINAS
Medicina Dra. María Fernanda Alves Rosa
Proteínas en Alimentos
Peixe 200 g Cirre 170 g Queijo 110 g 30 g de proteinas animale Marisco 100 g Leite de vaca 860 g Aves 180 g Ovos 285 g
¿Qué son las proteínas?
V Macromoléculas -> Polímeros de aminoácidos. Componentes nitrogenados muy importantes. V Proteínas de la dieta -> formación de nuevos tejidos o para el reemplazo. v Ubicación : carnes rojas, pescado, huevo, leguminosas, lácteos.
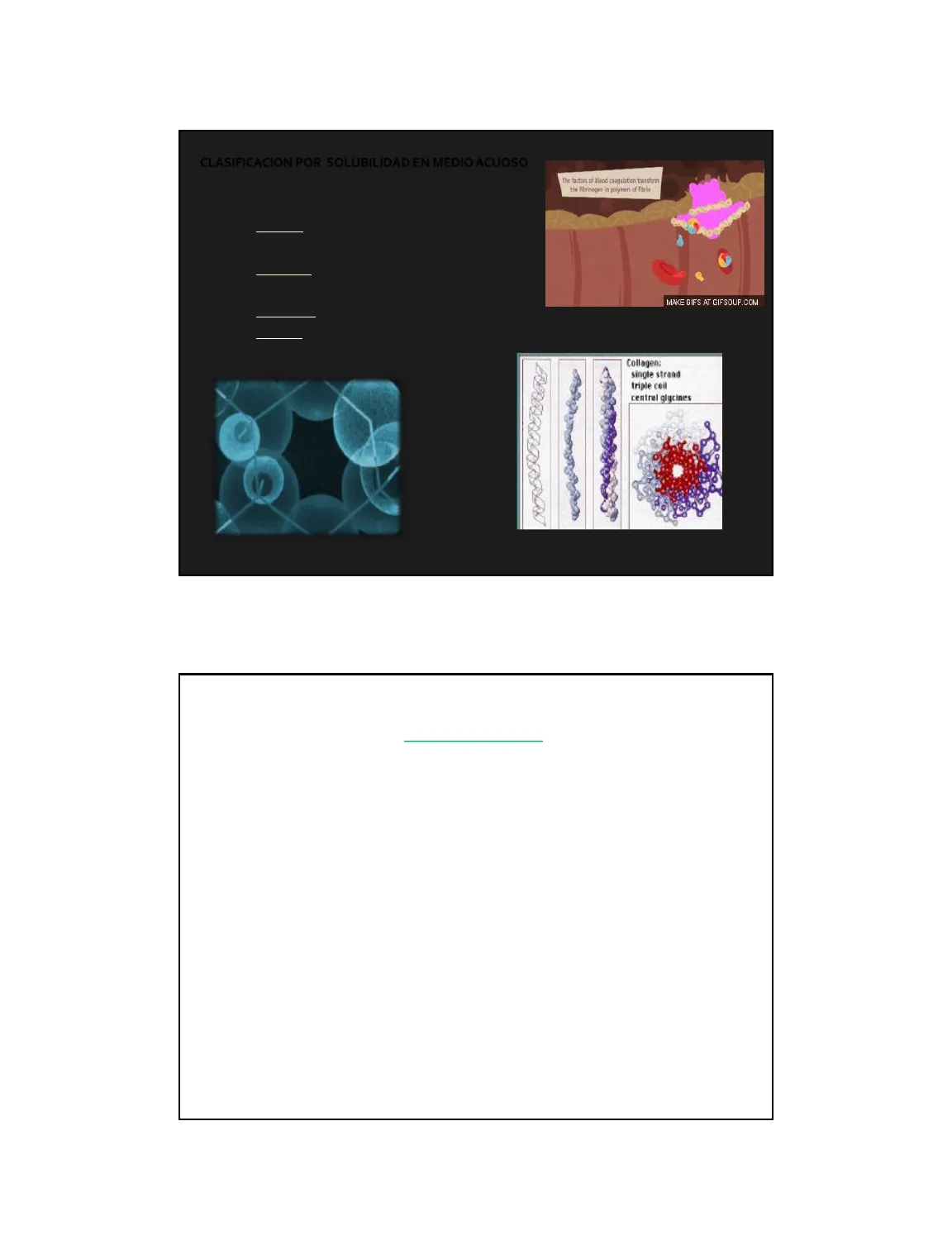
Clasificación de Proteínas por Solubilidad y Forma
Solubilidad en Medio Acuoso
The factors of blood coagulation transform the fibrinogen in polymer of fibrin
- Solubilidad en H2O
- Solubles: Fibrinogeno (precursor de fibrina) + trombina + Ca2+ -> redes
- Insolubles: Fibrina
Forma de las Proteínas
MAKE GIFS AT GIFSOUP.COM
- Globulares (esféricas) -> Insulina y Albúmina.
- Fibrosas (alargadas): Colágeno y Queratina, Fibrinogeno.
Collagen: single strand triple ceil central glycines
Clasificación de Proteínas Según Función
- Catalítica: (enzimas i.e .: Isomerasas, polimerasas, fosfolipasas)
- Transporte: llevar y traer moléculas (Hemoglobina)
- Estructurales: A nivel de membrana celular -> transporte -> i.e: canales de glucosa ie .: SGLUT, GLUT4, GLUT 1, etc. Bombas i.e Na/K, Ca2+
- Protección: sistema inmunológico (anticuerpos o Inmunoglobulinas)
- Reguladoras:
- Parte externa de la membrana plasmática -> sitios de reconocimiento (Receptores de insulina)
- Secretadas -> Insulina.
Tipos de Proteínas y Ejemplos
| Tipos | Ejemplos | Localización o función |
| Enzimas | ADN polimerasa | Cataliza la síntesis de ácidos nucleicos. |
| Reserva | Ovoalbúmina | Clara de huevo. |
| Transportadoras | Hemoglobina/ Albumina | Transporta el oxígeno en la sangre/ proteínas, hormonas, acidos grasos libres |
| Protectoras | Anticuerpos | Bloquean a sustancias extrañas. |
| Hormonas | Insulina | Regula el metabolismo de la glucosa. |
| Estructurales | Colágeno | Tendones, cartílagos, cabello. |
| Contráctiles | Miosina | Constituyente de las fibras musculares |
¿Cómo están compuestas las proteínas?
Los Aminoácidos
► Proteínas-> polímeros de aminoácidos. ► Aminoácidos -> compuestos orgánicos que tienen un grupo carboxílico y un grupo amino. En solución acuosa -> Comportamiento anfótero (pueden ionizarse, dependiendo del pH) -> puede actuar como base o como ácido. En el cuerpo humano existen 20 aminoacidos, siendo 10 esenciales (no pueden ser sintetizados por el organismo. ► Aminoácidos -> incorporacion al organismo a través de los alimentos.
Genérico Amina Carboxilo C~OH H2N. C ? R H HOOC CH3 H-C-CH CH3 NH3+ Valina Val V
Aminoácidos -> unión por enlace peptídico -> OH del grupo carboxílico del aa1 y el H del grupo amino del aa2 -> dipéptido + H2O.
Aminoácidos Esenciales y No Esenciales
| AMINOACIDOS ESENCIALES | AMINOACIDOS NO ESENCIALES |
|---|---|
| Fenilalanina | Glicina |
| Isoleucina | Serina |
| Lisina | Asparagina |
| Metionina | Tirosina |
| Treonina | Cisteína |
| Valina | Acido aspártico |
| Triptófano | Acido glutámico |
| Arginina | Prolina |
| Histidina | Alanina |
| Leucina | Glutamina |
Reacción de Formación del Enlace Peptídico
H O H C O= H-N-C-CFO-H| I + H+N-C-C-O-H HR HR Aminoácido 1 Aminoácido 2 H2O H O 1 H-N-C-+ -C-C-O-H Z-I H R1 I-0-02 0=0 R2 dipéptido
Clasificación de los Enlaces Peptídicos
Oligopéptidos
A. Oligopéptidos: el nº de aminoácidos es menor de 10.
- Dipéptidos: nº de aminoácidos es 2.
- Tripeptidos: nº de aminoácidos es 3.
- Tetrapéptidos: nº de aminoácidos es 4.
Polipéptidos o Cadenas Polipeptídicas
B. Polipéptidos o cadenas polipeptídicas el nº de aminoácidos es mayor de 10.
Clases de Aminoácidos
Aminoácidos No Polares
Alanina O O H2N C- H2N C-OH C H H H C C H H Cisteína No polar Amina || Carboxilo C~OH O O ? R H HẸN C-OH H2N C-OH H H C Básico C O C H C H Acido OH -NH Histidina C Acido Aspartico H+N=C C H Genérico HS H O Polar H2N. C C C H H OH
Metionina O Glicina Aminoácidos no polares H2N GOH GOH C C H O H H H Valina LeucinaO H C H2M C- -OH H2M C OH S H H2N C~OH CH H H3Ć C H3C C H3C ~CH3 H- Triptofano C - H2M C~OH H H H3C CH3 C H Fenilalanina Isoleucina H2M C OH H2M C~OH H Prolina H H3G - NH C-OH H H H2O C H H H3C H H2C-CH2
Aminoácidos Polares
O O Tirosina Treonina H2M C OH H2M C H2M OH C H H. C H - CH3 C OH H H HO GlutaminaO Cisteina O Asparragina H2M C- H2M C OH H2M C OH H H H H C C HS H O=C H O=C H NH2 NH2 O Serina C- ·OH C H- H H C C-H HO C 0-11 H C H C -C C H HON+ C C O G H C C H O H H H C O H C C H Alanina O C H C
Aminoácidos Ácidos
O H2N C- OH CAminoácidos ácidos Ácido aspartico O O H2N C~OH H2M C~OH C H C H C H. C O_C H C H 0=C H Ácido glutámico OH
Aminoácidos Básicos
Histidina O H2M C~OH O Lisina C H H2M C OH C O C C ·OH C H H+N=C H C H H H TH C +H3N C H N H +H2N=C H NH2 H C-H Arginina NH H H2M C C H - -0- C-H H\ H H-C-H C C H H H OH
Niveles de Organización Proteica
Estructura Primaria
Secuencia lineal de aa. en la proteína 5 4 3 2 1
Estructura Secundaria
- Enlaces de H entre los aminoacidos de la estructura primaria -> formación de láminas plegadas ß y hélices a.
Estructura Terciaria
► Plegamiento de las laminas ß y hélices a -> acción de los grupos funcionales R
Estructura Cuaternaria
► Asociación de más de un polipéptido dentro de un complejo proteico influenciado por los grupos funcionales R
Niveles de Organización Proteica: Detalles
La Estructura Primaria
Met-Gly-Ala-Pro-His-Ile-Asp-Glu-Met-Ser-Thr -... · La sustitución de un solo aminoácido altera la función proteica* · Cambios en esta estructura origina una proteína diferente y puede ocasionar enfermedades ( por ejemplo: Anemia falciforme). · Donde se encuentra almacenada la información de la estructura primaria de una proteina S S A Chain Gły Ile Val Glu Gin Cys Cys Ala Ser Val Cys Ser Leu Leu Glu Asn Tyr Cys Asn S 5 I 1 S S Phe Val Asn Gin His Leu Cys Gly Ser Leu Val Glu Ala Leu Tyr Val Cys Glu B Chain Arg Gly Ala Lys Pro Tyr Phe Phe insulina
Rnam- APM Tyr Gin His Leuribosome key signal peptide B-chain peptide dibasic cleavage peptides C peptide A-chain peptide signal sequence chain B N-ter- S Š S -C-ter preproinsulin Š chain A cytosol chain C higgshivealy slyqle 2. folding, oxidation and signal peptide cleavage signal sequence N-ter $ $ S $ proinsulin S Š chain A 3. ER export, Golgi transport, vesicle packaging Golgi chain C 4.protease cleavage liberates C-peptide funghiggshivealylvege; secretory vesicle Š $ $ -C-ter insulin S chain A C-ter N-ter @2004 Beta Cell Biology Consortium http://mol-biol4masters.masters.grkraj.org/html/Co_and_Post_Translational_Events1- Precursor_&_Polyproteins.htm
La Estructura Secundaria
1 no edtayes puntos funcionales El esqueleto peptídico tiene regiones de densidad (8) de carga negativas o positivas La áreas de cargas opuestas pueden interaccionar y formar puentes de H. Formación de puentes de Hidrógeno entre C=O (Carbonilos de un aa.) y el H-N (amino de otro aa). Las estructuras resultantes son: - Láminas plegadas ß - hélices a R H H 0 R - = 1 NH2- CR- C+N- Cx- C++N-Cx- NH2 H R H ! H Atracción por cargas que demuestra un giro. N-ter chain B weaccisigstyalenycn tvnghicgshivealylvege) givenccisicslyglenyen 5. carboxypeptidase E produces mature insulin tynghicgshivealylegge ¿Etnicstygianyen gqvelgggpgagsiqplalegsiqkrgiveqectsicsly malwmrilpilallalwgpdpaa sec61 translocon 1. translation and translocation sakrgiveqceist is6868d666janb chain B ER lumen DC-ter chain C involucrado
Secondary Protein Structure Val His Thr a-helix I-0-₡ \ 1 ß-pleated sheet 2-I ... 0=0 H 1 C 1 R O R O= I- U I -( I - 0=0 I-2 RIC-H I-0-₡ I-Z 1 0 Z I R DEO. .. I-Z Z-I. . . O=U R H I R I I 1 1 I 1 1 I CNCN-C U I I H H R H O Lámina plegada ß O O O O H H H H C N / N N N C C- C C N C N N C N C H H H H O O O O O O O O H C C C C N C C N C N C N C C H O O H O Z-I· · · 0=0 0 R H H -I ... O=0 -I. .. O=0 VEO . .. I-Z I-0-2 1 1 R I H H R 0 . R H -N-C- = 1 I -I H I R Z-I Z-I I-0-2 R Carbo xi terminal de la proteina Z-I. . . 0=0 0= H RICIH C C C C C C C C N C N C N C N C C C H H H H C
La Estructura Secundaria: Lámina Plegada ß
10La estructura secundaria. La lámina plegada ß O O O O H H H H C C N N N C N C C C C C C- C. C C N C N C N C H H H H O O O O O O O H O H C N C N C N C N N C C N C C N C C N C C H H O O H O O O O O H H H H C- N C. N C N N C. C C N C N C H H H H H O involucrada
Estructuras Terciarias y Factores
(Los grupos Funcionales) Hydrophobic interactions (clustering of hydrophobic groups away from water) and van der Waals interactions CH CH2 HĘĆ CH3 Polypeptide backbone O CH3 H CH 0 C-OH -CH2-S-S CH2 Disulfide bridge O -CH2-CH2-CH2-CH2-NH3+ -OC-CH2- Ionic bond Copyright O Pearson Education, Inc., publishing as Benjamin Cummings, (c) Tertiary structure Heme Estructuras terciarias redondeada y compacta -> aspecto globular. He fibrosa y alargada. ₿ polypeptide La conformación espacial de la proteína condiciona su función biológica. hemoglobina > 4 cadena peptidicas 2 & 2B Subunidad La estructura terciaria estan · Forma que adopta en el espacio una proteína -> Plegamiento de las estructuras secundarias (hélices a y láminas plegadas ₿) · Factores que influencian la estructura 3ria .: 1. Interacciones hidrofóbicas / hidrofílicas. 2. Puentes de Hidrógeno (H-H) 3. Puentes disulfuro entre cisteínas (S-S). C C C N C N C O O O C C C C O H C C C HỌC Hydrogen bond CH2 4. Uniones iónicas
C -N N H H
Polypeptide backbone 0 CH2 -CH2-CH2- CH2-CH2-NH3+ 0-C-CH2 lonic bond 0 H Hydrogen bond 0 Il C - NH2 1 CH /1 Dissulfide linkage CH2 H3C H3C CH3 CH3 CH -5 Hydrophobic interactions Bacteriorhodopsin Alpha helix )Camina Plusoda beta GREEN FLUORESCENT PROTEIN (Estructura terciaria) Beta sheet
12 51 cadena Cadena Meptida Estructura terciaria A ribbon diagram of the protein Lsd19, which catalyzes the formation of six- membered rings in lasalocid. (Image by Kinya Hotta) G-3-P Deshidrogenasa de Bacillus stearothermophilus
La Estructura Cuaternaria
► Resultante de la interacción de cadenas de polipéptidos independientes. Factores que influencian la formación de estas estructuras: Interacciones hidrofóbicas / hidrofílicas entre aa .. Formación de puentes de Hidrógeno. La forma y distribución de cargas de los polipéptidos que la componen. Polypeptide chain B Chain Iron a Chain Heme (a) Collagen (b) Hemoglobin Copyright & Pearson Education, Inc., pålisting as Erjuin Cummings
Plegamiento de Proteínas
Protein Folding - LabXchange Pleated sheet Primary protein structure is sequence of a chain of amino acids Amino Acids Tertiary protein structure occurs when certain attractions are present between alpha helices and pleated sheets. - Alpha helix Pleated sheet Alpha helix Secondary protein structure occurs when the sequence of amino acids are linked by hydrogen bonds Quaternary protein structure is a protein consisting of more than one amino acid chain. V EMLA Q A DOL
Niveles de Estructura Proteica
Primary Secondary Tertiary Quaternary todas las Proteinas Con estructura Quaternaria tienen terciario Pero no todas. lassenterciardernar LEVELS OF PROTEIN STRUCTURE Primary Structure HO 0 C H Secondary Structure C-C-N I-Z H 0 H 0 H H c-C- N- C-C N-C N N C C C 0 H CON-C 0 0 U=0 C CN 0 N IN C -N H C N .0 H CON-C CN Ö 0 a-Helix ---- Tertiary Structure Quaternary Structure Lubrizol Life Science C C HO OZO-I-Z IOC H C C C C C-CN H 0 H 0 C ß-Sheet H H. O C C-C-NG O I-Z C-N