Chimica dei materiali inorganici: preparazione, proprietà e reazioni allo stato solido
Documento di università sulla chimica dei materiali inorganici, che esplora la preparazione, le proprietà e le reazioni allo stato solido. Il Pdf, utile per lo studio della chimica a livello universitario, include dettagli sul metodo idrotermale e sui pigmenti inorganici, con tabelle e diagrammi esplicativi.
Ver más66 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Introduzione alla Chimica dei Materiali Inorganici
23/09/24
Ci sono molti approcci alla chimica dei materiali inorganici, uno di questi è quello di concentrarsi sulla
preparazione e la modifica dei materiali. Sintesi di prodotti con composizione desiderata, (micro)-struttura
adatta e proprietà. Ci sono due obiettivi principali nella produzione di un materiale: la preparazione delle
specie chimiche appropriate e il corretto stato fisico.
Il problema con i materiali solidi è che non possono essere purificati sciogliendoli e facendo una
cromatografia perché distruggerei la struttura cristallina o modificherei le proprietà fisiche del materiale.
È molto importante selezionare il precursore adatto e sviluppare le condizioni corrette.
La preparazione tecnologica dei materiali è antica quanto l'umanità (vedi i vasi cinesi e giapponesi) ma ora
anche le questioni ambientali dovute alla produzione di massa, le tensioni sociali derivanti dalla scarsità di
materiali (Co in Africa e Li in Sud America) e le questioni sanitarie devono essere prese in considerazione.
Le proprietà del materiale come la struttura, la dimensione delle particelle, la densità e i difetti dipendono
dalla composizione ma anche dal processo di sintesi utilizzato; anche i campi e i cicli convettivi hanno un
impatto sul cristallo.
Un cristallo è definito come un oggetto che si può diffrangere bene. La sintesi deve produrre lo stesso
contenuto della cella unitaria, aggiungendo impurità posso controllare la crescita dei cristalli.
NB: la cella unitaria è la media nello spazio e nel tempo poiché i cristalli sono oggetti vibranti
La chimica dei materiali inorganici è difficile da studiare perché ci sono molti elementi molto diversi nella
tavola periodica; quindi, è più difficile trovare modelli simili nella reazione, è più probabile che ci siano casi
diversi per ogni materiale.
L'universo è composto per circa l'80% da H, per il 19% da He e per l'1% da altri elementi; la crosta terrestre
è composta da elementi molto più pesanti, ovvero: O, Mg, Si, Fe (persi in ossidi a causa della fotosintesi
delle piante). I metalli rari non sono realmente rari, il problema è che non ci sono molti siti con una grande
densità per scavarli quindi essendo troppo dispersi significa che bisogna prelevare molto materiale solo per
ottenere una piccola frazione dell'elemento di interesse.
I solidi sono solitamente classificati utilizzando i legami chimici (NB: ogni solido non è al 100% un tipo di
legame, ma è più facile avere un composto covalente puro).
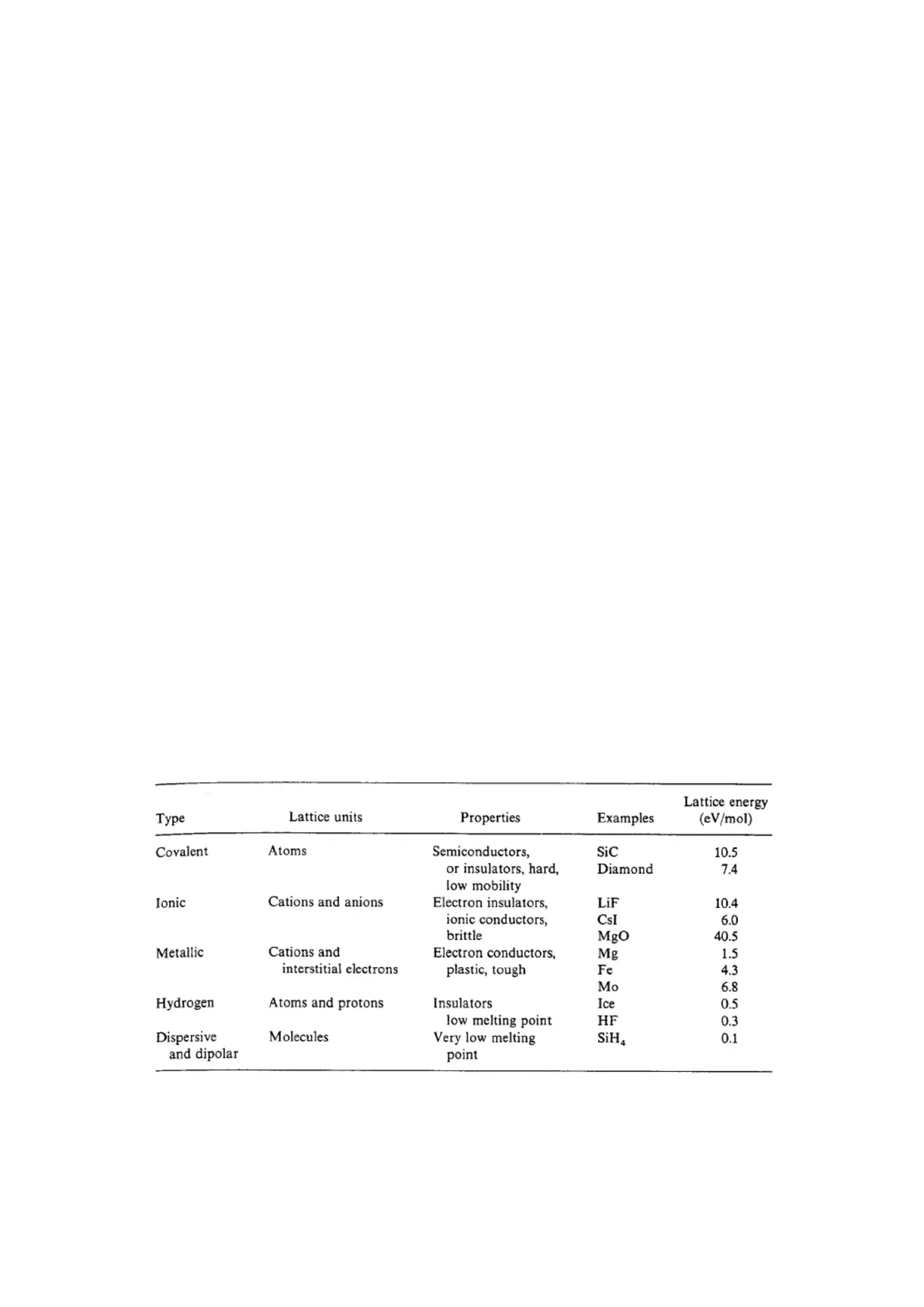
Classificazione dei Solidi e Proprietà
Type
Lattice units
Properties
Examples
Lattice energy
(eV/mol)
Covalent
Atoms
Semiconductors,
SiC
10.5
or insulators, hard,
Diamond
7.4
Ionic
Cations and anions
Electron insulators,
LİF
10.4
ionic conductors,
brittle
MgO
40.5
Metallic
Cations and
Electron conductors,
plastic, tough
Fe
4.3
Hydrogen
Atoms and protons
Insulators
Ice
0.5
low melting point
HF
0.3
Dispersive
Molecules
Very low melting
point
SiHA
0.1
and dipolar
low mobility
CsI
6.0
Mg
1.5
interstitial electrons
Mo
6.8
Questa tabella è utile per decidere il tipo di crogiolo da utilizzare nella sintesi.
Elementi Importanti nella Chimica dei Materiali
Tra tutti gli elementi i più importanti sono:
- Carbonio
1La grafite e il diamante sono due esempi di quanto sia forte l'influenza della struttura di un materiale
sulle loro proprietà. Il carbonio amorfo ha proprietà intermedie tra i due. Ci sono altre strutture come i
fullereni e i carburi metallici (legami con i metalli). - Silicio
Il germanio è un semiconduttore migliore ma è molto più costoso. Il silicio ha la tendenza a legarsi con
l'ossigeno (ceramici). - Boro
È un elemento bizzarro perché ha strani schemi di legame, dovrebbe essere un metallo ma è un
semiconduttore con proprietà anomale. Il boro crea legami sia con i metalli che con altri atomi di boro
NB: la sintesi di solidi è molto diversa dalla sintesi di molecole, i protocolli sintetici nascono dalla pratica di
laboratorio (trial and error) e non da argomenti teorici.
Reazioni allo Stato Solido
Una reazione per essere classificata come reazione allo stato solido deve avere almeno uno dei reagenti
come solido e uno dei prodotti come solido. Normalmente i solidi non reagiscono anche sotto forze motrici
elevate (come 4G << 0) perché la cinetica è lenta. Per aumentare la velocità di reazione è necessario
utilizzare un'alta temperatura e se viene aggiunto un fuso o un gas si può avere un miglioramento del
trasporto di massa.
L'energia libera di Gibbs è definita come: G(T, p) = U + pV - TS = H - TS
La differenza di energia libera di Gibbs (AG = AH - TAS) è la massima quantità di lavoro di espansione
non-volumetrico che può essere estratto da un sistema chiuso a T e p fisse, in processi reversibili. La sua
derivata rispetto alle coordinate di reazione del sistema sparisce al punto di equilibrio (=0).
Una riduzione dell'energia libera di Gibbs è necessaria per avere una reazione spontanea. La temperatura
bilancia le due diverse tendenze: ridurre l'energia interna e massimizzare l'entropia. Alle alte temperature
domina il cambio di entropia (prodotto TS domina) mentre alle basse temperature la diminuzione
dell'energia interna diventa il fattore chiave (TS diventa inesistente, sparisce a T=0).
Anche il fattore cinetico deve essere considerato quando si analizza una reazione, in particolare: il trasporto
atomico e la mobilità (reazioni tra atomi collidenti, i reagenti devono avere mobilità sufficientemente alta).
Per aumentare la mobilità è utile una diminuzione dell'energia di attivazione (ad esempio utilizzando un
catalizzatore).
I prodotti possono essere sotto controllo cinetico, ad esempio l'ossidazione dell'alluminio è limitata a causa
della passivazione. La passivazione si ottiene riducendo la mobilità atomica o aumentando le barriere di
attivazione mentre il sistema rimane termodinamicamente instabile. La cinetica è regolata dalla legge di
Arrhenius (k = A*e-E/RT).
Per risolvere il problema della sufficiente mobilità atomica è necessario utilizzare alte temperature e la
presenza di difetti come vacanze e interstiziali. La distribuzione della velocità molecolare è stata mostrata
per la prima volta da Maxwell e poi estesa da Boltzmann e dipende dalla temperatura. Nei solidi non c'è una
totale libertà di orientamento delle molecole e gli atomi hanno bisogno di riorganizzare la struttura cristallina
per reagire, per questo è più difficile.
Metodo Ceramico e Cinetica di Reazione
Un materiale ceramico è definito come un composto inorganico non metallico con almeno un atomo non
metallico presente. In genere sono duri ma fragili e hanno un alto punto di fusione. Possono essere
classificati in ceramici ionici (catione elettropositivo e anione elettronegativo, Al2O3, MgO, ZrO2, NaCl) e
ceramici covalenti (domina il legame covalente, GaAs, SiC, SiO2) per via del tipo di legame.
Il metodo ceramico per la produzione dei materiali è uno dei più antichi, un esempio di questa sintesi è la
sintesi di YBCO. Una miscela di Y2O3, BaO2 e CuO è finemente macinato per massimizzare la superficie ed
è riscaldata. A volte i materiali vengono pressati in un pellet per garantire un contatto intimo tra i grani.
Trovare il crogiolo giusto è fondamentale, i pellet vengono riscaldati a 930°C (la forma del riscaldamento può
essere rilevante per il materiale) e poi mantenuti a 930°C per 12-16 ore. I pellet vengono poi raffreddati a
2500°℃ e mantenuti a quella temperatura per 12-16 ore, controllando la pressione parziale dell'ossigeno è
possibile ottenere un materiale utile come superconduttore (a 930℃ il materiale non ha le giuste proprietà).
Il valore finale di x dipende dalla pressione parziale dell'ossigeno durante l'annealing (ricottura).
1000
Temperature [°C]
YBa2CU3 6.5
YBa2Cu3 6.9
500
stoichiometric
for Cu2+
25
-
-
0
10
20
30
40
50
Time [h]
Di solito le reazioni allo stato solido sono molto diverse dalle reazioni in
soluzione perché sono eterogenee. Se consideriamo una reazione termica tra
due cristalli A e B in intimo contatto l'uno con l'altro, in primo luogo c'è la
formazione di nuclei sull'interfaccia A/B, questo è il passaggio critico per
l'energia di attivazione (difficile se la riorganizzazione strutturale rilevante è
necessaria): la nucleazione del prodotto C produce due diverse interfacce di
reazione e la contro-diffusione degli ioni deve avvenire attraverso lo strato del
prodotto. Man mano che lo strato di prodotto diventa più spesso e il percorso
di diffusione diventa più lungo, la reazione si riduce. La velocità della reazione
può essere scritta come:
dx = kx-1
dt
Product layer
dove t è il tempo, x lo spessore dello strato di prodotto e k la costante di velocità.
Per integrazione otteniamo la legge del tasso parabolico: x(t) = vkt + C
Si presume che la reazione sia limitata dalla diffusione della specie (anioni, cationi, vacanze). Gli ioni sono
solitamente intrappolati nei loro siti; vibrano soltanto e solo a temperature molto elevate hanno
un'energia sufficiente per diffondersi attraverso la struttura cristallina; non c'è controllo nella reazione, solo
attraverso il cambiamento si verifica la reazione. C'è una regola empirica che dice che, se 2/3 di un
componente sono a Tmelt, è sufficiente per attivare la diffusione e quindi per abilitare la reazione.
La superficie dei solidi è fondamentale per aumentare la velocità di reazione, semplicemente tagliando un
cubo 10 volte parallelamente ad ogni faccia, la superficie aumenta di un ordine di grandezza (103 cristalliti,
area superficie totale 60 cm2). Le particelle raggiungono dimensioni medie di 10um o meno con ball-milling
(macinazione a sfere) e grinding (macinazione). L'area di superficie non c'è nell'equazione del tasso di
reazione, è inclusa indirettamente perché è l'inverso della relazione tra spessore dello strato del prodotto e
l'area di contatto.
Le reazioni limitate alla nucleazione sono descritte dall'equazione di Avrami che si basa su un modello in
cui una fase viene raffreddata sotto la temperatura di transizione (che è una proprietà dell'equilibrio) quindi
la reazione è spontanea; lì si trasforma in un'altra fase con nucleazione spazialmente casuale. La barriera
più alta da superare è la creazione dei nuclei, la barriera energetica per crescere è molto meno. La variazione
della frazione può essere espressa come:
Vo-Vo
X(t) = to = 1 - e-kt"
dove k è la costante cinetica e n è un numero reale (solitamente
compreso tra 1 e 3 come la dimensione della particella ottenuta); n
dipende dalla forma delle particelle nella fase B: n = 3 sfere, n = 2 dischi,
n = 1 corde. Se n > 1 la funzione ottenuta è una sigmoidea (a forma di S).
Se la nucleazione avviene contemporaneamente alla crescita per le
particelle sferiche 3D, n può essere 4 o 5, per particelle a forma irregolare
n può essere un numero non-intero.
exhaustion of reactive
surface/reactants
n =1
growth of
nuclei
n = 3
nucleation
·t
Per avere una distribuzione stretta della dimensione del cristallo dobbiamo fermare la nucleazione
separando i nuclei dalla soluzione per poi lasciarli crescere.
3
A
B
Original interface
A
B