Normalità in chimica: definizione, molarità e titolazioni acido-base
Slide di Università sulla normalità in chimica. Il Pdf, utile per lo studio della Chimica a livello universitario, definisce la normalità come concentrazione chimica, la sua relazione con la molarità e le applicazioni nelle titolazioni acido-base, con esempi numerici.
Mostra di più31 pagine
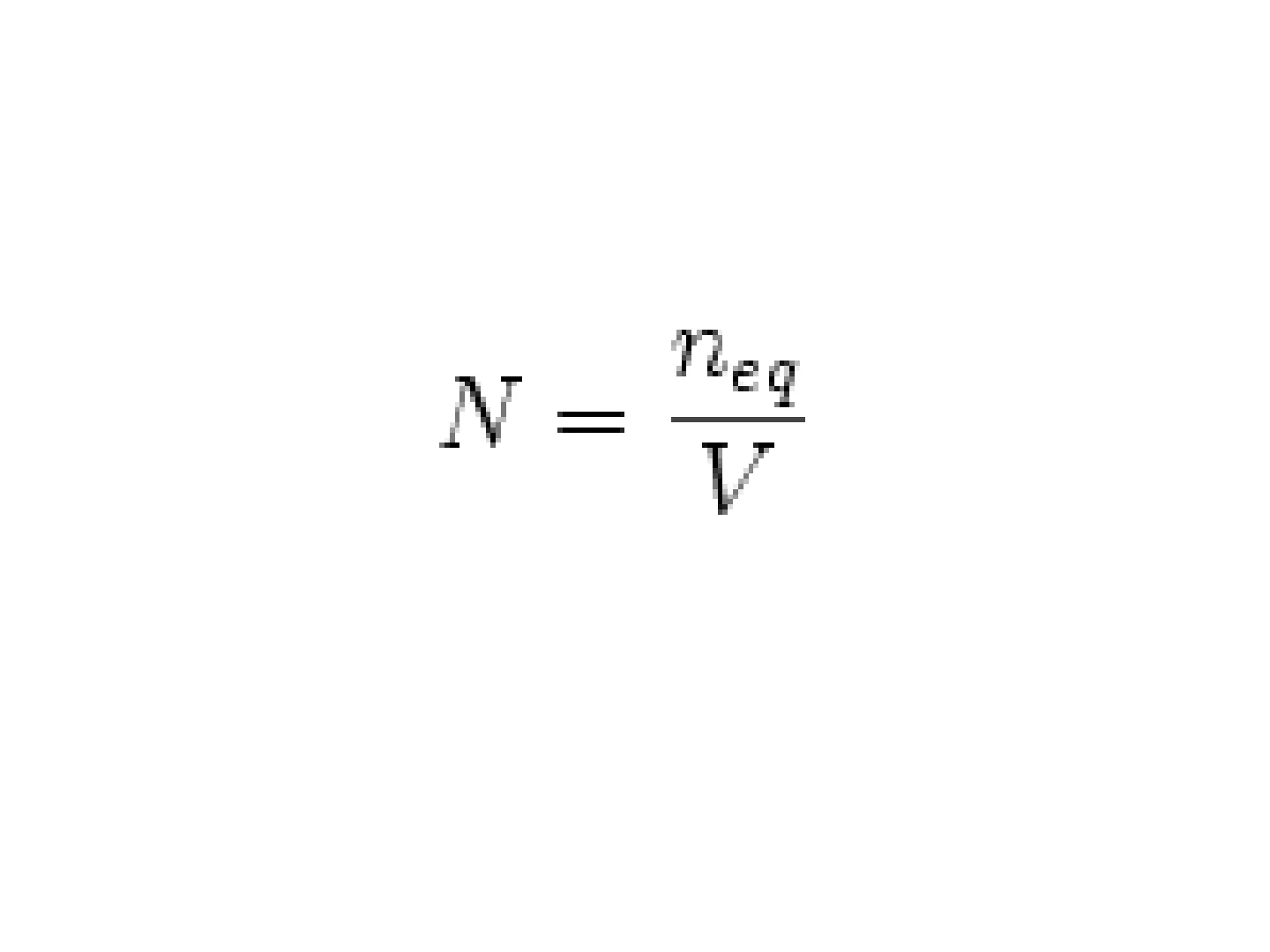
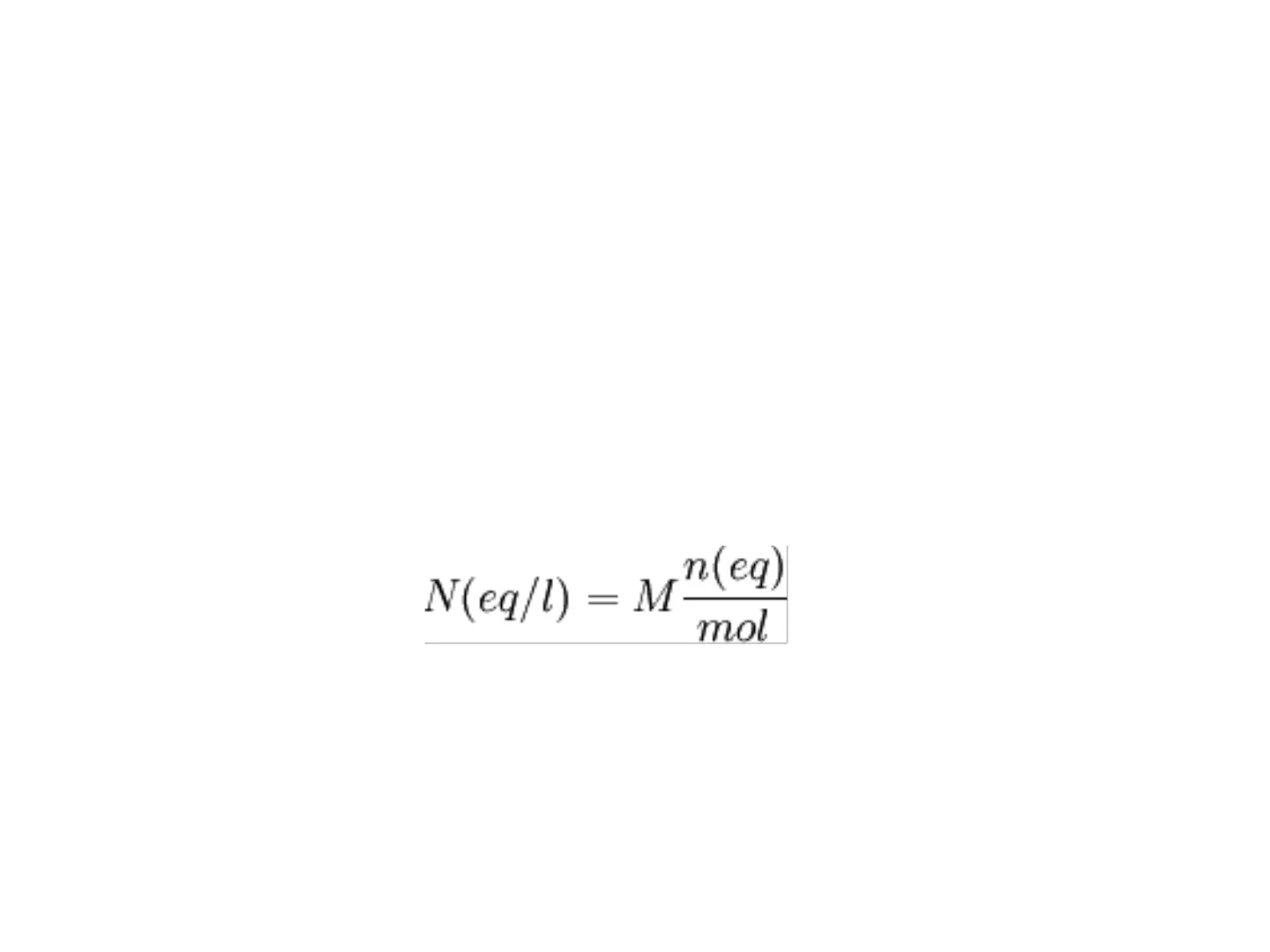
Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Normalità e Concentrazioni
Normalità · indica il numero di equivalenti di un soluto disciolti in un litro di soluzione. N · neq è il numero di equivalenti e V è il volume. · È molto utile esprimere le concentrazioni di soluto in termini di normalità quando si vuole sfruttare la legge dell'equivalenza chimica: un numero eguale di equivalenti di reagenti reagisce per dare un egual numero di equivalenti di prodottiNormalità
- Nelle titolazioni si usa applicare, relativamente ai reagenti, la relazione N V1 = N2V2
- La relazione tra Molarità di una soluzione e Normalità N(eq/l) = M n(eq) mol
- Nota: n(eq)/mol = Equivalente
- Il concetto di equivalente è connesso al concetto di peso equivalente
Normalità: Numero di Equivalenti per Litro
Normalità - N: Numero di equivalenti / litro di soluzione Equivalente: varia a seconda del tipo di reazione e dei reagenti Per determinare il numero di equivalenti in una mole è necessario sapere il tipo di reazione e come le specie coinvolte nella reazione effettivamente si combinano.
Peso Equivalente e Reazioni Chimiche
Peso equivalente : P. = Peso molecolare/ nº equivalenti/mole Acido-base P. = Peso molecolare/ nº H+ prodotti o consumati eq Formazione di un precipitato P .= Peso molecolare/ carica dello ione z Ossido-riduzione Pen = Peso molecolare/ nº e- acquisiti o persi
Pesi Equivalenti delle Sostanze Elementari
Pesi equivalenti delle sostanze elementari . Gli elementi sono sempre coinvolti in processi redox, pertanto il p.e. è dato dal rapporto tra il peso atomico o molecolare e il numero di elettroni ceduti o acquistati per mole di sostanza
- Gli elementi del Gruppo 1 hanno z=1
- Gli elementi del Gruppo 2 e 3 hanno z=2, z=3
Pesi Equivalenti nei Composti
Nei composti · P.E. = M.M./Z · Il valore di z dipende a seconda che la sostanza partecipi ad un processo redox o acido-base HCl, NaOH, HNO3 , LiOH, NH3 , H3PO2 Z=1 H2SO4, Ca(OH)2, H3PO3 Al(OH)3 , H3PO4 z=1,2,3 z=1,2 In ogni caso è uguale al numero di H+ o di OH- scambiati nella reazioneneq = moli . Z N= Z · M
Titolazione Acido-Base
titolazione acido-base · La titolazione acido-base si basa su una reazione di neutralizzazione in cui un acido reagisce con una quantità equivalente di base - il titolante è sempre un acido forte o una base forte - l'analita può essere una base o un acido forte, una base o un acido debole, monoprotico o poliprotico, una miscela di acidi o basi
Titolazione in Pratica
Titolazione in pratica 4 5 6 7 8 (a) (b) (c)
- Per preparare una soluzione a titolo esattamente noto si solubilizza una quantità pesata di soluto in un volume noto di solvente.
- Questo è comunque realizzabile solo per quelle sostanze che sono standard primari.
- Affinche' un solido possa essere considerato standard primario deve essere - puro ** (99.99%), - possedere un peso equivalente elevato, - avere una reazione stechiometrica univoca - non deve reagire con il solvente in uso - essere stabile all'aria.
- La normalità' di una soluzione di uno standard primario viene quindi calcolata conoscendo la quantità' pesata, il peso equivalente ed il volume di soluzione.
Standard Primari e Secondari
Per una data titolazione, non sempre sono disponibili standard primari !!! a volte è necessario ricorrere ad una seconda sostanza, che per essere usata come soluzione titolante deve comunque essere standardizzata usando uno standard primario si ottiene uno standard secondario es:
- idrossido di sodio (standardizzato con ftalato acido di potassio);
- acido cloridrico (standardizzato con carbonato di sodio);
- permanganato di potassio (standardizzato con ossalato di sodio)
Titolazione Acido Forte-Base Forte
Titolazione acido forte-base forte Immaginiamo di titolare una soluzione 0,1 N di HCI con una soluzione 0,1 N di NaOH. Osserviamo che, essendo l'acido cloridrico un acido monoprotico e l'idrossido di sodio una base monoprotica, in questo caso per entrambi molarità e normalità coincidono. CHCI = 0,1 M = 0,1 N = NA CNaOH= 0,1 M = 0,1 N=NB Inseriamo la soluzione di idrossido di sodio nella buretta (titolante), poniamo un volume noto (VA) di soluzione di acido cloridrico nel becher (titolato) e procediamo con la titolazione. Supponiamo di poter misurare il pH della soluzione di HCI durante lo svolgimento della titolazione (nei prossimi capitoli vedremo come è possibile farlo) e di costruire punto per punto la curva di titolazione NaOH HCI Prima dell'inizio della titolazione, nel becher è presente una soluzione 0,10 M di HCI, un acido monoprotico forte, totalmente dissociato, secondo la reazione: HCI + H20 -> H30++CI La concentrazione di ioni H3O+ è quindi uguale alla concentrazione analitica dell'acido: [H3O+]= CHCI = 0,1 M ed il pH risulta: pH =- log[H3O+] =- log(0,1)= 1
Variazione del pH nella Titolazione Acido Forte-Base Forte
Iniziamo ad aggiungere la soluzione di NaOH dalla buretta; tra acido cloridrico ed idrossido di sodio ha luogo la reazione di neutralizzazione: H3O+ + OH ->2 H2O in forma ionica Stiamo aggiungendo una base e questo provoca un aumento del pH della soluzione; tuttavia, nella fase iniziale della titolazione, la curva di titolazione mostra una variazione di pH estremamente modesta. Infatti, una soluzione concentrata di acido forte possiede proprietà tamponanti, ovvero il suo pH non varia apprezzabilmente in seguito ad aggiunta di piccole quantità di acidi o basi. Procedendo con le aggiunte, la concentrazione di acido cloridrico non neutralizzato dall'idrossido di sodio diminuisce sempre di più e la soluzione perde gradualmente la sua capacità tamponante. In corrispondenza del punto di equivalenza si osserva una brusca variazione, ovvero un salto di pH, che da valori acidi si porta rapidamente e valori molto basici. Il punto di equivalenza corrisponde al punto di massima pendenza della curva di titolazione; dal punto di vista matematico è un punto di flesso, ovvero un punto in cui la derivata prima della curva presenta un massimo e la deriva seconda si annulla. All'equivalenza tutto l'acido cloridrico è stato neutralizzato dalla base, pertanto la soluzione risulta neutra (pH=7).
Curva di Titolazione Acido Forte-Base Forte
pH 14 12- 10 punto di equivalenza 8 6- 4- 2 V V B NaOH Titolazione acido forte-base forte Al punto di equivalenza il numero di equivalenti (ed in questo caso anche di moli) di base aggiunta all'acido eguaglia il numero iniziale di equivalenti di acido: neqA= neqB ed è possibile determinare la normalità della soluzione a titolo incognito mediante l'equazione: NAVA= NBVB Se si procede con le aggiunte di titolante oltre il punto di equivalenza, si osserva che, dopo il salto di pH, il pH della soluzione, tende nuovamente a stabilizzarsi intorno a valori molto basici, a causa dell'eccesso di idrossido di sodio.
Dettagli della Curva di Titolazione Acido Forte-Base Forte
CURVA DI TITOLAZIONE ACIDO FORTE - BASE FORTE Titolazione di 20 cm3 di un soluzione acquosa di HCI 0.1 N con una soluzione acquosa di NaOH 0.1 N Titolando: HCI 0.1 N, Vol. iniziale: 20 ml - Titolante: NaOH 0.1 N Indicatore: Rosso fenolo NaOH (ml) Vol. tot. (ml) [HCI] N pH HIn (%) colore 0 20 0.10 1.0 100 9 + 10 30 0.033 1.5 100 7 punto di equivalenza 5 3 + 0.9 39.9 0.0025 3.6 100 + 0.09 39.99 2.5×10-5 4.6 99.8 + 0.05 40.04 NaOH=9.99x10-5 10 0.2 pH 13 11 punto finale + 9 39 0.0256 2.6 100 1 0 10 20 30 ml NaOH 0.1 N aggiunti a 20 ml HCI 0.1 N H+ + OH- > H2O pH al punto equivalente = 7 Indicatore Rosso fenolo: vira nell'intervallo di pH 6.4 - 8.0
Curva di Titolazione Acido Debole-Base Forte
CURVA DI TITOLAZIONE ACIDO DEBOLE - BASE FORTE Titolazione di 20 cm3 di CH COOH 0.1 N con NaOH 0.1 N Titolando CH3COOH 0.1 N, Vol. iniziale 20 ml Indicatore: Fenolftaleina - Titolante: NaOH 0.1 N PH NaOH (ml) Vol. tot. (ml) [acido]: [sale] pH HIn (%) col. 13 0 20 75:1 2.87 100 11 + 1 21 19:1 3.47 100 + 1 22 9:1 3.79 100 punto di equivalenza + 8 30 1:1 4.74 100 7 + 9 39 1:19 6.02 100 5 + 0.5 39.5 1:39 6.34 99.9 + 0.4 39.9 1:199 7.04 99.4 + 0.09 39.99 1:1999 8.03 94.9 1 + 0.01 40.00 1:9400 8.72 79.2 + 0.01 40.01 1:45000 9.4 44.3 + 0.03 40.04 1:178000 10.0 16.6 0 10 20 30 ml NaOH 0.1 N aggiunti a 20 ml CH 3COOH 0.1 N CH3 COOH + NaOH -> Na+ + CH3 COO + H2O prima del p. equiv .: soluzione tampone al punto equivalente pH > 7 perché CH3 COO + H2O = CH3 COOH + OH- Indicatore fenolftaleina che vira nell'intervallo di pH: 8.3 - 10.0 9 punto di semiequivalenza 3
Calcolo del Volume di NaOH per il Punto Equivalente
A 40.0 mL di una soluzione 0.100 M di acido acetico viene aggiunta una soluzione di NaOH 0.150 M. Sapendo che la costante acida dell'acido acetico è pari a 1.80 x 10-5 calcolare: a) Il volume di NaOH necessario per raggiungere il punto equivalente Le moli di acido acetico presenti nella soluzione sono pari a: 0.0400 L · 0.100 M = 0.004 Per raggiungere il punto equivalente sono necessarie altrettante moli di NaOH. Il volume di NaOH viene quindi calcolato dalla formula V = moli/ molarità ovvero V = 0.00400/ 0.150 =0.0267 L corrispondenti a 26.7 mL
Concentrazione Molare dell'Acido al Punto Equivalente
b) La concentrazione molare dell'acido al punto equivalente Al punto equivalente tutto l'acido si è trasformato nella sua base coniugata ovvero in ione acetato secondo la reazione: CH3 COOH + OH- - > CH3 COO- + H2O Lo ione acetato così formato dà reazione di idrolisi secondo la reazione di equilibrio: CH3COO- + H20 CH3COOH + OH- Kp = Kw X Ka ovvero: Kp = 1.00 · 10-14/ 1.80 . 10-5 = 5.56 · 10-10 Le moli di ione acetato sono pari a 0.004 Il volume totale della soluzione è pari a 40.0 + 26.7 = 66.7 mL = 0.0667 L La concentrazione dello ione acetato vale quindi [CH3COO-] = 0.004/0.0667 =0.06 M
Calcolo delle Concentrazioni all'Equilibrio
CH3COO- + H20 CH3COOH + OH- I 0.06 - - E 0.06 -x x x All'equilibrio le concentrazioni delle specie presenti in soluzione sono: [CH3COO-] = 0.0600 -x mentre le concentrazioni dello ione OH- e di CH3COOH sono pari a x. Sostituendo tali valori nell'espressione della costante di equilibrio si ha: Kp = 5.56 . 10-10 = [CH3COOH][ OH-]/ [CH3COO-] = (x)(x) / 0.0600 -x Risolvendo tale equazione rispetto a x e trascurando la x sottrattiva al denominatore stante il basso valore della costante di equilibrio si ottiene x = 5.77 . 10-6 = [CH3COOH]= [OH-]
Calcolo del pH al Punto Equivalente
c) Il pH della soluzione al punto equivalente Avendo calcolato nel punto precedente la concentrazione dello ione OH- possiamo calcolare il pOH pOH = - log 5.77 . 10-6 =5.24 da cui pH = 14 - pOH = 14 - 5.24 = 8.76
Soluzioni Tampone
Soluzioni tampone Un tampone è una soluzione che varia in maniera trascurabile il proprio pH in seguito all'aggiunta di quantità moderate di un acido o di una base forte. Se ad un litro di acqua pura vengono aggiunte 0,01 moli di HCI il pH varia da 7 a 2 (pH =- log(0,01) =2,0), ovvero di 5 unità. L'aggiunta della stessa quantità di HCI ad un litro di soluzione tampone può far variare il pH di circa 0,1 unità. Per questo motivo le soluzioni tampone sono molto importanti, anche a livello biologico. Per esempio il sangue è una soluzione tampone ed ha un pH di circa 7,4 e la sua funzione di trasportatore di ossigeno risulterebbe compromessa se tale valore dovesse variare.