Proprietà colligative delle soluzioni in chimica per l'università
Slide sulle Proprietà Colligative. Questo Pdf illustra le proprietà colligative delle soluzioni, con un focus sull'abbassamento della tensione di vapore e la pressione osmotica. La presentazione, ideale per studenti universitari di Chimica, include definizioni e diagrammi per facilitare la comprensione degli argomenti.
Mostra di più34 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Proprietà Colligative
Le proprietà colligative delle soluzioni sono proprietà che dipendono dalla concentrazione delle molecole di soluto o degli ioni in soluzione, ma non dalla loro natura.
Abbassamento della Tensione di Vapore
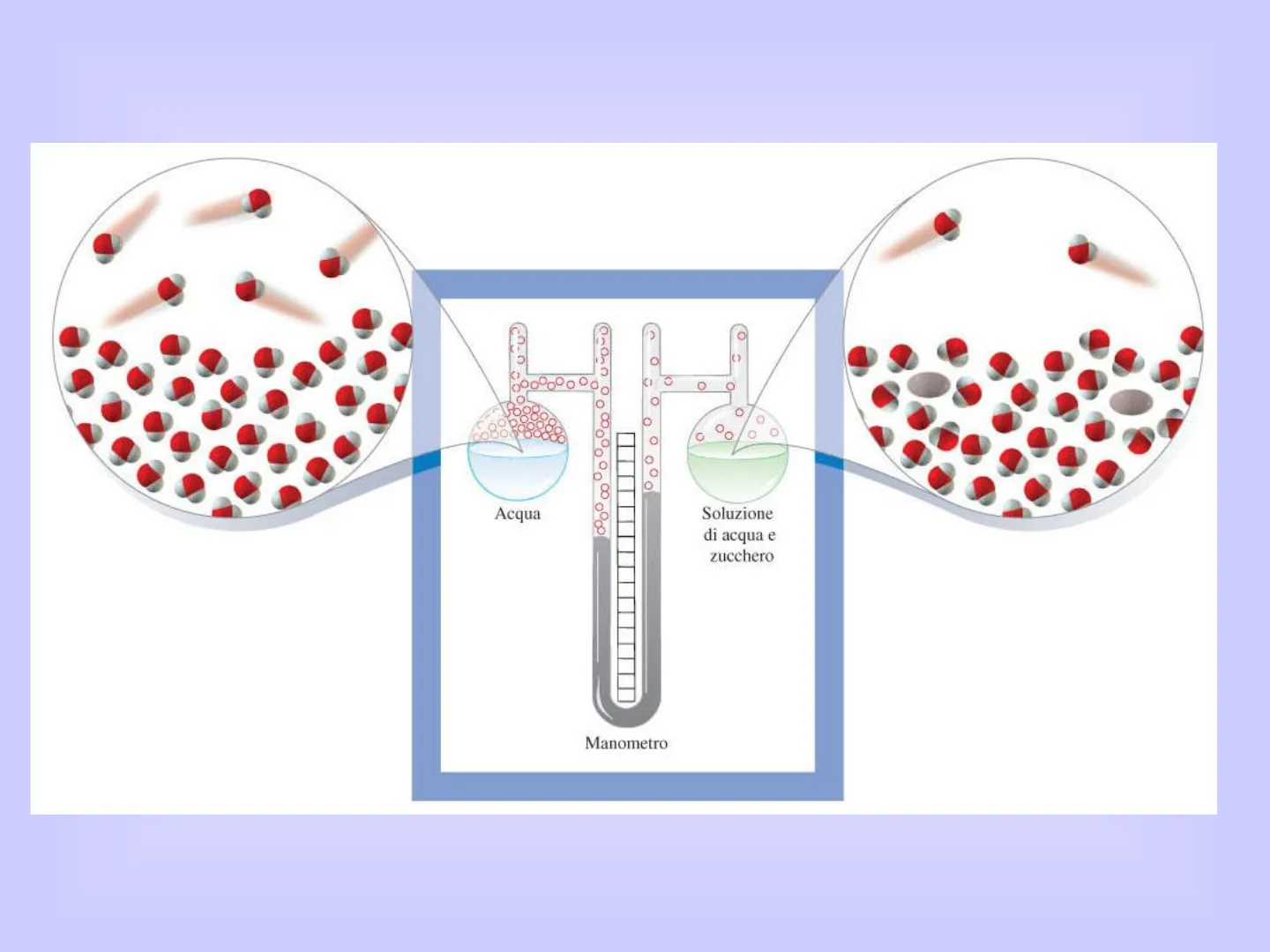
Alla fine dell'800 fu sperimentalmente osservato che la tensione di vapore del solvente veniva abbassata dall'aggiunta di un soluto non volatile. In particolare nel 1886 Raoult osservò che l'entità di questo abbassamento non dipendeva dal tipo di soluto ma solo dalla sua frazione molare.0 0 2000 0 O 0 CO 0 0 0 8 Acqua Soluzione di acqua e zucchero ManometroAbbassamento della tensione di vapore Consideriamo la soluzione di un solvente volatile A e un soluto non elettrolita B (volatile o non volatile). La legge di Raoult stabilisce che: la tensione di vapore parziale del solvente, PA, sopra la soluzione è uguale alla tensione di vapore del solvente puro, PAº, moliplicata per la frazione molare del solvente, XA PA = XA PO Se il soluto è non volatile PA è la pressione di vapore totale della soluzione. Poiché x è minore di 1 si ha un abbassamento della tensione di vapore rispetto al solvente puro.Questo abbassamento sarà dato da: AP= PA - PA In base alla legge di Raoult AP= PA - PA XA= PA(1- XA)= PA°XB XB L'abbassamento della tensione di vapore dipende dalla concentrazione del soluto Xp ma non dalla sua natura ed è quindi una proprietà colligativa.Quando vale la legge di Raoult?
Vale in genere per soluzioni diluite (con xA vicino ad 1). Quando essa vale per qualsiasi frazione molare (ciò accade quando A e B sono simili, es. benzene e toluene) la soluzione è detta ideale. In altre parole, una soluzione ideale si ha quando sia A che B seguono la legge di Raoult per ogni valore della frazione molare (oppure quando si mescolano senza sviluppo o assorbimento di calore). PA PO 0 A Soluzione ideale Raoult -- RA Soluzione non ideale 1 XA A 0 0 X B 1Esempio: Calcolare AP dell'acqua a 25℃ quando 5,67 g di glucosio (C6H12O6 ) sono sciolti in 25,2 g di acqua. A tale temperatura la tensione di vapore dell'acqua pura è 23,8 mmHg n glucosio = 5,67 g 180,2 g/mol = 0,0315 mol glucosio n H 2 O = 25,2 g 18,0 g/mol = 1,40 mol H 2 O 0,0315 X glucosio = 0,0315 + 1,40 = 0,022 Dalla legge di Raoult: AP= PAY glucosio = 23,8 mmHg ×0,0220 = 0,524 mmHg PA= PA°XH20 = 23,8 mmHg ×(1-0,0220) = 23,3 mmHgInnalzamento ebullioscopico ed Abbassamento crioscopico Abbiamo visto che l'aggiunta di un soluto non volatile abbassa la tensione di vapore della soluzione. Un grafico della tensione di vapore contro T mostra che occorre una temperatura maggiore affinchè la tensione di vapore raggiunga una atmosfera e si abbia ebollizione 760 700 Pressione di vapore (mm Hg) 600 500 400 HO Soluzione pura- 300 AT-0,512 ℃ (non in scala) 200 100 p.e. di H2O pura p.e. della soluzione - - - 0 50 60 70 80 90 100 Temperatura (° C)Temperatura di congelamento della soluzione pressione LIQUIDO soluzione 1,00 atm Temperatura di ebollizione della soluzione SOLIDO GAS 0℃ 100℃ temperatura760 Tensione di vapore del solvente (torr) Liquido APsolvente a pe del solvente puro Solido Solvente puro luzione Gas T Tf Te Te soluzione AT solvente solvente puro puro ΔΤ. soluzione Temperatura (°℃) Un diagramma di fase completo mostra che per una soluzione si ha un innalzamento del punto di ebollizione e un abbassamento del punto di fusione rispetto al solventePer soluzioni diluite si può dimostrare che ATb= Tb(soluzione) - Tb(solvente) = Kb m ATf= Tf(solvente) - Tf(soluzione) = Kf m Kp, nota come costante ebullioscopica, e Kf, nota come costante crioscopica, sono costanti caratteristiche solo del solvente. Esse hanno unità ºC/m.Problema: Sapendo che per l'acqua Kp= 0,512 ℃/m e K+=1,86 °C/m calcolare il punto di ebollizione e di fusione di una soluzione acquosa di glucosio 0,0222 m. ATb= Kb m = 0,512 °C/m × 0,0222 m = 0,0114 ℃ Tb= 100,00 + 0,0114 = 100,011℃ ATf= Kf m = 1,86 ℃/m × 0,0222 m = 0,0413 ℃ Tf= 0,000 - 0,0413 = - 0,041℃Le proprietà colligative possono essere usate per determinare il peso molecolare di sostanze non note. Problema: La canfora è un solido che fonde a 179,5℃ ed ha Kf= 40°C/m. Se 1,07 mg di un composto sono sciolti in 78,1 mg di canfora fusa la soluzione congela a 176,0 °℃. Determinare il peso molecolare del composto. L'abbassamento del punto di congelamento è: ATf= 179,5 -176,0 = 3,5 ℃ Da cui si ricava la molalità della soluzione: ΔΤ m = f = 3,5℃ K = 0,088 m 40°C/m Dalla definizione di molalità si può ottenere il numero di moli del composto: moli soluto m = Kg solvente moli= m × Kg solventeQuindi: Moli = m x Kg solvente = 0,088 mol/Kg × 78,1×10-3 Kg = 6,9 ×10-6 mol La massa molare del composto è data da: massa moli = M m massa 1,07 ×10-3 g M = = =1,6×102 g/mol m moli 6,9×10-6 molOsmosi Anche il fenomeno dell'osmosi (pressione osmotica) è associato all'abbassamento della tensione di vapore. Esso riveste una grande importanza in relazione a sistemi biologici. Coinvolge membrane semipermeabili, cioè strati sottili e con fori abbastanza larghi da far passare le molecole di solvente, ma non di soluto, specie di elevato peso molecolare. + Molecola di grandi dimensioni Membrana semipermeabile H2O + Ioni idratatiL'Osmosi è il passaggio spontaneo di un solvente puro verso una soluzione, separata da una membrana semipermeabile. Una membrana semipermeabile permette il passaggio del solvente ma non del soluto. Il solvente passa dalla soluzione meno concentrata a quella più concentrata. 4% NaCl 10% NaCl H20-3 2 7% NaCl 7 % NaCl H2O 2 Membrana Semipermeabile EquilibrioOsmosi: flusso di molecole di solvente dal solvente puro alla soluzione (in generale dalla soluzione meno concentrata a quella più concentrata) Pressione osmotica: pressione che occorre esercitare sulla soluzione, A, per bloccare il flusso osmotico Membrana semipermeabile P soluzione A B solvente puro flusso di solvente (osmosi)La pressione osmotica è indicata con Tt. Un esempio è anche la pressione esercitata dalla colonna di solvente in questo esperimento: Altezza della colonna di soluzione - Acqua pura 5% zucchero 95% acqua Membrana semi- permeabile (a) (b)Pressione osmotica · In natura consente - il flusso di sostanze attraverso la parete cellulare - il movimento di soluzioni negli organismi vegetali · Il fenomeno può essere evidenziato attraverso lo studio del comportamento di cellule in soluzione · In laboratorio si può mettere in evidenza - il flusso di solvente attraverso una membrana da una soluzione meno concentrata ad un'altra più concentrataMembrana semipermeabile · Si lascia attraversare solo da certi tipi di molecole o di ioni - Naturali · pareti cellulari - Sintetiche · Acetato di cellulosa · Ferrocianuro di rameSoluzione isotonica (iso-osmotica) ha la stessa pressione osmotica Soluzione ipertonica ha una pressione osmotica maggiore dell'altra Soluzione ipotonica ha una pressione osmotica minore dell'altraEritrociti 1. Per funzionare bene hanno bisogno della giusta concentrazione di soluto - soluzione isotonica 2. Se la soluzione è diluita vi entra acqua fino a farli esplodere - soluzione ipotonica 3. Se la soluzione è troppo concentrata cedono acqua raggrinzendosi - soluzione ipertonica 1 2 3L'osmosi protegge da attacchi batterici la carne salata La soluzione salina (ipertonica) disidrata e uccide i batteri privandoli dell'acquaLa pressione osmotica è quella pressione che, aggiunta a quella atmosferica, è necessaria per impedire il passaggio del solvente attraverso la membrana semipermeabile. La pressione osmotica si indica conLegge di van't Hoff Jacobus Henricus van 't Hoff Rotterdam (1852) - Steglitz (1911) Premio Nobel per la Chimica 1901 T = pressione osmotica TV = n RT da cui: T = RT c (c = molarità)La pressione osmotica è una proprietà colligativa ed è proporzionale alla concentrazione molare del soluto M: T= MRT In cui R è la costante dei gas e T è la temperatura assoluta. Si noti l'analogia tra questa equazione e quella per i gas reali, più evidente se si tiene conto che M=n/V e quindi: PV=nRT P=(n/V) RT P=MRT Esempio: Calcolare la pressione osmotica di una soluzione 0,02 M di glucosio a 25℃? T= MRT = 0,02 mol/l×0,0821 l·atm/(K mol)×298 K= = 0,5 atmLa pressione osmotica viene utilizzata per calcolare il peso molecolare di sostanze polimeriche o macromolecole. Problema: 50 ml di una soluzione acquosa contengono 1,08 g di una proteina e presentano una pressione osmotica di 5,85 mmHg a 298 K. Quale è il peso molecolare di tale proteina? La pressione in atmosfere è: P = 5,85 mmHg 760 mmHg/atm = 7,70×10-3 La concentrazione molare della proteina è: T = MRT π RT 7,70 × 10-3 atm = 3,15 x mol / L = 0,0821 L · atm/(K mol) × 298K Il numero di moli della proteina è: M = moli V moli = Mx V = 3,15×10-4mol/L × 50 .10-3L =1,58x10-mol La massa molare della proteina è: massa 1,08 g M = = = 6,84×104 g/mol m moli 1,58 × 10-5 molSoluzioni di Elettroliti Un elettrolita è una sostanza che si scioglie in acqua producendo ioni e formando una soluzione che conduce l'elettricità. Un non-elettrolita è una sostanza che si scioglie in acqua senza produrre ioni e forma una soluzione che non conduce l'elettricità. Un elettrolita può essere un composto ionico o molecolare: NaCl (s) H2O Na+ (aq) + Cl- (aq) Dissociazione HCI (g) + H2O(I) -> H3O+ (aq) + Cl- (aq) Ionizzazione Un non-elettrolita è un composto molecolare che non ionizza Un elettrolita può essere debole o forte Un elettrolita forte è presente in soluzione completamente sotto forma di ioni HCI (g) + H2O(I) -> H3O+ (aq) + Cl- (aq) Elettrolita forteUn elettrolita debole è solo parzialmente ionizzato in soluzione NH3 (g) + H2O(I) > NH4+ (aq) + OH- (aq) Elettrolita debole Electricity source + Graphite rod (a) (b) (c) Molecola di H O lone K lone Cro Molecola di zuccheroProprietà colligative di soluzioni di elettroliti Per spiegare le proprietà colligative di soluzioni di elettroliti si deve tener conto della concentrazione totale di tutti gli ioni piuttosto che della concentrazione dell'elettrolita. Ad esempio l'abbassamento del punto di congelamento di una soluzione di NaCI 0,1 m è (circa) il doppio di quello di una soluzione di glucosio 0,1 m. Ciò perché ogni unità formula NaCI si dissocia in ioni Na+ e CI-, cioè in due particelle che contribuiscono entrambe a tale proprietà colligativa.