Appunti di Chimica: fondamenti, atomo, reazioni ed equilibrio chimico
Documento di Università sulla Chimica, che esplora i fondamenti della materia, la struttura dell'atomo e le reazioni chimiche. Il Pdf, utile per lo studio universitario, copre argomenti come il fenomeno, la materia, l'atomo e l'equilibrio chimico, offrendo una trattazione schematica e discorsiva.
Mostra di più54 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
FENOMENO
- Descrizione microscopica
- Descrizione atomico - molecolare
MATERIA
Sostanze pure
- Sostanze elementari (ossigeno) - si trovano sulla Tavola Periodica Aristotele: aria, fuoco, terra, acqua fino all'800 il termine sostanze pure non era noto, oggi con questo termine si intendono le sostanze che non possono essere scomposte in altre unità
- Composti (acqua ossigeno + idrogeno)
Miscele
- Omogenee (aria, acqua)
- Eterogenee (legno, roccia, latte)
ATOMO
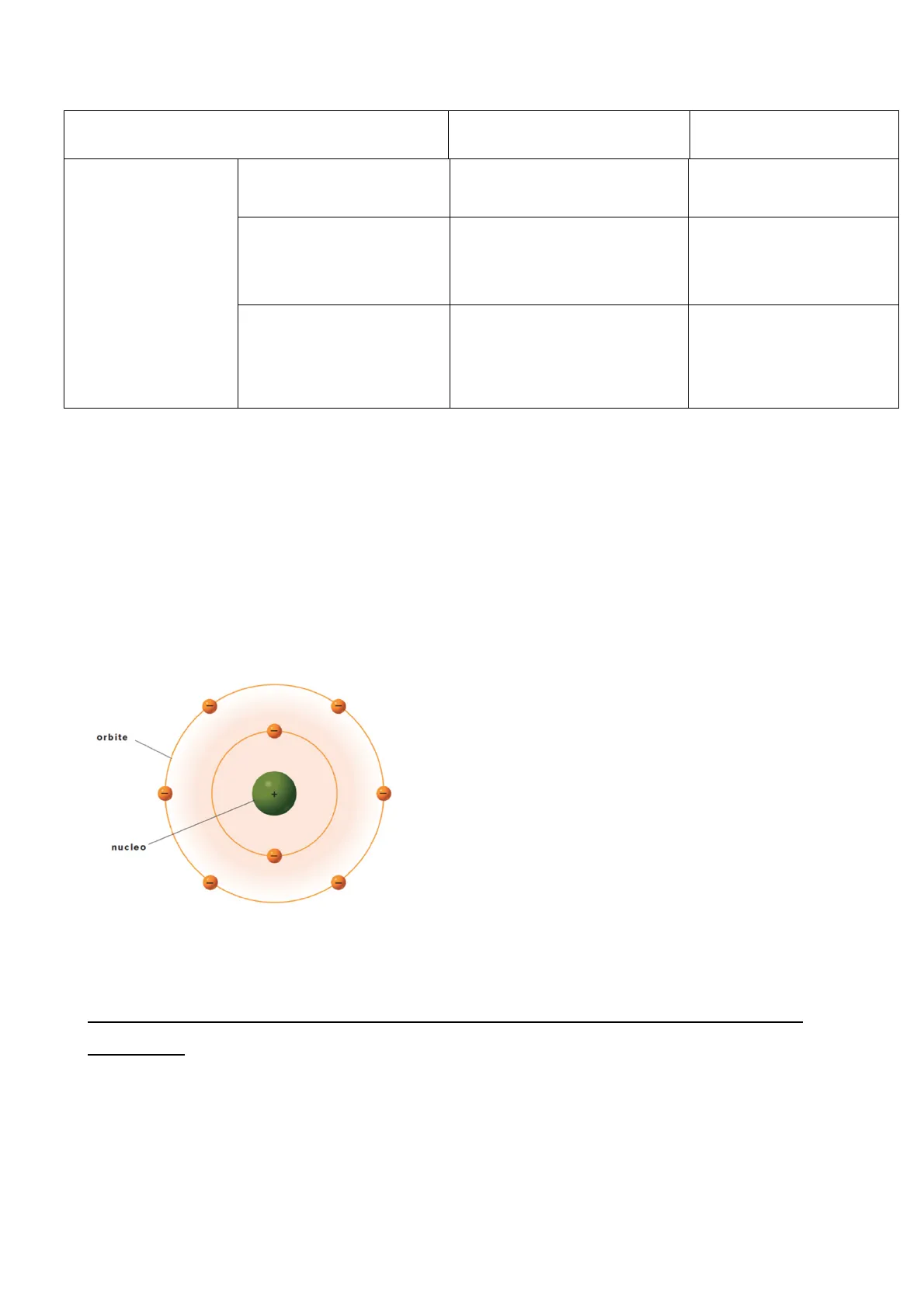
Fin dall'antichità si chiedeva da cosa fosse composta la materia (solida o liquida), nel 600 - 700 vennero scoperti i gas e fino all'800 il concetto di atomo indicava la materia densa; oggi il termine indica le strutture costituite da vuoto che all'interno hanno delle particelle sub-atomiche All'interno del nucleo ci sono i nucleoni (proni ed elettroni), mentre le particelle sulle orbite prendono il nome di elettroni, i quali si caratterizzano per carica (Coulomb) e massa (grammi) Molti elementi sono artificiali, mentre quelli presenti in natura sono circa 90 e ad ogni elemento corrisponde un atomo diversoCarica Massa
Massa di un atomo
Massa di un atomo viene definita da protoni e neutroni e si trova nel nucleo
Protoni (+) 1,602 x 10^-19 1,673 x 10^-24 Neutroni 0 1,675 x 10^-24 Elettroni (-) -1,602 x 10^-19 0,109 x 10^-28 La carica di un atomo è sempre 0 dove una carica positiva ed una negativa si annullano - numero di elettroni = numero di protoni (forza elettrostatica tra elettroni e nucleo) Gli elettroni non cadono nel nucleo perché c'è la forza centrifuga ma in realtà è per un'altra ragione, cioè gli elettroni possono circolare solo su determinate orbite orbite nucleo il modello planetario non è corretto perché le particelle si possono comportare anche come onde elettromagnetiche e non hanno una posizione Gli orbitali sono zone di alta probabilità in cui è possibile trovare un elettrone Es. luce - modo di trasmettere onda luminosa ma a volte si comporta come una particellaLa differenza tra un atomo di un elemento rispetto ad un altro sta nel numero degli elettroni - NUMERO ATOMICO (elettroni e protoni), ogni elemento ha il suo numero atomico Es. H^1= 1 elettrone,1 protone He^2= 2 elettroni, 2 protoni I neutroni servono per stabilizzare il nucleo - gli elettroni sono positivi e si respingono (forza nucleare forte) Neutroni + protoni = NUMERO DI MASSA, ogni elemento ha un numero di elettroni differente
Numero di massa atomica
numero di massa atomica ( A ) simbolo dell'elemento chimico 12 C -6 numero atomico ( Z) WWW.ANDREAMININI.COM Isotopi: stesso numero atomico e diverso numero di massa
UNITÀ DI MASSA ATOMICA
È definita come 1/12 della massa dell'isotopo 1u=1,6605 x 10^-24 g Ogni elemento è costituito da isotopi diversi la cui abbondanza dipende dalla loro stabilità, gli isotopi instabili si trasformano in altri elementi Per definire la massa faccio una media tra le masse isotopiche, cioè degli isotopi Gli atomi possono cedere o acquistare elettroni diventando ioni
- Se perde carica negativa diventa positivo CATIONE
- Se acquista carica negativa diventa negativo ANIONE
ORBITALI
Se ci sono differenze di probabilità sarà maggiore vicino al nucleoAd ogni orbitale è associata un'energia ed è definito da 3 numeri - numeri quantistici 4 tipologie:
- s - sferici con nucleo al centro
- p - costituiti da 2 zone di probabilità ai lati del nucleo e un nodo (probabilità nulla) sul nucleo, l'elettrone non può stare nel nucleo. Esistono 3 orbitali p orientati lungo 3 assi cartesiani aventi stessa energia sottolivello 1 sottolivello 2 sottolivello 3 Z 2 2 1=1 Px Py Pz sull'asse X sull'asse Y sull'asse Z WWW.ANDREAMININL.COM
- d - 4 zone di probabilità e 5 orbitali d orientati in modo diverso ma aventi stessa energia
- f - 7 orbitali f Z N 4 AX S Z Z Z - y y y X X X P.1 Po p. Z Z Z Z Z A ry y y d.2 do d. d. Z Z Z Z Z A y y y y y AX Ax Ax x x f1 f2 f3 f3 f2 fo A. Ax Ax × x × × x Z Z A y1s -2 3p - 6 5d - 10 7d - 14 Gli elettroni riempiono gli orbitali seguendo delle regole, gli orbitali sono organizzati in livelli energetici all'interno del nucleo e man mano che ci allontaniamo da esso l'energia e la distanza aumentano
- livello 4: 1s,3p,5d,7f - 4s,4p,4d,4f (sottolivelli)
- livello 3: 1s,3p,5d - 3s,3p,3d
- livello 2: 1s,3p - 2s,2p
- livello 1: 1s - 1s l'energia dei livelli non è fissa ma dipende dall'atomo gli elettroni che occupano i livelli sono di 2 tipologie le quali hanno uno spin(verso) opposto, in ogni sottolivello possono coesistere 2 orbitali con spin opposto 11 spin opposto TTT spin parallelo il senso di rotazione è indicato da un 4°numero quantico, ruotando gli elettroni generano un piccolo campo magnetico es. H - 1s - 1 orbitale che contiene 1 elettrone He - 2s - 1 orbitale che contiene 2 elettroni Orbitali degeneri: orbitali aventi la stessa energia
DISPOSIZIONE DEGLI ELETTRONI
In 1 atomo non eccitato (stato fondamentale) gli elettroni si dispongono sempre uguali sugli orbitali liberi a minor energia, se esistono più orbitali con la stessa energia si dispongono in modo da occupare il maggior numero possibile
CONFIGURAZIONE ELETTRONICA ESTERNA
È la disposizione degli elettroni nell'ultimo livello, quello più esterno Es. N 1s^2,2s^2,3p^3 F 1s^2,2s^2,3s^2,3p^3 Stessa configurazione elettronica esterna e hanno caratteristiche chimiche simili Può essere rappresentata con la simbologia di Lewis, dove il max degli elettroni intorno al nucleo è 8 (ottetto) 1 elettrone 2 elettroni 3 elettroni 4 elettroni X- X × 5 clicttroni 6 elettroni 7 cicttroni 8 cicttroni ·X: X: X: . : XE WWW.ANDREAMININI.ORG Es S=zolfo 3s^2 3p^4 - 6 elettroni nel livello 3 I=iodio 5s^2 5p^5 - 7 elettroni nel livello 5(livello esterno) In base al gruppo di appartenenza corrispondono gli elettroni nella configurazione elettronica esterna (orbitali s e p)
Tavola Periodica
Nasce a fine 800 da Mendel in un periodo in cui non si conoscevano né gli atomi né gli elementi, la costruì andando a studiare le proprietà degli elementi e si accorse che andando ad elencare gli elementi conosciuti in ordine di massa cerano degli elementi che avessero proprietà simili e lo metteva uno sotto l'altro ottenendo una scacchiera secondo massa oggi secondo numero atomico con dei gruppi di elementi con proprietà simili. Ordinandoli sulla base della massa cerano dei buchi perché gli elementi non erano ancora stati scoperti La tabella che abbiamo oggi serve per capire le proprietà chimiche degli elementi in base alla loro posizione
- gruppi (verticale) - ogni gruppo contiene elementi con simili proprietà
- periodi (orizzontale) - primo periodo ha delle caselle vuote e ne fanno parte solo 2 elementi, è una tabella non regolare Gli elementi con proprietà simili
- I gruppo alcanini tranne idrogeno
- Il gruppo alcanino terrosi - questi due gruppi insieme formano il blocco s (orbitale sferico s)
- Il blocco centrale hanno proprietà simili e contengono elementi che prendono il nome di metalli, tutto questo blocco prende il nome di blocco d o metalli di transizione
- Il blocco a destra fa parte del blocco p e contiene elementi con proprietà molto diverse (es. ossigeno e piombo), ma sono molto importanti per la chimica della vita
- Il penultimo gruppo è il gruppo degli alogeni
- l'ultimo contiene dei gas non reattivi detti gas nobili
- gli elementi sotto sono gli elementi del blocco f, sono quasi tutti artificiali o radioattivi e ricordiamo l'uranio tutti gli elementi possono essere suddivisi in 2 grandi categorie:
- metalli - elementi a sinistra come ferro, piombo, sodio
- non metalli - elementi a destra, sono molto pochi ma importanti Oggi la tabella elenca gli elementi per ordine atomico, ogni volta che ci spostiamo di una casella aumenta un elettrone e un protone Conoscendo quanti sono gli elettroni e i protoni possiamo costruire gli atomi Leggendo il gruppo di appartenenza degli elementi definisco gli elettroni esterni e questa regola vale solo per elementi del blocco s e p Le proprietà chimiche derivano dalla configurazione elettronica esterna, gli elementi quando reagiscono scambiano elettroni ovvero quelli del livello esterno, ci sono grandi differenze:
- i gas nobili non li scambiano perché sono stabili
PROPRIETÀ PERIODICHE
le proprietà periodiche sono proprietà che variano periodicamente aumentando numero atomico e gli elettroni man mano saranno sempre più lontani dal nucleo, esse dipendono dagli elettroni esterni ovvero delle particelle negative attratte dal nucleo positivo sono 3:
- raggio atomico
- energia di ionizzazione
- affinità elettronica nel caso dei periodi aumenta la carica e aumenta la forza attrattiva diminuendo le dimensioni, mentre nei gruppi gli elettroni sono sempre più esterni e più lontani dal nucleo (meno attratti dal nucleo e più liberi) raggio atomico: si definisce sperimentalmente, la distanza tra due atomi identici diviso 2
es. prendo grafite e misuro distanze atomiche e divido a metà ottenendo la misura di un atomo
- aumenta lungo i gruppi
- diminuisce lungo i periodi energia di ionizzazione: si misura sperimentalmente ed è l'energia necessaria per strappare un elettrone dall'atomo (per portare elettrone da un atomo ad uno spazio infinito), oppure energia necessaria per formare un catione (es. Na+) gli elementi tendono a cedere gli elettroni esterni ma cedono con grande difficoltà gli elettroni interni
- aumenta lungo i periodi
- diminuisce lungo i gruppi perché è sempre più facile estrarre elettroni gli elementi in basso a sinistra hanno maggiore predisposizione a diventare positivi cedendo elettroni(cesio), quelli a destra non danno ioni positivi affinità elettronica: è l'energia associata alla formazione di un aione cioè all'acquisizione di un elettrone, ha lo stesso andamento dell'energia di ionizzazione per ragioni simili
- aumenta lungo i periodi
- diminuisce lungo i gruppi elementi a sinistra bassa affinità elettronica elementi in basso a destra grande tendenza a formare cationi
Regola dell'ottetto
Regola che ci aiuta a definire gli elementi che cedono e quelli che acquistano elettroni, vale solo per il blocco s e del blocco p