Chimica come scienza sperimentale: radioattività e modello atomico
Slide da Università su Chimica Scienza Sperimentale. Il Pdf esplora il metodo scientifico, la radioattività con le scoperte di Rutherford e il modello atomico di Thompson, noto come 'modello a panettone', per studenti universitari di Chimica.
Mostra di più60 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Chimica: Scienza Sperimentale
CHIMICA = Scienza Sperimentale
Una "Scienza Sperimentale" è basata sui fatti, così come una casa è fatta di mattoni o pietre. Tuttavia, un mucchio di mattoni o pietre non è necessariamente una scienza sperimentale. Henri Poincaré 1854-1912
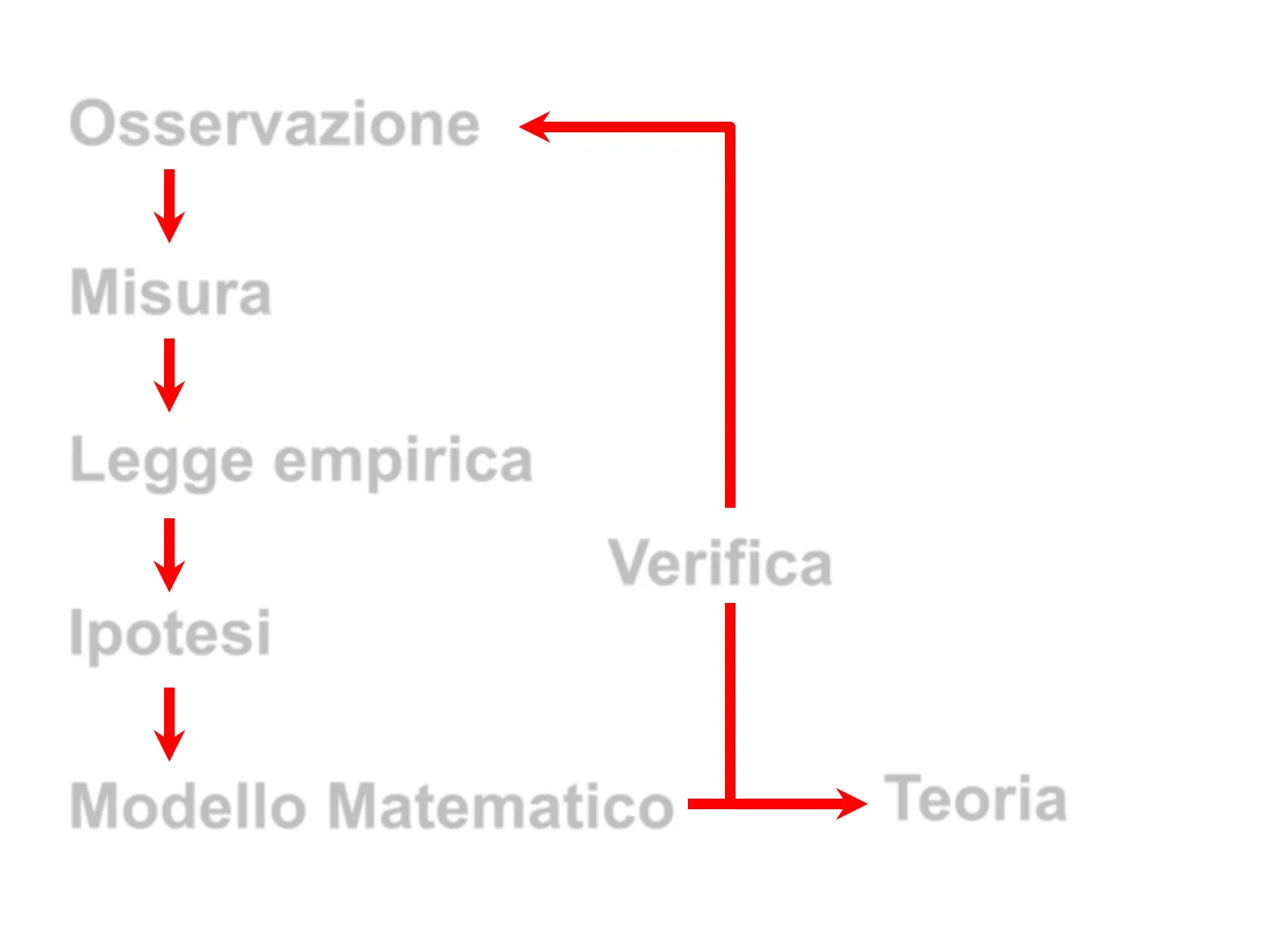
Metodo Scientifico
Osservazione Misura Legge empirica Verifica Ipotesi Modello Matematico Teoria
Osservazione Misura Legge empirica Ipotesi Verifica Modello Matematico Te a
Proprietà della Materia
L'Universo è composto da materia ed energia radiante La chimica è la scienza che si occupa della STRUTTURA della materia, delle sue proprietà e delle sue possibili TRASFORMAZIONI (REAZIONI CHIMICHE) e della energia associata a queste trasformazioni.
Classificazione della Materia
MATERIA MISCELE tecniche fisiche: SOSTANZE OMOGENEE ETEROGENEE centrifugazione distillazione filtrazione tecniche chimiche COMPOSTI (molecole) ELEMENTI (molecole o atomi) anidride carbonica, acqua, sale, zucchero oro, carbonio, ossigeno, mercurio
La Chimica come Disciplina Scientifica
La Chimica, come disciplina scientifica, è nata quando dalle conoscenze empiriche e dalle considerazioni astratte (alchimia), si è passati ad uno studio sistematico e scientifico delle osservazioni sperimentali.
Definizione di Elemento
Robert Boyle (1627-1691) "Un elemento è una sostanza materiale che aumenta di peso in ogni trasformazione chimica" The Sceptical Chymist (1661)
Antoine Lavoisier e la Conservazione della Massa
Lavoisier nel suo laboratorio, mentre analizza l'aria espirata e inspirata da un uomo. Al tavolino c'è la moglie che registra i dati sperimentali. Antoine Lavoisier 1743-1794
deux parties d'eau, et que la dissolution s'opère à froid, c'est-à-dire à la température moyenne de l'atmosphère, et aux environs de 10 degrés, on aura en fractions décimales, la quantité d'acide étant supposée d'une livre, (olivre, 2 7 + o livre, 058 () + 2 livres, 5 + (olive, 25 0 + o livre, 25 AF - o livre, 058 0 - olivre, 058 AF), ce qui se réduit à (olivre, 2 07 + olive, 058 0) + (2 livres, 5 7) + (olivre, 192 ) + olivre, 192 A). et en fractions vulgaires, 1 liv. 507 + 500 liv. $)+ (2 ) : ) + 24liv. 125 0 24liv. Le tableau ci-après présente le résultat de toute cette opération, en livres, onces, gros et grains. Les quantités de matière, avant l'expérience, étaient : EN FRACTIONS VULGAIRES. Livres. Onces. Gros. Grains. EN FRACT, DÉCIM. Livres.
Legge di Lavoisier
Legge di Lavoisier: "In una reazione chimica la massa totale si conserva " (la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti) 2 g di Idrogeno + 16 g di Ossigeno = 18 g di Acqua
Massa e Peso
Massa (m) La materia possiede una MASSA. Ogni porzione di materia sulla superficie della terra, per effetto della forza di gravità, è attratta verso il centro della terra ed ha un PESO. Peso = m x g (Legge di Newton)
Legge di Proust
Joseph-Louis Proust (1754-1826) Legge di Proust (o delle proporzioni definite): "Un composto chimico è formato da elementi sempre nella stessa proporzione in peso, indipendentemente da come sia stato sintetizzato"
Esempi di Proporzioni Definita
Acqua 11,1% di idrogeno e 89,9% di ossigeno Cloruro di sodio 60,7% di cloro e 39,3% di sodio
Anidride Carbonica: Carbonio: 27,3 % Ossigeno: 72,7 % Ossido di Carbonio: Carbonio: 42,9 % Ossigeno: 57,1 %
Legge delle Proporzioni Multiple
Legge delle proporzioni multiple: "Se due elementi formano più di un composto, le differenti masse di uno che si combinano con la stessa massa dell'altro stanno tra di loro come numeri piccoli interi" Anidride Carbonica: Ossido di Carbonio: Carbonio: 1,000 g Carbonio: 1,000 g Ossigeno: 2,663 g Ossigeno: 1,331 g 2,663:1,331 = 2 :1 CO2 CO
ossigeno idrogeno ELEMENTS D # carbonio H I 0 0 14 # 0 54 OO 000 000.000 ossido di acqua 50 carbonio Lungoway & Soonap 54 John Dalton (1766-1844) anidride carbonica 17 7 0 F
Teoria Atomica di Dalton
Teoria Atomica di Dalton Esistono atomi indivisibili Atomi di diversi elementi hanno masse differenti Gli atomi si combinano secondo numeri interi per formare i composti
Determinazione di Masse Atomiche e Formule Chimiche
Determinazione simultanea di masse atomiche relative e di formule chimiche Dalton ricorse alla regola della massima semplicità: Le molecole sono molto semplici e la combinazione di atomi 1:1 deve sempre esistere
Legge di Avogadro
Lorenzo Romano Amedeo Carlo Avogadro conte di Quaregna e di Cerreto (1776 - 1856) Legge Avogadro: "Volumi uguali di gas, alla stessa pressione e temperatura, contengono ugual numero di molecole.
"2 volumi di idrogeno + 1 volume di ossigeno > 2 volumi di vapor d'acqua 2H + 2HO 2H2 + O2 > 2H2O 1 volume di azoto + 1 volume di ossigeno > 2 volumi di ossido di azoto N2 + O2 > 2NO 3 volumi di idrogeno + 1 volume di azoto -> 2 volumi di ammoniaca 3H2 + N2 > 2NH3
Simbologia Moderna
Il Nuovo Cimento, vol. VII (1858), pag. 321-366 Acqua: H2O Cloruro d'etile: C2H5Cl Stanislao Cannizzaro (1826-1910) Simbologia moderna: Acqua: H2O 2 Cloruro d'etile: CHCI
Atomi, Molecole e Ioni
Nucleo: possiede praticamente tutta la massa dell'atomo ed è formato da protoni (carica positiva) e da neutroni (nessuna carica), che hanno massa molto simile. Elettroni: hanno una massa praticamente trascurabile rispetto a quella di protoni e neutroni ed hanno carica negativa. Ruotano intorno al nucleo.
Esperimenti con i Tubi Catodici
Elettrone (-) (+) (-) Electrically charged plates N S (+) Fluorescent screen Electron paths High voltage Magnet • tubi catodici emettono fasci di particelle cariche negativamente · J. J. Thompson (1897) · Rapporto carica/massa 1,76 x 1011 C/kg.
Esperimento di Millikan
Esperimento di Millikan Noto il rapporto carica/massa determinare uno dei due equivaleva ad ottenerli entrambi Oil spray Atomizer (+) Source of X rays (ionizing radiation) C Viewing microscope CO Electrically charged plates Robert Millikan - 1909 e = 1,602 × 10-19 C
Radioattività
Radioattività · L'emissione spontanea di radiazioni da parte di un nucleo instabile. · Scoperta da Henri Becquerel. · Studiata da Marie e Pierre Curie.
Tipi di Radiazioni Nucleari
Radioattività · Ernest Rutherford individuò 3 tipi di radiazioni nucleari: - Particelle a - Particelle B - Raggi y Lead block (+) ß rays y rays a rays (-) Radioactive substance Electrically charged plates Photographic plate
Modello Atomico Iniziale
L'Atomo, circa 1900: Negative electron · Modello a panettone di Thompson. · Una sfera di materia carica positivamente contenente gli elettroni carichi negativamente Positive charge spread over sphere
La Scoperta del Nucleo
La scoperta del nucleo Some « particles are scattered Most a particles are undeflected Thin gold foil Beam of particles Circular fluorescent screen Source of « particles Ernest Rutherford fece collidere particelle & contro un sottile foglio di oro ed osservò le particelle diffuse
Il Nucleo Atomico
Il nucleo atomico La maggior parte delle particelle sono deflesse a grandi angoli (in avanti, oltre il foglio di oro) quindi il modello di Thompson non è corretto Incident a particles ( Nucleus ( Atoms of gold foil 1
Il nucleo atomico · Rutherford postulò l'esistenza di un nucleo molto piccolo con gli elettroni diffusi intorno a grandi distanze. · La maggior parte del volume di un atomo è spazio vuoto Volume occupied by electrons ~10-4Å Nucleus containing protons and neutrons Atoms 1-5Å
Particelle Subatomiche
Particelle subatomiche · Protoni ed elettroni sono le uniche particelle a possedere carica elettrica. · Protoni e neutroni possiedono essenzialmente la stessa massa. · La massa dell'elettrone è così piccola da essere spesso trascurata. Particle Charge Mass (amu) Proton Positive (1+) 1.0073 Neutron None (neutral) 1.0087 Electron Negative (1-) 5.486 × 10-4
Simboli Chimici degli Elementi
I simboli chimici degli elementi Mass number (number of protons plus neutrons) 7 12 6 C Symbol of element Atomic number (number of protons or electrons) In genere si usano una o due lettere Cu, Fe, U, Ca, O, N, ....
Il Numero Atomico
Il Numero Atomico Mass number (number of protons plus neutrons) 12( 6C Symbol of element Atomic number (number of protons or electrons) Tutti gli atomi dello stesso elemento hanno lo stesso numero di protoni (e di elettroni): Il numero atomico (Z)
Il Numero di Massa
Il Numero di Massa Mass number (number of protons plus neutrons) 12 C Symbol of element Atomic number (number of protons or electrons) Il numero di massa (A) rappresenta il numero totale di protoni e neutroni contenuti nel nucleo
Gli Isotopi
Gli Isotopi: · Atomi dello stesso elemento con massa differente · Gli isotopi hanno un differente numero di neutroni. 12 6 C 13 6 C 14 6 C
Massa Atomica
Massa Atomica Magnet Detector Accelerating grid N 37C1+ (- (-) S A 35C1+ C Beam of positive ions Slit Sample B (+) Separation of ions based on mass differences Ionizing electron beam To vacuum pump Masse atomiche e molecolari si misurano con estrema accuratezza usando gli spettrometri di massa. Heated filament
Unità di Massa Atomica
Unità di Massa Atomica 1/12 della massa di 12C 1 u.m.a. = 1,661×10-27 kg È comodo definire una unità di massa atomica che abbia un valore confrontabile con quello degli atomi massa 12C = 1,9932 ×10-26 kg = 12,000 u.m.a.
Alcune Masse Atomiche in u.m.a.
Alcune masse atomiche in u.m.a. H 1,008 Na 22,990 He 4,003 Mg 24,305 Li 6,941 Al 26,981 Be 9,012 Si 28,086 B 10,811 S 30,974 C 12,011 P 32,066 N 14,007 Cl 35,453 O 15,999 Ar 39,948 F 18,998 K 39,098 Ne 20,180
Abbondanza Isotopica Naturale
Abbondanza Isotopica Naturale · idrogeno 1H 99.985 % deuterio 2H (D) 0.015 % trizio 3H (T) Elio 3 3He 0.000137% Elio 4 4He 99.99% Litio 6Li 7.5 % Litio 7Li 92.5 % Carbonio 12 12C 98.892 % Carbonio 13 13C 1.108 %
Massa Atomica Media
Massa Atomica Media L'isotopo 12 del carbonio 12C pesa esattamente 12 L'isotopo 13 del carbonio 13C pesa 13.00335 Carbonio naturale 98.892 % 12C 1.108 % 13C Abbondanza relativa (A%): 98.892/100 = 0.98892 12C 1.108/100 = 0.01108 13C Massa atomica relativa in natura: M = MX(A%1)+M2X(A%2)+ ... +Mnx(A%n) Carbonio > M = 12x0.98892 + 13.00335x0.01108 = 12.011
La Tabella Periodica
La Tabella Periodica: 1A 1 8A 18 3A 13 4A 14 5A 15 6A 16 7A 17 2 He 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3 11 Na 12 Mg 3B 3 4B 4 5B 5 6B 6 7B 7 8 9 10 1B 11 2B 12 13 A1 14 Si 15 P 16 S 17 CI 18 Ar 4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5 37 Rb 38 Sr 40 Zr 41 Nb 42 Mo 43 Tc 44 45 Rh 46 Pd 47 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6 55 Cs 56 Ba 71 Lu 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 TI 82 Pb 83 Bi 84 Po 85 At 86 Rn 7 87 Fr 88 Ra 103 Lr 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 111 112 113 114 115 116 Metals 57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb Metalloids 89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 No Nonmetals · Una catalogazione sistematica degli elementi. · Gli elementi sono ordinati per numero atomico crescente. Dimitry Ivanovich Mendeleyev (1834 - 1907)