Proprietà generali delle molecole in chimica farmaceutica e organica
Documento sulle proprietà generali delle molecole. Il Pdf esplora concetti chiave di chimica organica e farmaceutica, come acidità, basicità, elettrofili, nucleofili e gruppi attivanti/disattivanti, con esempi pratici e schemi utili per lo studio universitario della materia.
Mostra di più11 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Proprietà Generali delle Molecole
Anna De Rossi Ripasso - 16/10 PROPRIETA' GENERALI DELLE MOLECOLE Esiste un grosso parallelo tra i concetti della chimica farmaceutica e quelli della sintesi organica: spesso parliamo della stessa cosa utilizzando terminologie diverse o analizziamo la stessa caratteristica della molecola in entrambi gli ambiti.
Chimica Farmaceutica
- Donatori o accettori di ponti idrogeno: importante saperlo perché può stabilire un certo tipo di interazione con il target; esempio se il farmaco ha un gruppo NH2 è facile pensare che serva per instaurare un legame con I'NH ammidico del backbone della proteina -> NH2 è accettore di ponte idrogeno
- Acido - base: a seconda del composto avrà un comportamento e caratteristiche diverse in base al pH (solubilità, stabilità, ecc).
- Gruppi labili: il più classico è l'estere; ogni volta che nella molecola ho una funzione facilmente idrolizzabile, posso pensare che la molecola sia un profarmaco o che venga utilizzato per un rilascio lento.
- Lipofilia: farmaco che può entrare in SNC (esempio: antistaminici di vecchia generazione)
- Idrofilia: farmaco che non supera la barriera ematoencefalica
Sintesi Organica
- Elettrofili o nucleofili : esempio NH2 è nucleofilo e tenderà ad agire con tutti gli atomi che hanno carica parziale positiva (come H+ -> formazione del ponte idrogeno e salificazione) Donatore ponte H = elettrofilo Accettore ponte H = nucleofilo
- Salificabile (work-up) e reattività (pH della reazione) : il fatto che la molecola abbia proprietà acido-base significa che ad un certo valore di pH è salificabile: esempio se la molecola ha una funzione carbossilica so che ad un pH alcalino si forma il sale. Il fatto di essere salificabile influenza la solubilità in acqua (i sali sono solubili) e questo ha un grosso effetto sul work-up della reazione (serie di operazioni, processo che permette di ottenere il composto puro).
- Stabilità (work-up): se la molecola ha gruppi labili devo tenere conto della stabilità: esempio se la molecola ha un gruppo estereo non posso portarla a pH troppo alti/bassi perché si idrolizza (devo mantenerla integra). min 12
- Solubilità in solventi organici : molecole lipofile sono solubili in solventi organici
- Solubilità in acqua
Proprietà Acido-Base
Quando parliamo di acidità in chimica organica, abbiamo la possibilità di fare questa considerazione: ogni volta che è presente un N nella molecola, questo tende a dare basicità tranne nel caso delle ammidi che donano acidità (esempio: un gruppo piridinico conferisce alla molecola proprietà basiche); l'O tende invece a dare acidità, tranne del caso di eteri ed esteri che sono neutri. Quando una molecola ha una funzione basica e una acida, nel complesso la tratto come neutra.
211 BASICA 2I OH ACIDA CH3 ACIDA 0 OH BASE ACIDOAnna De Rossi
Valore di pKa
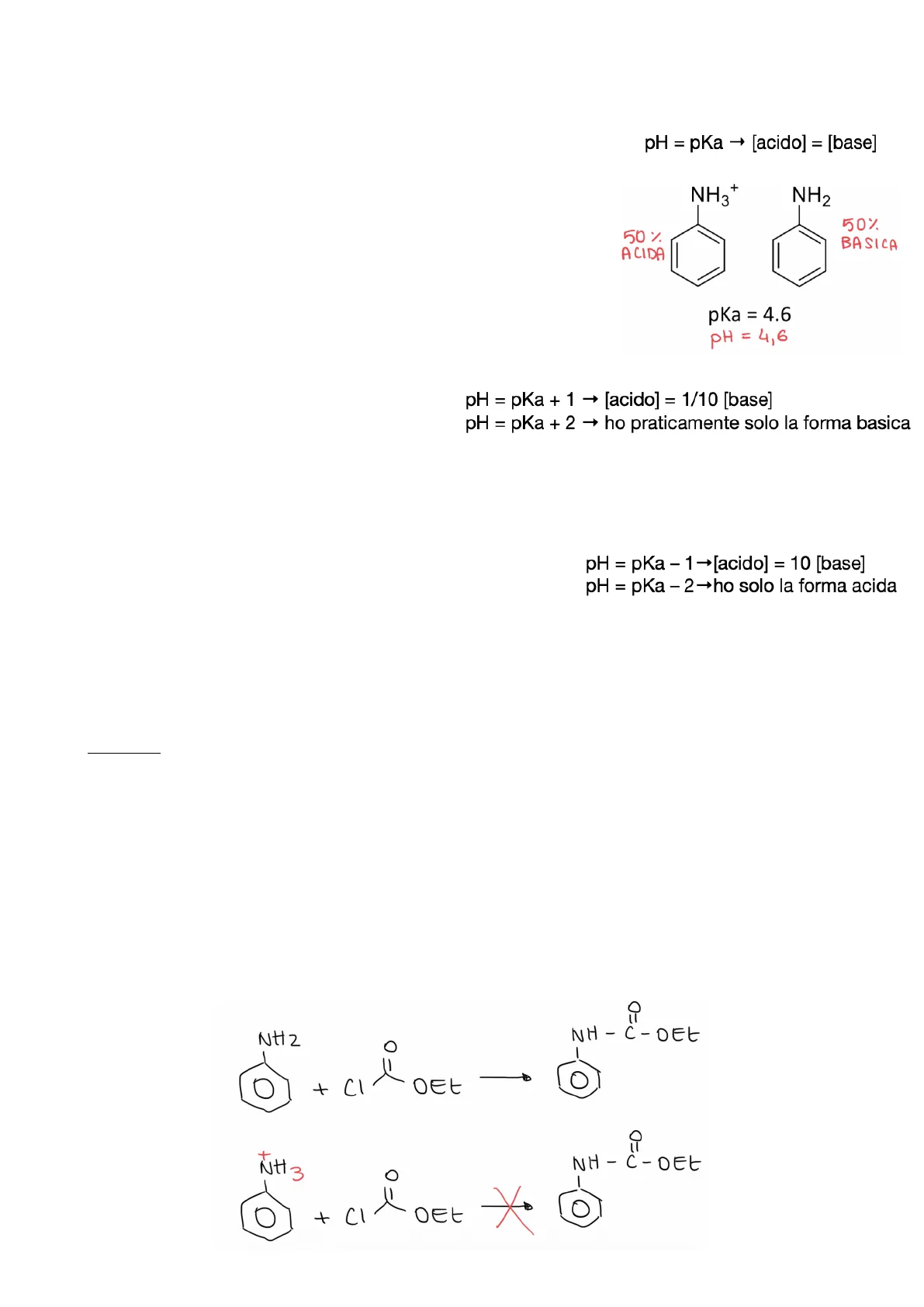
pKa Determina valore di pH al quale una molecola si trova metà in forma basica e metà in forma acida. Esempio: se l'anilina ha pKa=4,6 e la pongo in una soluzione acquosa a pH=4,6, essa si troverà al 50% in forma acida e al 50% in forma basica. pH = pKa - [acido] = [base] NH3+ NH2 50% ACIDA 50% BASICA pKa = 4.6 PH = 4 , 6 Quando ci poniamo ad un pH uguale e a pKa+1, la concentrazione dell'acido è 1/10 della concentrazione della base; Quando è uguale a pKa+2 esiste quasi solo al forma basica. pH = pKa + 1 -+ [acido] = 1/10 [base] pH = pKa + 2 - ho praticamente solo la forma basica Esempio: a che pH mi devo porre per avere l'anilina in forma quasi tutta basica? 4,6+2=6,6. Quando ci poniamo ad un pH uguale e a pKa-1, la concentrazione dell'acido è 10 volte quella della base; pH = pKa - 1-+[acido] = 10 [base] pH = pKa - 2-ho solo la forma acida Quando è uguale a pKa-2 esiste quasi solo al forma acida. Esempio: se voglio avere l'anilina in forma acida mi devo porre ad un pH di 4,6-2=2,6. NB: E' importante conoscere il pKa delle molecole e il pH a cui le devo porre perché potrebbe cambiare completamente la loro reattività: se mi trovo ad un pH>pKa prevale la forma basica, ad un pH<pKa prevale quella acida e in base a questo la molecola potrebbe essere più o meno nucleofila e cambiare reattività. In generale: - Per una base (solitamente ammine), maggiore è pKa maggiore è la basicità; - Per un acido (alcoli ed ammindi) maggiore è la pKa minore è l'acidità. Esempio: non posso sintetizzare la benzocaina con anilina e etilecloroformiato perché l'estere si lega all'azoto. Se io però svolgo la reazione ad un pH inferiore a 4,6 tendo ad avere la forma acida NH3+, la quale non può reagire con l' etilecloroformiato perché l'azoto non ha più il doppietto disponibile e non è più nucleofilo, per questo motivo non può subire l'attacco dal carbonio. -> a seconda del pH posso rendere più o meno nucleofila la molecola! =0 NH2 O + Cl. OEt + NH 3 NH-C-OEt O + CI O OEt X NH-C-OEt 23COOH 0 NH2 Anna De Rossi Esempio: se io volessi sapere se questa molecola è più acida o più basica dovrei confrontare la pKa dei due gruppi funzionali: l'acido benzoico ha pKa=4,2; l'anilina ha pKa=4,6 -> la pKa sono quasi uguali quindi possiamo dire che l'acido p-amminobenzoico è tanto acido quanto basico, quindi lo consideriamo neutro. Quando osserviamo la molecola dobbiamo tenere conto non solo della pKa (quindi acidità) ma anche della nucleofilia per sapere se si ha la possibilità di formare ponti idrogeno. Questi due concetti, acidità e nucleofilia, sono sovrapponibili ma non uguali: aumentando pKa aumenta l'efficienza nell'accettare i ponti idrogeno, ma non è detto che aumenti in modo lineare anche la nucleofilia!
NH2 HN N N pKa 4.6 4.9 5.2 5.2 H-accettore + ++ +++ +++ Nucleofilia ++ +++ + ++ Lipofilia + ++ +++ + Esempi nucleofilia: - L'anilina è un buon nucleofilo e la posso acilare facilmente; - La metilanilina è più basica e più nucleofila e posso farla reagire con un elettrofilo più velocemente; - La dimetilanilina, ancora più basica, non è più nucleofila perché N ha già raggiungo il numero massimo di legami (N alifatico tende a farsi quaternarizzare molto difficilmente, accetta solo H+); - La piridina invece tende a farsi protonare/acilare facilmente perché la carica positiva dell'azoto viene mitigata dal fatto che si trova in un anello aromatico. Quindi aumenta la scala di basicità all'aumentare di pKa ma non aumenta la nucleofilia. Un atomo di azoto già quaternarizzato non è nucleofilo a meno che non sia in un anello a 6 termini. La lipofilia è molto poco predicibile al di fuori di una serie omologa. Da anilina a dimetilaniilna aumentano le catene alchiliche e aumenta anche la lipofilia, con la piridina però facciamo più fatica a capire come potrebbe essere. In generale gli eterocicli azotati tendono ad essere molto meno liofili rispetto alle corrispondenti ammine aromatiche. BASE = accettore di ponti H dal punto di vista farmaceutico = nucleofilo (fino al numero massimo di legami) dal punto di vista della sintesi organica; ACIDO = donatore ponti H dal punto di vista farmaceutico = elettrofilo dal punto di vista della sintesi organica;
24Anna De Rossi Ripasso - 19/10
Effetto dei Gruppi Elettronattrattori
I gruppi elettronattrattori riducono la basicità - riducono la nucleofilia dell'atomo di azoto; Esempio: l'anilina ha un pKa di 4,6 ma nel momento in cui ci lego un elettron attrattore riduco la nucleofilia dell'atomo di azoto e il suo doppietto non è più disponibile ad attaccare un elettrofilo perchè è condiviso con il gruppo carbonilico. Per questo motivo l'ammide (in questa reazione e in queste condizioni) non è più reattiva. Avendo una pKa maggiore di 14, non è deprotonabile in acqua. Nel momento in cui trasformo un'ammina in un ammide, trasformo il gruppo da basico ad acido.
E + Et D : NH2 pKa = 4.6 HN Ammina = Base Ammide = Acido Gruppi elettronattrattori aumentano l'acidità - aumentano la nucleofilia di O e C. Esempio atomo O: il metanolo è un acido debolissimo e non lo posso deprotonare in soluzione acquosa (dove il pH massimo raggiungibile è 14). Nel momento in cui aggiungo un gruppo elettron attrattore trasformo l'alcol in acido carbossilico (acido acetico in questo esempio), aumenta l'acidità e si abbassa pKa e diventa deprotonabile in acqua.
PH MAX = 14 ( H2O) C H3C OH pka =15.5 NON DEPROT. D OH pKa = 4.8 DEPROT IN H2O Esempio atomo C: il propano ha una pKa altissima e gli idrogeni dell'atomo di C centrale non possono essere staccati (non possiamo aumentare la nucleofilia perchè non possiamo aggiungere una carica negativa in quel C). Aggiungendo un gruppo elettron attrattore aumenta l'acidità, la pKa si riduce e si arriva ad un valore simile a quello di un ammide. Aggiungendo un ulteriore gruppo elettron attrattore la pKa crolla ancora di più e posso deprotonare il carbonio in acqua. Quando riconosco una molecola di questo tipo (metilene in mezzo a due elettron attrattori) posso pensare che gli atomi di idrogeno legati al C centrale siano particolarmente acidi e, ponendo la moleocla in ambiente basico, riesco a strappare uno dei due, attribuendo al carbonio una carica negativa e rendendo possibile un suo attacco verso un elettrofilo.
pKa =51.0 H pKa = 26.5 Hm R ER H CH3 C H C 11 O O O DEX DEPROT . IN H2O pKa = 11.0 R H3C # CH3 - X=y (e- AITRAITORE. pKa = 21.6NB: ponendo il metanolo in una soluzione acquosa basica, la percentuale di deprotonazione rimane comunque bassissima ed irrilevante. Se mi pongo a pH=pKa-1, quindi pH circa 14, ho il 90/91% della forma acida metanolo, e il 9/10% della forma basica deprotonata. Anna De Rossi
PH = pka - 50% A 50% B PH=pKa-7 90% MeOH 10% MeO-
Regole Generali di Reattività
In generale, possiamo riassumere il tutto in 3 regole:
- Eteroatomi sono sempre nucleofili: N tende ad essere nucleofilo perchè ha un -N 1 - - 0- doppietto elettronico disponibile; O ha due doppietti elettronici disponibili; Unica eccezione: N+ -+ elettrofilo ma non reattivo; posso avere N+ in due situazioni: - N quaternarizzato per protonazione: non avendo più il doppietto elettronico disponibile, perchè impiegato per la protonazione, non è più reattivo nei confronti degli elettrofili; E' comunque nucleofilo perchè, in presenza di gruppi con carica negativa, tende a salificare. R * DEX 1 R- N - H R3N + HCI = R3NH+ + Cl- - N del gruppo nitro: anche in questo caso il doppietto elettronico non è più disponibile e il nitro gruppo diventa non reattivo nei confronti degli elettrofili (l'unica reazione che può dare è quella di riduzione). R- N R - N = 0 + 0- - O C17 A NO 2 Il Carbonio può essere elettrofilo o nucleofilo a seconda delle condizioni in cui si trova (stato redox): il carbonio non ha doppietti elettronici, può assumere carica parzialmente negativa e comportarsi da nucleofilo o parzialmente positiva e comportarsi da elettrofilo.
- Eteroatomi aumentano la loro nucleofilia se sono carichi negativamente: R-NH- > R-NH2 : un atomo di azoto carico negativamente è più nucleofilo di un'ammina R-O- > R-OH : un alcolato è più nucleofilo e più reattivo di un alcol
- In generale, l'ordine di reattività degli eteroatomi è : R-NH- = R-O- > R-NH2 >> R-OH - Alcoli reagiscono solo se deprotonati (pH > pKa) : dobbiamo essere in condizioni sufficientemente basiche per poter depotonare l'alcol; esempio: non possiamo fare la reazione di alchilazione degli alcoli in acqua perchè non raggiungiamo un pH tale per cui la deprotonazione avviene in modo efficiente. Quindi, per fare reagire l'ossigeno di un alcol devo andare ad un pH superiore alla sua pKa. R-OH + R'-CI = R-O-R'
26