Le basi della chimica: atomo, numero atomico e isotopi da Hub Scuola
Slide da Hub Scuola su Le Basi della Chimica. Il Pdf, adatto per la scuola superiore, esplora la materia e la composizione dell'atomo, le cariche elettriche, il numero atomico e di massa, e gli isotopi, con esempi specifici sul carbonio.
Mostra di più22 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Le basi della chimica
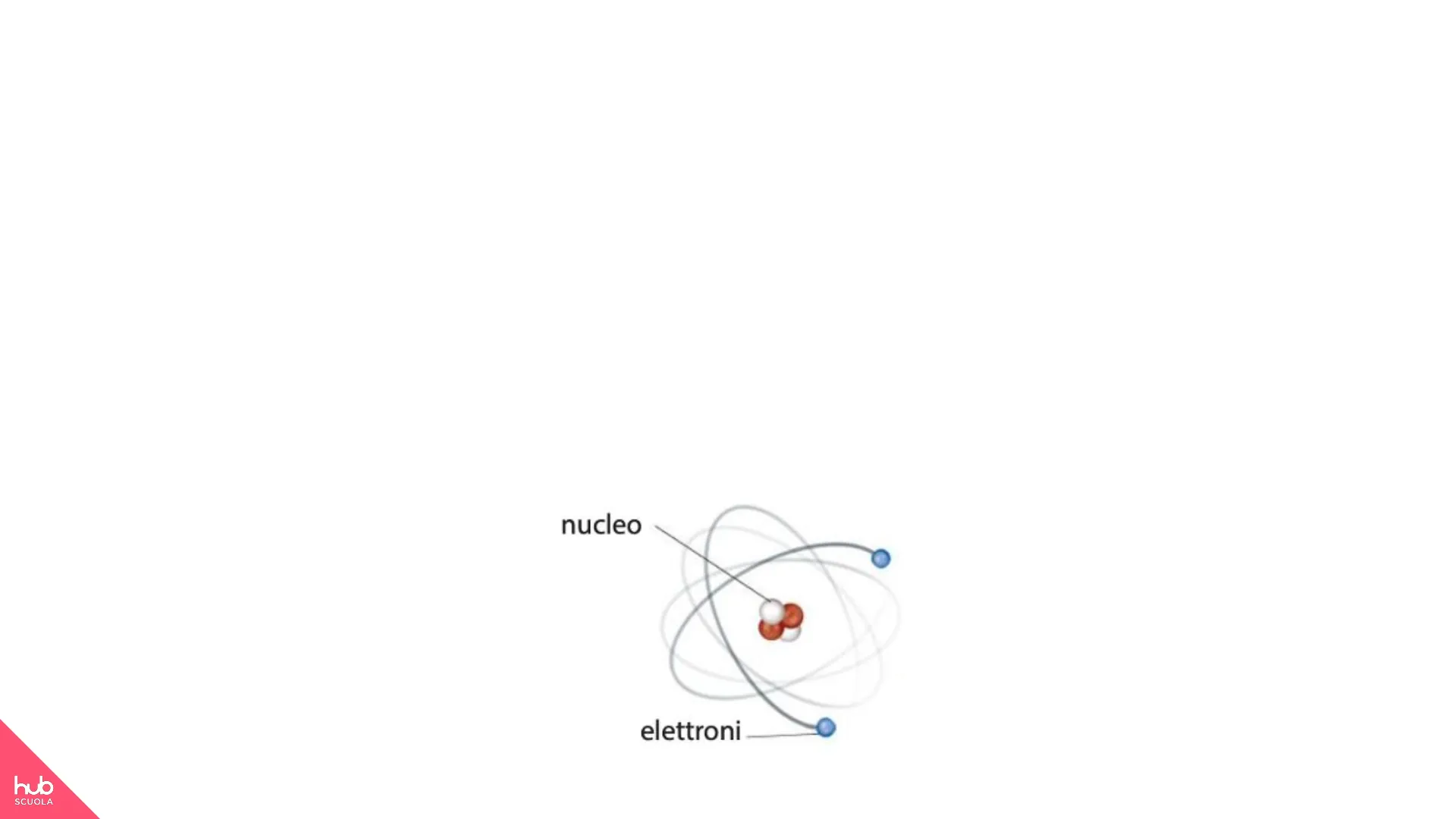
hub SCUOLA a4 LE BASI DELLA CHIMICA 100 75 approk. vol. 50LA MATERIA È FORMATA DA ATOMI La materia è formata da piccolissime particelle dette atomi. Ogni atomo è formato da particelle ancora più piccole, dette particelle subatomiche: i protoni, i neutroni, gli elettroni. Protoni e neutroni costituiscono il nucleo che si trova al centro dell'atomo. Gli elettroni si muovono attorno al nucleo e costituiscono una nuvola elettronica.
nucleo elettroni hub SCUOLA Le basi della chimicaLa carica elettrica è la proprietà della materia che permette ai corpi di attrarsi oppure di respingersi. Può essere positiva (+) o negativa (-). Anche le particelle subatomiche possiedono carica elettrica: il protone ha carica positiva, l'elettrone ha carica negativa, mentre il neutrone è elettricamente neutro.
+ protone 1 elettrone neutrone Cariche elettriche dello stesso segno si respingono, di segno opposto si attraggono.
+ + + 1 1 1 1 hub SCUOLA Le basi della chimica - La materia è formata da atomiIl numero di protoni presenti nel nucleo di un atomo è definito numero atomico e si indica con la lettera Z. Il numero atomico contraddistingue quell'elemento da tutti gli altri ed è anche uguale al numero di elettroni presenti nell'atomo.
L'idrogeno è costituito da 1 protone e 1 elettrone. Il suo numero atomico Z è 1. L'elio ha 2 protoni, 2 neutroni, 2 elettroni. Z = 2. hub SCUOLA Le basi della chimica - La materia è formata da atomiLa somma del numero dei protoni e dei neutroni è definito numero di massa e si indica con la lettera A. Gli elementi con lo stesso numero atomico ma differente numero di massa, cioè con differente numero di neutroni, sono detti isotopi.
carbonio-12 (12C) carbonio-13 (13C) carbonio-14 (14℃) Il carbonio ha tre isotopi. hub SCUOLA Le basi della chimica - La materia è formata da atomiLa massa atomica, o peso atomico, di un elemento indica quante volte un atomo di quell'elemento pesa di più della dodicesima parte dell'atomo di carbonio-12. La massa atomica si esprime in unità di massa atomica relativa.
Massa atomica degli elementi
Elemento Simbolo Massa atomica idrogeno H 1,008 elio He 4,002 carbonio C 12,011 ossigeno O 15,999 ferro Fe 55,846 rame Cu 63,540 hub SCUOLA Le basi della chimica - La materia è formata da atomiGli elettroni non sono liberi di muoversi ovunque nella nuvola elettronica ma solo all'interno di spazi ben definiti, detti gusci elettronici. Ogni guscio elettronico si trova a una distanza diversa dal centro dell'atomo e può ospitare un determinato numero di elettroni:
- il guscio più vicino al nucleo ne può ospitare 2,
- quelli più esterni fino a 8. hub SCUOLA Le basi della chimica - La materia è formata da atomiLA TAVOLA PERIODICA Gli elementi chimici sono ordinati nella tavola periodica in base al numero atomico. Ogni elemento occupa una casella in cui sono indicati:
- il nome
- il simbolo chimico
- il numero atomico
- la massa atomica. numero atomico simbolo . 4 Be. Berillioo 9,012182 nome massa atomica hub SCUOLA Le basi della chimicaLa tavola periodica è organizzata in 8 colonne (gruppi) e 7 righe (periodi).
Organizzazione della tavola periodica
gruppi IA VIIIA 1 1 H drogeno 1,008 IIA IIIA IVA VA VIA VIIA 2 He Elia 4.0028 5 B hom 10,81 6 7 8 9 2 lit : 5.94 Be her'l io ללוח. ט 13 14 15 P 16 17 18 3 Na sodi: 22,550 magncsic 24,305 IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB a luminio 26,982 si icio 28.085 'osfore 30,97-1 32.06 cloro 35.415 arcor 39.91B periodi 19 21 22 Ti 23 24 Cr 25 29 30 31 Ga ga lin 69,323 32 Ge germario /7,630 33 As 34 Se selenio 18,0/1 35 Br bra no 74,004 viaton 64 /96 46 Pd pal edio 06,42 47 Ag argento 107,87 48 Cd cácriiu 112,41 49 In 50 Sn slugio 118,71 un. monio 121,76 slerio 127,60 iucic 126,90 131,25 78 Pt platino .95.08 79 Au 80 81 Ti 82 Pb piombo 207.2 83 Bi bismuto 208,98 84 Po polonio (209) 85 At 86 Rn 6 Cs ces D 132,91 56 Ba ogrio .37.33 89 104 Rf 105 Db 106 111 112 113 114 115 116 117 118 Fr Rq Cn Nh FI M LV Ts 0g darmslazio countgonio (261) copoirino (285) n'horium (286) Ilerovio '289) moscovium |livermorici (290) (293) lennessinc (294) ajanc5504 (294) 63 Eu 64 Gd gadolinio 157,25 65 Th zerbio 158.03 66 Dy cispresio 162.50 67 Ho almric 16/,93 68 Er eroic 167,26 69 Tm tu ic 168,93 70 Yb itterbio 73.05 71 Lu lutezio 74,97 Attinoidi > 89 Ac atti-ic :227) 90 Th toric 232,0± 91 92 Pa U 93 Np retti nio 94 Pu pl_tonio (24) 95 Am americio (243) 96 Cm curic (24/) Bk berkelio (24/) cal fornia (251) 99 Es Einsteinio :252) 100 Fm Turic [2]/) mende eric (258) nobslio (259) 103 Lw lawrenzic (266) hub SCUOLA Lantanoidi * 57 La 58 Ce DE'ic 40,12 59 Pr 60 Nd 61 Pm orcriezio (' 45) 62 Sm sa 'nar o '50,38 135 91 71 72 Hf atn'o 178.49 73 Ta tantalio 180.95 tungsteno 183,84 Re renic 186.21 190,23 196.97 204.38 51 Sb 52 Te 53 54 Xe 5 37 Rb rub dio 85.468 38 Sr 39 40 Zr ill'io BB,90G zirconio 91.224 41 Nb niobio 92,906 42 Mo 43 Tc 44 Ru (9B) rolun u 101,07 45 Rh rod u '02,51 55 57 75 74 W 76 Os Ir 7 franco (223) 103 ruthErtore 5 (267) (26B) Sg sil;orgio [259' 107 Bh bahri> (270) hassin) [277 meilnor' a (278) 28 Ni 4 K porassio 19.048 scandio 44.956 ttan o 47,86 vanadio 50,947 21,996 manganese 54,4.8 ferro 45,645 coba to 48,999 n chel 48,699 Cu rame 63.546 Zn zinco ติว , ซสี arsenico 34,422 oss geno 15,994 fluoro 10 Ne nen- 75.1RD 11 12 Mg Al Si 5 CI Ar Sc V Mn 26 Fe 27 Co 3 4 C N ra bonio 17,011 azoto 14,4%1/ 0 F astato (210) racon (222) 110 Ds 108 Hs 109 Mt 51.96 97 98 Cf 101 Md 102 No protoattinio 231,01 uranio 238,03 prasexin in 140,91 neod mio 1.11,24 77 Hg mercurio 200.59 ir'dio 92.22 87 88 Ra radio (226) Y >.'urizio 87,52 20 Ca calcio 40,075 36 Kr riolibueno 95.95 114.82 (282) Le basi della chimica - La tavola periodicaI LEGAMI TRA GLI ATOMI Quando un atomo ha 8 elettroni nel guscio più esterno si dice che ha l'ottetto completo. Gli atomi cercano di riempire completamente il guscio elettronico più esterno perché così raggiungono la maggiore stabilità chimica possibile. Per farlo possono:
- cedere elettroni
- acquistare elettroni
- condividere elettroni. O Li F O O 0 hub SCUOLA Le basi della chimicaUn atomo che perde un elettrone diventa uno ione positivo. Un atomo che acquista un elettrone diventa uno ione negativo. Na Na Na Na+ CI CI- Na perde un elettrone e diventa Na+. Cl acquista un elettrone e diventa Cl- . hub SCUOLA Le basi della chimica - I legami tra gli atomiIl legame chimico è ciò che tiene legati gli atomi gli uni agli altri e che determina la formazione delle sostanze composte. I legami possono essere ionici, covalenti o metallici. Legame ionico: attrazione elettrostatica che tiene uniti uno ione positivo e uno ione negativo. La sostanza che si ottiene è detta composto ionico. C Na Na+ Lo ione Na+ e lo ione Cl- hanno carica elettrica opposta: si attraggono reciprocamente e tra essi si stabilisce un legame ionico. hub SCUOLA Le basi della chimica - I legami tra gli atomiLegame covalente: gli atomi sono uniti mediante la condivisione di uno o più elettroni. L'unione di due o più atomi mediante un legame covalente determina la formazione di una molecola. H H H. Formazione della molecola di idrogeno. hub SCUOLA Le basi della chimica - I legami tra gli atomiLegame metallico: attrazione elettrostatica tra gli ioni positivi e il mare di elettroni che si muovono nel metallo. Grazie alla mobilità degli elettroni i metalli sono ottimi conduttori di corrente elettrica. 4 + hub SCUOLA Le basi della chimica - I legami tra gli atomiLE REAZIONI CHIMICHE Le sostanze semplici sono sostanze formate da un solo tipo di atomo. I composti sono sostanze formate da atomi di elementi diversi. La formula chimica indica da quali elementi è formato un composto e in quale proporzione essi sono presenti. Per esempio, l'acqua ha molecole formate da 2 atomi di idrogeno (H) e 1 atomo di ossigeno (O): la sua formula chimica è H O. Lo zolfo è una sostanza semplice. H H O L'acqua è un composto. hub SCUOLA Le basi della chimicaLe trasformazioni della materia in cui non cambia la composizione delle sostanze coinvolte si chiamano fenomeni fisici (fenomeni reversibili). Le trasformazioni della materia in cui avvengono cambiamenti nella composizione delle sostanze si chiamano fenomeni chimici o reazioni chimiche (fenomeni irreversibili). H2O solida H2O liquida fenomeno fisico Tutti i passaggi di stato sono fenomeni fisici. Nella fiamma dell'accendino si verifica una reazione chimica. hub SCUOLA Le basi della chimica - Le reazioni chimicheUna reazione chimica è una trasformazione della materia in cui alcune sostanze, dette reagenti, si combinano tra loro trasformandosi in altre sostanze, dette prodotti. Una reazione viene rappresentata attraverso un'equazione chimica. Ogni reazione chimica rispetta la legge di conservazione della massa: la massa delle sostanze reagenti è sempre uguale alla massa delle sostanze prodotte. reagenti prodotti 4 Fe + 30 2 2 Fe, O 3 hub SCUOLA Le basi della chimica - Le reazioni chimicheI MISCUGLI ETEROGENEI Un miscuglio eterogeneo è una mescolanza di sostanze diverse che restano distinguibili e mantengono le proprie caratteristiche. I componenti di un miscuglio eterogeneo possono essere separati con la filtrazione e la decantazione. hub SCUOLA Le basi della chimicaI MISCUGLI OMOGENEI: LE SOLUZIONI Un miscuglio omogeneo è una mescolanza di sostanze che non sono distinguibili; la composizione del miscuglio omogeneo è uguale in ogni punto. Una soluzione è un miscuglio omogeneo. In una soluzione, la sostanza presente in maggiore quantità si chiama solvente, quella presente in minore quantità è detta soluto. il sale si scioglie NaCI -O O acqua H2O (solvente) Na+ cristallo di NaCl (soluto) Il sale si scioglie in acqua e le due sostanze non sono più distinguibili l'una dall'altra. hub SCUOLA Le basi della chimicaLa solubilità indica la capacità di una sostanza di sciogliersi in un solvente. A seconda di quanto soluto sciogliamo nel solvente possiamo avere una soluzione diluita, concentrata o satura:
- è diluita se contiene una quantità minima di soluto;
- è concentrata se contiene una quantità di soluto poco inferiore rispetto alla massima quantità di soluto;
- è satura se contiene la massima quantità di soluto che è possibile sciogliere in quel solvente. I componenti di una soluzione si possono separare con la distillazione. soluzione diluita soluzione concentrata soluzione satura hub SCUOLA Le basi della chimica - I miscugli omogenei: le soluzioni