La spettroscopia di assorbimento UV-visibile: concetti e legge di Lambert-Beer
Slide dall'Università sulla spettroscopia di assorbimento UV-visibile. Il Pdf, adatto per lo studio universitario di Chimica, spiega concetti come trasmittanza e assorbanza, presentando la legge di Lambert-Beer e un esempio pratico sull'assorbimento della clorofilla.
See more59 Pages
Unlock the full PDF for free
Sign up to get full access to the document and start transforming it with AI.
Preview
La spettroscopia di assorbimento UV-visibile
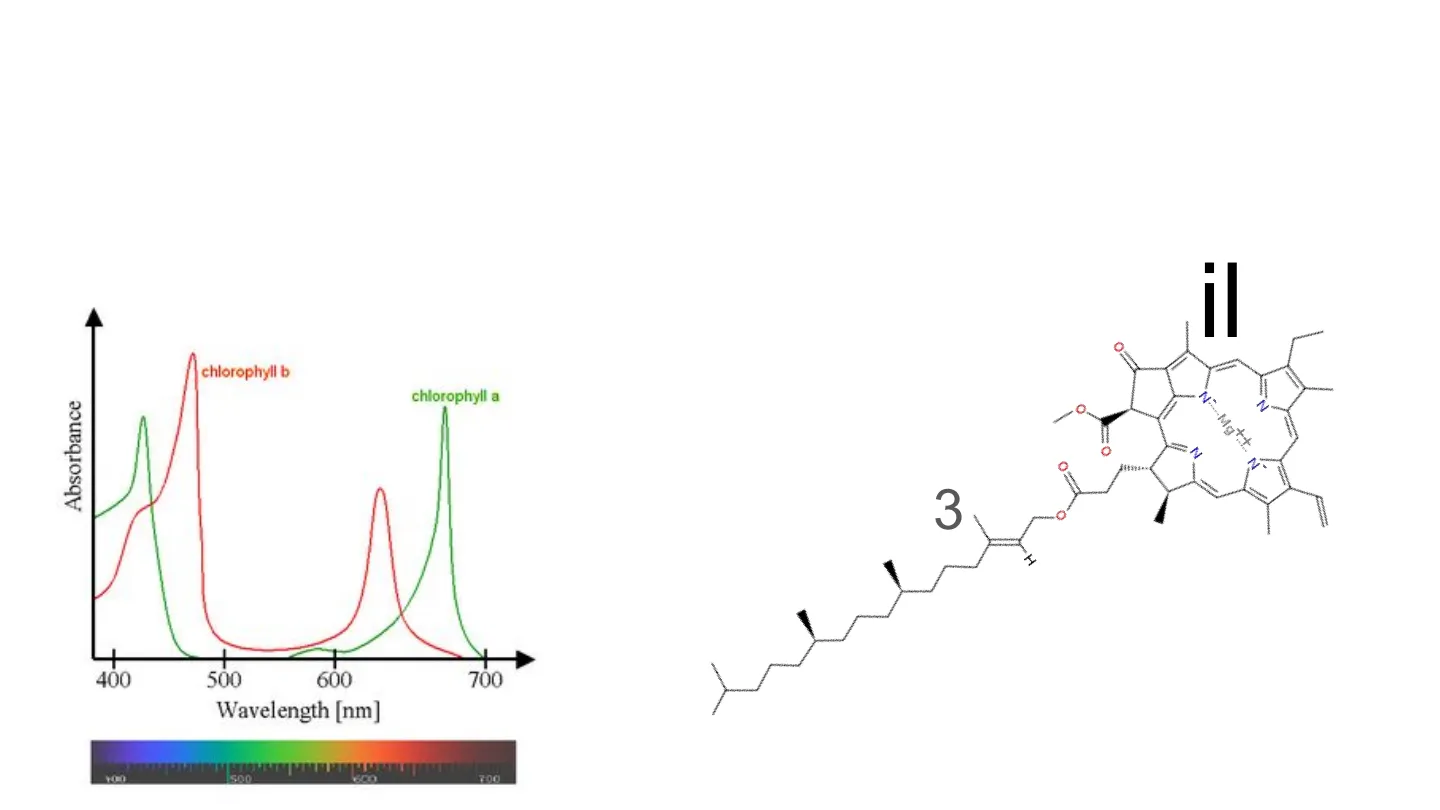
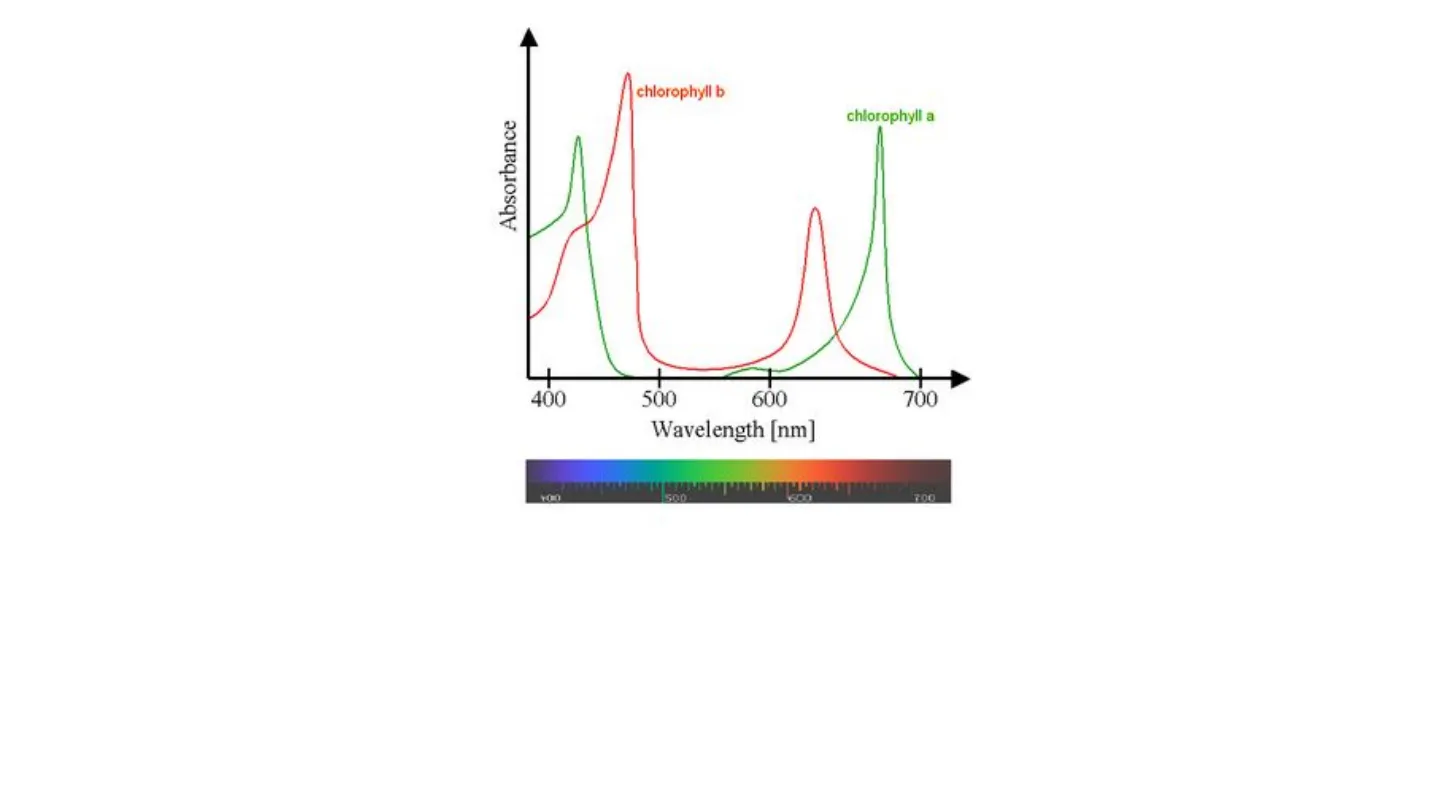
La spettroscopia di assorbimento UV-visibile chlorophyll b chlorophyll a Absorbance N- Mg 2 C I 400 500 600 700 Wavelength [nm] 500 700
LEZIONE 3chlorophyll b Absorbance chlorophyll a 11 400 500 600 700 Wavelength [nm] 500 700
Perché la clorofilla è verde
Presenta due picchi di assorbimento nella zona del visibile: assorbe tutta la componente blu e rossa Una molecola è colorata quando assorbe nel visibile. il colore che la molecola mostra è quello complementare al colore assorbito.ENERGIA INTERNA DELLE MOLECOLE E= E i nucleare + +E + E + E Elettroni interni elettroni esterni vibrazionale rotazionale + E traslazionale
- Per spostare elettroni più interni sono necessarie energie maggiori, quelle che cadono nel lontano UV o nei raggi X
- È quantizzata e le radiazioni in grado di effettuare transizioni energetiche degli elettroni di legame cadono nella regione dell'UV-Visibile (Spettroscopia UV-visibile)
- È dovuta alla rotazione della molecola E' quantizzata perchè la molecola si muove in uno spazio uguale al suo. L'energia necessaria per modificare tale stato è quella delle microonde (spettroscopia nelle microonde)
- È quantizzata e le relative transizioni cadono nei raggi gamma. E' stato però scoperto che i nuclei di H e C sottoposti a forti campi magnetici possono variare il loro momento magnetico e le energie di queste transizioni sono basse e corrispondono a quelle delle onde radio.(Spettroscopia di risonanza magnetica nucleare (NMR)
- È dovuta alle vibrazioni degli atomi lunghi gli assi di legame e gli angoli di legame L'energia necessaria per modificare tale stato è quella degli infrarossi (spettroscopia infrarossa)
- È dovuta al movimento delle molecole, Non è quantizzata può assumere qualsiasi valore
Energie caratteristiche delle varie tecniche spettroscopiche
Le molecole tendono a stare negli stati fondamentali, cioè di più bassa energia, e possono raggiungere il livello energetico superiore solo quando ricevono una radiazione con frequenza tale che l'energia del fotone sia uguale alla differenza di energia tra i livelli coinvolti nella transizione.
Classificazione delle tecniche spettroscopiche
rispetto all'energia molecolare rispetto alla radiazione elettromagnetica
- Spettroscopia elettronica SPettroscopia UV-Visibile
- Spettroscopia vibrazionale Spettroscopia IR
- Spettroscopia rotazinale Spettroscopia Microonde
E raggi-X 1 1 1 1 / Microonde 1 Infrarosso 1 UV-visibile Livelli elettronici Livelli vibrazionali Livelli rotazionali Livelli di energia molecolare, e radiazioni in grado di indurre transizioni tra i livelli.Le diverse regioni dello spettro elettromagnetico 0 0 O 0-0 0 onde radio microonde infrarosso visibile-UV raggi-X NMR EPR rotazioni vibrazioni salti elettronici elettroni esterni elettroni interni 108 109 1010 1011 1012 1013 1014 1015 1016 -1 V /s 3 0,3 0,03 3x103 3x104 3x105 3x106 3x107 3x10-8 2 /m 0,01 0.1 1,0 10 102 103 104 10° 106 AE/cal mole-1 10Regole di selezione
Affinché una sostanza possa assorbire la radiazioni elettromagnetica occorrono due cose:
- L'energia posseduta dalla radiazione deve essere esattamente eguale alla differenza d'energia tra due livelli molecolari.
- Occorre che il moto molecolare che viene eccitato comporti dei cambiamenti delle proprietà elettriche o magnetiche della molecola che possano interagire con i campi elettrici o magnetici oscillanti della radiazione.I
Livelli di energia molecolare e righe spettrali
Livelli di energia molecolare e righe spettrali dovute a tre possibili transizioni E E3 frequenza E2 - E E0 A un sistema atomico o molecolare può essere fornita energia sotto forma di una radiazione elettromagnetica di frequenza v. Per avere transizione tra due livelli (ad esempio da E1 a E2) si deve fornire l'energia corrispondente a AE = E2-E1 = hv AE (J/molecola) = hv h = 6,626x10-34 J s/molecola Questa formula ci dà l'energia assorbita o emessa da una molecola; per avere l'energia assorbita o emessa da una mole occorre moltiplicare questo valore per il numero di Avogadro L=6,022x1023 molecole per mole.L'energia assorbita o emessa da una mole di una data sostanza durante una transizione tra due livelli è correlata alla lunghezza d'onda della radiazione corrispondente, da: AE = hv V=c/2 AE = nº L= hc 6,62×10-34(Js molecola-1).3×1010(cms-1). 6,022×1023 (molecole mole-1) 2 (cm) 11,962 J mole-1 2 (cm) numero di Avogadro L=6,022x1023 molecole per mole ovvero, passando alle calorie: E(J)= 4,184E (cal) LE = 11,961 2 J mole-1 1 cal J-1 = 2,86 4,184 2(cm) cal mole-1Esempio 2,86x10-3 LE = kcal mole-1 2(cm) 2,86x10-3 LE cm Se AE=100 kcal mol-1 2 ~ 286 nm Se AE = 47 kcal mol-1 2 = 608 nm
Esercizi
- L'energia di ionizzazione dell'idrogeno è 13, 59 eV (1eV=1,60219 x 10 -19J). Calcola la frequenza e la lunghezza d'onda della radiazione in grado di strappare l'elettrone dal nucleo.
- La transizione 3s->3p del sodio richiede 2,1028 eV. Calcola l'energia di tale transizione in Joule e la lunghezza d'onda in nm a cui si verifica la transizione.
- Per rompere i legami di una mole di CI, sono necessari 243,4 KJ. Puoi rompere questi legami inviando una radiazione di opportuna frequenza? Qual è la frequenza della radiazione? Qual è la lunghezza d'onda? In quale campo dello spettro elettromagnetico si trova?
Spettrofotometria di assorbimento UV-visibile
Nella tecnica di assorbimento Uv-Vis si impiegano radiazioni nell'intervallo 190-780 nm, la cui energia è sufficiente ad attivare transizioni elettroniche nei campioni (atomi, molecole), che causano il passaggio di elettroni degli strati esterni a stati eccitati Visibile : 380 - 780 nm UV (vicino Ultravioletto ): 190 - 380 nm Stato eccitato (E1) LE = hv H R O-H 0=0 Stato fondamentale (En) Utilizzi:
- Identificare molecole
- Quantificare le molecole
- Analizzare cambiamenti nelle molecole
- Studiare cinetiche di reazione Si ha assorbimento della radiazione solo se 'energia del fotone assorbito è esattamente uguale alla differenza di energia fra lo stato fondamentale e lo stato eccitato della specie assorbente : hv = ΔΕ
La spettroscopia di assorbimento UV-visibile
E' la tecnica che permette di studiare l'assorbimento nel campo visibile e UV, assorbimento che determina transizioni tra livelli energetici di valenza (elettroni di legame). La spettroscopia di assorbimento permette, attraverso lo studio delle radiazioni assorbite e della loro intensità, di fare analisi di tipo qualitativo e quantitativo. Si basa sull'interazione tra luce UV-visibile e materia e coinvolge le transizioni dei livelli elettronici ovvero degli elettroni di legame di una molecola. Poichè i livelli elettronici sono divisi in vibrazionali e rotazionali, queste transizioni sono spesso accompagnate a transizioni sia vibrazionali che rotazionali e gli spettri appaiono come bande e non come sottili righe. La struttura fine di una molecola è rilevabile solo per gas rarefatti e con l'utilizzo di spettrografi ad alta risoluzione.
La luce visibile
La radiazione visibile rappresenta solo una piccola parte dello spettro elettromagnetico: violetto indaco azzurro verde giallo arancio rosso · alta V · bassa V · alta E · bassa E · bassa 2 · alta 2 400 500 600 700 800 lunghezza d'onda (nm) Alle diverse radiazioni visibili, che differiscono per la loro lunghezza d'onda (e di conseguenza per la loro frequenza ed energia) corrispondono i diversi colori.
Radiazione Ultravioletto 280 nm - 400 nm
Regione dell'ultravioletto (1<400 nm) UV lontano 10-200 nm UV vicino 200-380 nm UV-A meno pericolosi responsabili dell'invecchiamento della pelle UV-B responsabili dell'abbronzatura, dannosi per il cristallino UV-C battericidi ma cancerogeni CIE: UV-C (100-280 nm) UV-B (280- 315 nm) UV-A (315-400 nm) * Definitions based on biological effect. UV-C' UV-B* UV-A· Ozone- producing Germicidal Erythemal Far UV Near UV ("Black light") (nm) 100 150 200 250 300 350 400
Quali composti assorbono nell'UV-Visibile?
composti organici transizioni o-> o+ transizioni TT-> TT+ transizioni n-> TT+ composti di coordinazione transizioni metalli di transizione (d->d, f->f) Trasferimento di carica
Spettroscopia elettronica di assorbimento UV-Visibile
Diagramma schematico di uno spettrofotometro Specchio soluzione I t Registratore 2 A Separatore di raggio Rivelatore Fenditura 2 Prisma (o reticolo) solvente Sorgente Po
Strumentazione
Lo spettrofotometro è costituito da:
- Sorgente: genera le radiazioni elettromagnetiche ad ampio spettro. Si usano Lampada a deuterio per la regione UV (190-350 nm) Lampada al tungsteno o al quarzo alogena per la regione del visibile (350-900 nm)
- Monocromatore: permette di selezionare una particolare lunghezza d'onda e generare una radiazione monocromatica. Possono essere un prisma o un reticolo. La guida del monocromatore è sincronizzata con l'asse delle ascisse del registratore in modo che questi indichi la lunghezza d'onda della radiazione.
- Separatore di raggio: divide la radiazione in due raggi.
- Celle portacampioni: contengono la soluzione con analita da studiare (il campione) e il solvente (il bianco). Le analisi vengono eseguite su campioni in soluzione. Cuvette in vetro o plastica per il visibile, in quarzo per UV.
- Rivelatore misura la quantità di radiazione assorbita. E' formato da fotocellule o fototubi che convertono il segnale luminoso in elettrico.
- Registratore riporta lo spettro di assorbimento (Trasmittanza o assorbanza in funzione della lunghezza d'onda).
Analisi qualitativa
Per effettuare analisi qualitative si fa uso di radiazioni policromatiche a spettro continuo, poi separate tramite monocromatori nelle varie componenti (radiazioni monocromatiche). In pratica le singole radiazioni monocromatiche di tale raggio si fanno passare, una alla volta, attraverso la sostanza in esame, la quale assorbirà in modo diverso, cioè con diversa intensità, le diverse radiazioni. Riportando perciò i valori registrati in un grafico come assorbanza in funzione della lunghezza d'onda, si ottiene lo spettro di assorbimento della sostanza esaminata. Ogni sostanza ha il suo spettro di assorbimento, l'esame di tali spettri permette di identificare una sostanza (per confronto diretto con campioni noti o tramite banche dati di spettri). Assorbanza 400 500 600 lunghezza d'onda (nm) soluzione K2Cr2O7 Assorbanza 400 500 600 lunghezza d'onda (nm) soluzione KMnO