Composizione percentuale di acqua e biomolecole nell'organismo umano
Slide sulla composizione percentuale di acqua e biomolecole nell'organismo umano. Il Pdf, utile per la scuola superiore, approfondisce le funzioni delle proteine, la loro forma e proprietà chimiche, e il concetto di denaturazione proteica.
See more26 Pages
Unlock the full PDF for free
Sign up to get full access to the document and start transforming it with AI.
Preview
Composizione e Funzioni delle Proteine
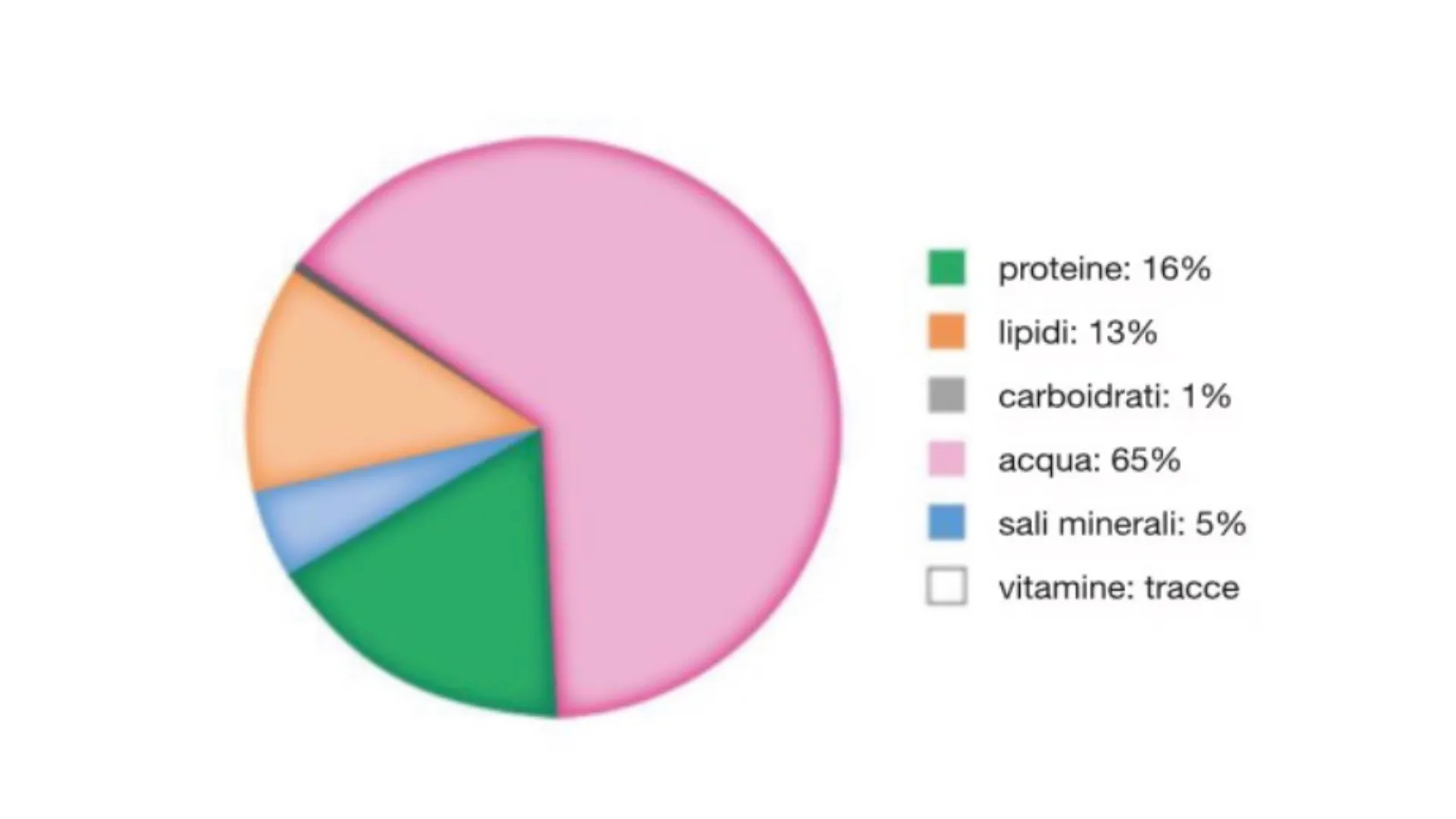
Composizione percentuale di ACQUA e BIOMOLECOLE dell'organismo umano proteine: 16% lipidi: 13% carboidrati: 1% acqua: 65% sali minerali: 5% vitamine: tracceIn ogni cellula ci sono in media MILIONI di TIPI DIVERSI di PROTEINE, ognuna delle quali svolge una specifica funzione che è ESSENZIALE per il corretto funzionamento di una cellula e quindi dell'organismo
Funzioni Specifiche delle Proteine
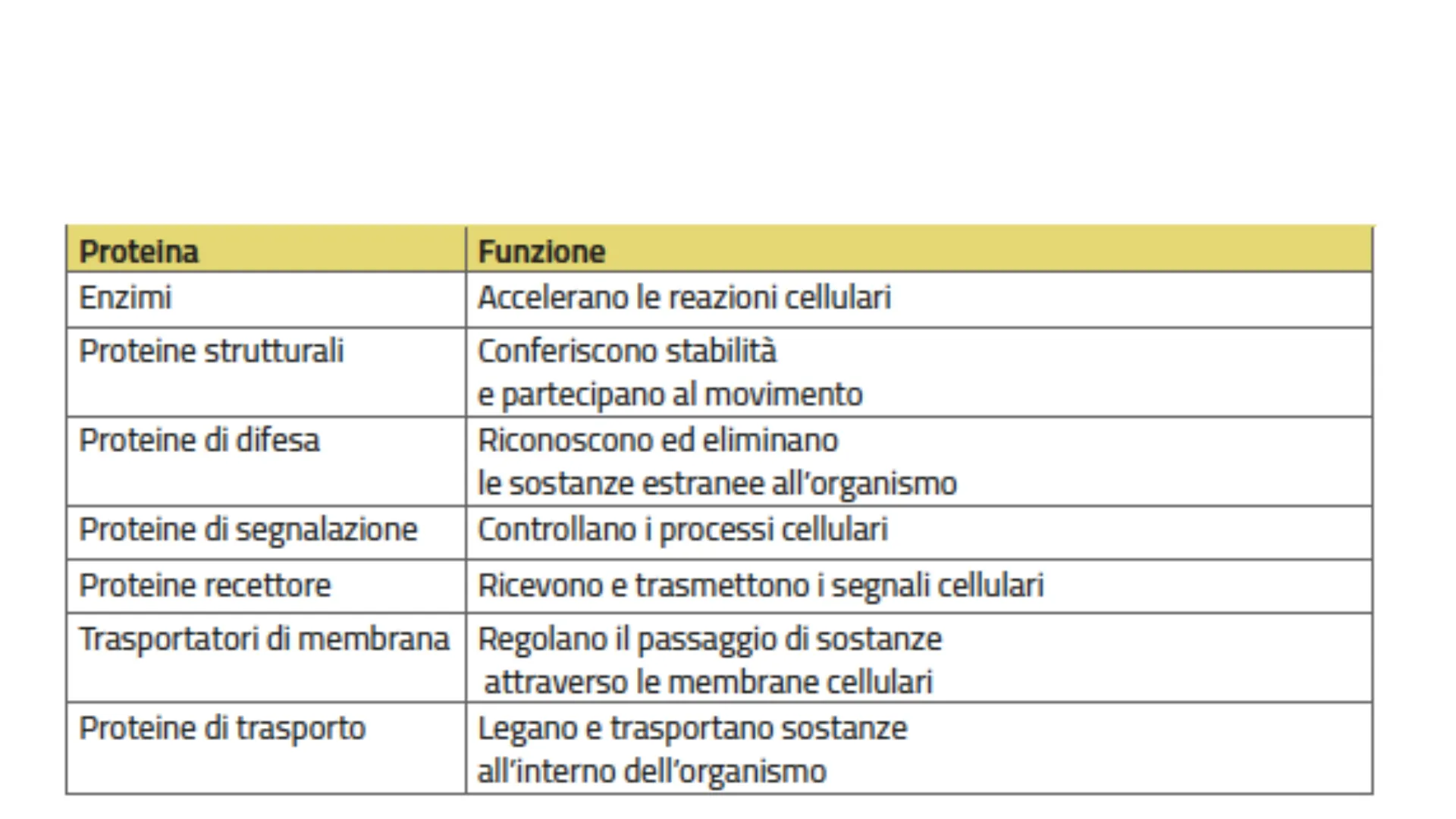
Proteina Funzione Enzimi Accelerano le reazioni cellulari Proteine strutturali Conferiscono stabilità e partecipano al movimento Proteine di difesa Riconoscono ed eliminano le sostanze estranee all'organismo Proteine di segnalazione Controllano i processi cellulari Proteine recettore Ricevono e trasmettono i segnali cellulari Trasportatori di membrana Regolano il passaggio di sostanze attraverso le membrane cellulari Proteine di trasporto Legano e trasportano sostanze all'interno dell'organismo
Le Proteine: Biomolecole Fondamentali
Le PROTEINE [dal greco proteios: primario, che occupa il primo posto) BIOMOLECOLE FONDAMENTALI con compiti STRUTTURALI FONDAMENTALI
- Sono i costituenti principali delle cellule
- Sono sempre presenti in tutte le strutture cellulari degli esseri viventi, come i "mattoncini" di una casa
- Sono le biomolecole più abbondanti negli esseri viventi: dopo l'acqua sono i nutrienti presenti in maggiore quantità [nell'essere umano costituiscono circa il 18% del peso]
Funzioni ed Esempi delle Proteine
FUNZIONI ESEMPI
- STRUTTURALE: Cheratina - la proteina delle unghie e dei capelli; Collagene - componente fondamentale della pelle, delle ossa, della cartilagine e dei tendini
- ENZIMATICA: ENZIMI proteici funzionano da CATALIZZATORI rendendo più veloci le reazioni chimiche cellulari senza dover aumentare la temperatura
- DIFENSIVA: mediante gli ANTICORPI che riconoscono gli agenti estranei all'organismo e ne favoriscono l'eliminazione
Altre Funzioni Proteiche
FUNZIONI ESEMPI
- REGOLATRICE: ORMONE insulina regola il livello di glucosio nel sangue
- CONTRATTILE: le proteine ACTINA e Miosina presenti nei muscoli
4. di TRASPORTO: EMOGLOBINA nel sangue che trasporta ossigeno a tutte le cellule del corpo 5. di RISERVA: CASEINA del latte o l'ALBUMINA nell'albume dell'uovo 6. Proteine RECETTORE dei NEUROTRASMETTITORI (che sono degli amminoacidi: glutammato, aspartato, GABA, glicina) o degli ORMONI
Cosa Sapere sulle Proteine
Cosa dobbiamo sapere delle PROTEINE:
- Quali FUNZIONI hanno le proteine
- Le proteine sono POLIMERI di AMMINOACIDI. Che vuol dire?
- Come è fatto un AMMINOACIDO; come si legano tra loro gli amminoacidi per formare una CATENA POLIPEPTIDICA
- Quanti diversi tipi di amminoacidi servono per comporre milioni di proteine diverse nelle nostre cellule?
- Che cosa si intende per AMMINOACIDI ESSENZIALI?
- Quanti e quali sono i livelli di organizzazione strutturale delle proteine?
- Perché è importante la FORMA di una proteina?
- Che succede ad una proteina se la temperatura aumenta intorno ai 50℃?
Proteine: Polimeri di Amminoacidi
: Una proteina è un POLIMERO di AMMINOACIDI ( =i MONOMERI) T AMINO ACIDS PEPTIDE PROTEIN MONOMERI POLIMERO Amino Acid Peptide Protein
Composizione Chimica delle Proteine
Dal punto di vista CHIMICO: a) le PROTEINE sono formate da quattro elementi: carbonio (C), idrogeno (H), ossigeno (O), azoto (N). In alcune di esse possono essere presenti altri elementi come lo zolfo (S) e il fosforo (P) b) Le proteine sono POLIMERI formate dall'unione di AMMINOACIDI, i MONOMERI delle proteine
T AMINO ACIDS PEPTIDE PROTEIN Amino Acid Peptide Protein
Digestione e Riutilizzo delle Proteine
Le PROTEINE contenute negli alimenti vengono DIGERITE attraverso la reazione di IDROLISI (=idrolizzate) per liberare gli amminoacidi (aa) che le costituiscono, in modo tale che gli organismi possano riutilizzare gli amminoacidi per SINTETIZZARE NUOVE PROTEINE
PROTEINA IDROLISI H OH aa aa aa Si rompe un legame covalente tra i monomeri. H20 Durante l' idrosi viene aggiunta acqua. H OH + H OH aa Amminoacido aa aa
Struttura di un Amminoacido
Come è fatto un AMMINOACIDO? > Un AMMINOACIDO è formato da un atomo di CARBONIO centrale a cui sono legati quattro chimici:
- un gruppo AMMINICO (-NH2) R HN-C-COOH
- un gruppo CARBOSSILICO (-COOH) 2 I 1 H
- un atomo di IDROGENO (H)
- una parte VARIABILE (R) specifica per ogni amminoacido
Importanza della Struttura Amminoacidica
Dobbiamo sapere come è fatto un amminoacido? Sì! Dobbiamo saperlo 1 1 R HN-C-COOH H
Diversità degli Amminoacidi
Quanti diversi tipi di amminoacidi servono per comporre milioni di proteine diverse nelle nostre cellule? 20 amminoacidi In tutti gli organismi viventi esistono diverse decine di tipi di amminoacidi ma soltanto VENTI di essi sono i costituenti delle PROTEINE Questi venti amminoacidi sono come le lettere dell'alfabeto e possono combinarsi per formare milioni di "parole" diverse (le proteine), questo spiega la grande varietà di proteine esistenti
I 20 Amminoacidi
1 20 AMMINOACIDI acido aspartico acido glutammato arginina istidina lisina amminoacido essenziale asparagina cisteina glutammina tirosina glicina serina treonina amminoacido essenziale alanina isoleucina amminoacido essenziale leucina amminoacido essenziale metionina amminoacido essenziale prolina triptofano amminoacido essenziale valina amminoacido essenziale fenilalanina amminoacido essenziale Amminoacido COO- COO COO- + H3N-C-H 1 H3N -C -H 1 CH3 - H3N-C-H 1 + CH Glicina CH3 CH3 COO- Alanina Valina Non polari, Gruppi R alifatici I H3N-C-H - CH2 COO- COO- - 1 H3N-C-H CH 1 CH2 CH3 CH3 I CH2 CH2 COO I S - - CH3 IH CH3 H2N CH 2 1 Metionina Isoleucina 1 H2C-CH2 Prolina COO COO 1 1 + H3N-C-H 1 CH2OH Serina COO- Cisteina coo H3N-C-H COO + - H3N-C-H - H-C-OH 1 C - CH3 H2N H2Ń Treonina Asparagina Glutammina Amminoacido COO- COO- COO- 1 H3N-C-H I CH2 H3N-C-H 1 CH2 H3N-C-H I CH2 1 Gruppi R a carico positivo CH2 - 1 `CH CH2 CH2 C -NH+ CH2 NH 1 +NH3 1 C =NH - NH2 Lisina Arginina Istidina Gruppi R a carico negativo COO- COO- - - H3N-C-H L H3N-C-H - CH2 CH2 - - CH2 COO- - COO- Aspartato Glutammato COO- COO- COO- - I - H3N-C-H H3N-C-H H3N-C-H I CH2 I CH2 NH OH Fenilalanina Tirosina Triptofano Non polari, Gruppi aromatici + I 1 H3N-C-H I CH2 I CH2 I CH2 I C Polari, Gruppi R non caricati + H3N-C-H - CH2 1 SH - H-C-CH3 1 Leucina - H3N-C-H - CH2 C -NH+ - CH2 I H
Amminoacidi Essenziali
Cosa si intende per AMMINOACIDI ESSENZIALI? Dei venti amminoacidi che compongono le proteine, i MAMMIFERI, essere umano compreso, sono in grado di produrne (sintetizzarne) solo tredici, detti «non essenziali»; gli altri SETTE amminoacidi, detti AMMINOACIDI ESSENZIALI [valina, metionina, lisina, leucina, isoleucina, treonina, triptofano, fenilalanina] devono essere assunti con gli alimenti (cibo) perché i mammiferi, essere umano compreso, non sono in grado di produrli (sintetizzarli) e quindi per evitare gravi carenze nutrizionali
1 20 AMMINOACIDI acido aspartico acido glutammato arginina istidina lisina amminoacido essenziale asparagina cisteina glutammina tirosina glicina serina treonina amminoacido essenziale alanina isoleucina amminoacido essenziale leucina amminoacido essenziale metionina amminoacido essenziale prolina triptofano amminoacido essenziale valina amminoacido essenziale fenilalanina amminoacido essenziale
Valore Biologico delle Proteine e Amminoacidi Essenziali
Quali amminoacidi è necessario introdurre con l'alimentazione? Gli aa essenziali Il VALORE BIOLOGICO di una proteina dipende proprio dal suo CONTENUTO di AMMINOACIDI ESSENZIALI: le proteine di origine ANIMALE (carne, pesce, uova, latticini) li contengono tutti, mentre le proteine di origine VEGETALE (legumi, cereali) li possono presentare in numero parziale o in minor quantità
Alimenti Ricchi di Amminoacidi Essenziali
ALIMENTI RICCHI di AMMINOACIDI ESSENZIALI: valina, metionina, lisina, leucina, isoleucina, treonina, triptofano, fenilalanina] Leucina latte mais pollo uova Lisina latte soia manzo Valina latte mais uova bresaola Fenilalanina uova riso integrale grano Treonina mais soia uova Tripofano latte manioca uova Metionina grano carne uova Istidina pesce carne formaggio Isoleucina mais patate pollo uova
Formazione delle Proteine e Legame Peptidico
Come si formano le proteine (o catene polipeptidiche)? V Gli AMMINOACIDI si legano tra loro tramite REAZIONI DI CONDENSAZIONE dando origine a lunghe catene polipeptidiche V Il legame tra due aa e di tipo covalente e si chiama LEGAME PEPTIDICO V Il legame peptidico si forma mediante l'unione di un gruppo carbossilico di un aa con un gruppo amminico di un altro aa v Per ogni legame peptidico si libera una molecola d'acqua (reazione di CONDENSAZIONE)
Reazione di Condensazione tra Monomeri
Reazione di CONDENSAZIONE tra MONOMERI H monomero OH + H monomero OH aa aa Si forma un legame covalente tra i monomeri. H20 Nella condensazione l'acqua viene rimossa. H OH + H OH aa aa H20 OH PROTEINA o CATENA POLIPEPTIDICA aa aa aa aa H
Dettaglio del Legame Peptidico
Carbonio & H Gruppo amminico NH, C COOH Gruppo carbossilico R Catena laterale H H. 0 0 H-N-C + H _0. H R R Legame peptidico I gruppi amminico e carbossilico dei due amminoacidi reagiscono tra loro per formare un legame peptidico. H 0 H. = +2 1 H Z-I I-U .O Estremità N-terminale R H-N-C-C-OH - = HHO HH Õ H2O amminoacido amminoacido + R 1 I H-N-C-C - - N-C-C-OH - ǁ HH O HHO legame peptidico Estremità C-terminale R R L'unione di molti amminoacidi mediante legami peptidici dà luogo a un polipeptide. H H H20 R 1 1- H-N-C-C-OH - R
Struttura delle Proteine
** La STRUTTURA delle PROTEINE Le FUNZIONI svolte da una proteina dipendono dalla FORMA che la proteina assume nello spazio. Per conoscere una singola proteina e comprendere la sua attività biologica è indispensabile conoscere la sua organizzazione strutturale, cioè la CONFORMAZIONE SPAZIALE La conformazione spaziale è la FORMA TRIDIMENSIONALE della proteina
Livelli di Organizzazione Strutturale delle Proteine
HIN+ Amminoacido Struttura primaria: sequenza di amminoacidi Legame peptidico COO Legame a idrogeno 0 -7 = 0 1 = = 1-2: GEO-11-N NTH-OSC 6 CH CH Alfa-elica Foglietto ripiegato Struttura terziaria: forma globulare Legame disolfuro Struttura quaternaria: più di un polipeptide I livelli di organizzazione delle proteine. C Legame a idrogeno H CEO -- H-N CEO Struttura secondaria: alfa-elica e foglietto ripiegato
Dettaglio delle Strutture Proteiche
Le strutture delle proteine Struttura primaria La specifica sequenza di amminoacidi, che contraddistingue un polipeptide da tutti gli altri, viene definita struttura primaria. Leu Tyr Gin Leu Glu Asn Tyr Cy Struttura secondaria È determinata dalle interazioni tra gli amminoacidi della catena polipeptidica che fanno assumere alle proteine forme elicoidali o a foglietto ripiegato. La cheratina che forma i capelli, ad esempio, ha una struttura a elica. La struttura terziaria È una struttura ancora più complessa che assume la molecola di un polipeptide quando le catene tendono a raggomitolarsi. La mioglobina, una proteina presente nelle cellule muscolari, è formata da una molecola a elica attorcigliata su se stessa. La struttura quaternaria Si ha quando due o più polipeptidici diversi si legano tra loro a formare una struttura tridimensionale ancora più grande. L'emoglobina contenuta nei globuli rossi è una proteina formata da quattro catene polipeptidiche.