El Átomo y las Sustancias Químicas, Presentación de Gsd
Diapositivas de Gsd sobre El Átomo y las Sustancias Químicas. El Pdf presenta la estructura de la materia, partículas subatómicas y el modelo planetario del átomo, ideal para Bachillerato en Química.
Ver más27 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
EL ÁTOMO Y LAS SUSTANCIAS QUÍMICAS
GSD
GSDQué vamos a ver ...
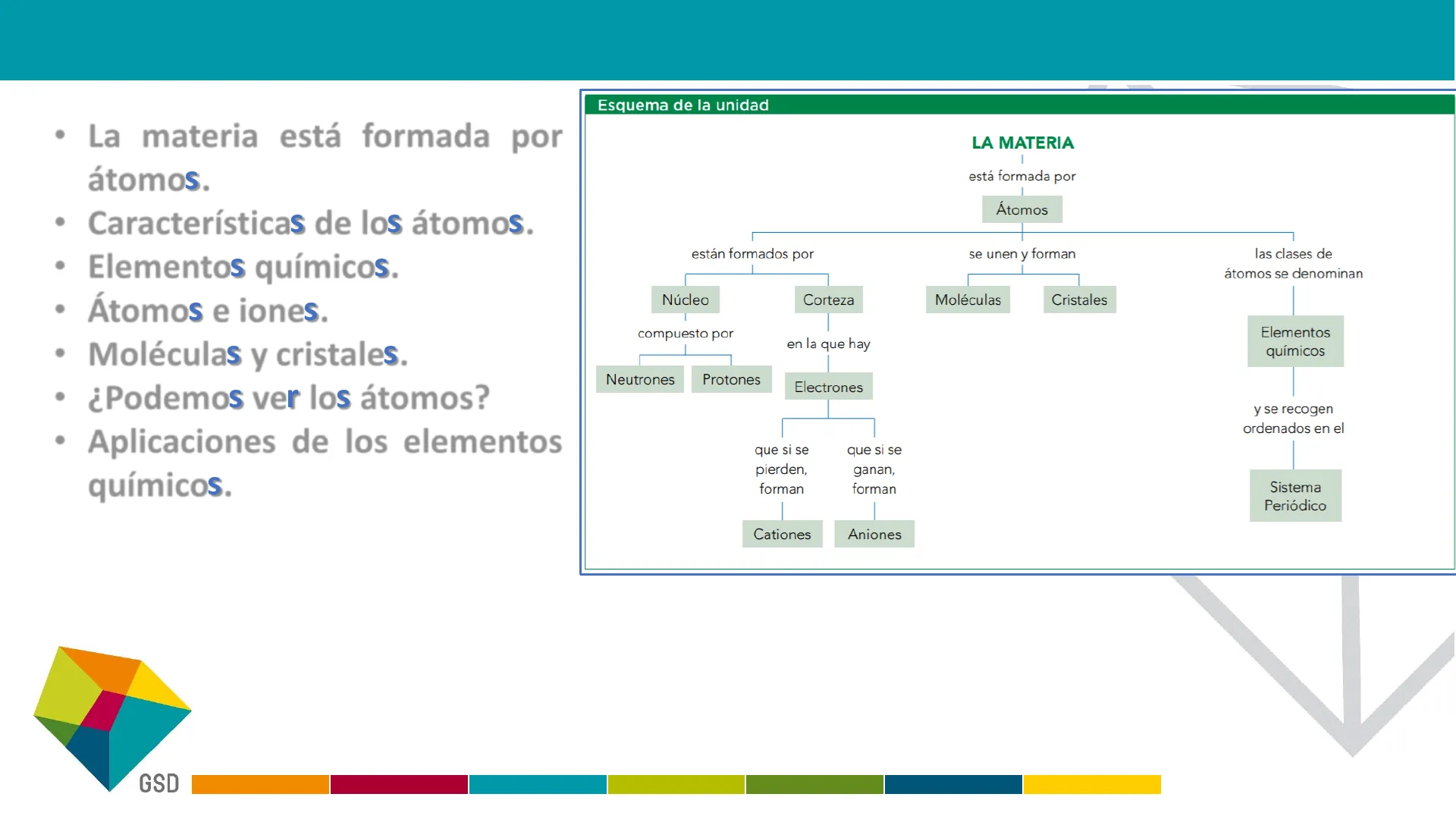
- La materia está formada por átomos.
- Características de los átomos.
- Elementos químicos.
- Átomos e iones.
- Moléculas y cristales.
- ¿ Podemos ver los átomos?
- Aplicaciones de los elementos químicos.
Esquema de la unidad
LA MATERIA está formada por Átomos están formados por se unen y forman las clases de átomos se denominan Núcleo Corteza Moléculas Cristales compuesto por en la que hay Neutrones Protones Electrones que si se pierden, forman que si se ganan, forman - Cationes Aniones Elementos químicos y se recogen ordenados en el Sistema Periódico
GSDConceptos previos
https://www.youtube.com/watch?v=wIbMW6U2t3M
GSDLa materia está formada por átomos
- En la antigua Grecia Demócrito planteo que la materia estaba formada por partículas indivisibles llamadas "átomos".
- Teoría atómica de Dalton:
- La materia está formada por pequeñas partículas indivisibles llamadas átomos
- Los átomos de distintos elementos tienen distintas propiedades y distinta masa.
- Los átomos de distintos elementos pueden combinarse entre sí para formar compuestos. Si se unen átomos iguales, obtenemos una sustancia simple o elemento.
- Cuando tiene lugar un cambio químico, los átomos que componen las sustancias se reordenan, obteniéndose sustancias nuevas
- Esta teoría permite explicar por qué las mezclas se pueden separa por medios físicos y las sustancias químicas requieren de un cambio químico.
GSDLa materia está formada por átomos
Clasificación de la materia
La materia en estudio ¿Está formada por particulas iguales? No SI Mezcla Sustancia pura ¿Es uniforme en todas sus partes? Los Stomos que forman las particulas, ¿ son iguales? Si No No SI Mezcla homogénea (disolución) Mezcla heterogénea Compuesto Sustancia simple
GSDCaracterísticas de los estados de agregación
CAMBIO FÍSICO CAMBIO QUÍMICO Se separan las sustancias que forman las mezcla, pero no los átomos que las forman Se separan los átomos que forman la sustancia y se unen de forma diferente, creando nuevas sustancias. AB A + B 2 H2O (1) - 2H2 (g) + O2 (g) ELECTROLYSIS Hydrogen Oxygen Catode Annde Water
GSD
FILTRACIÓNEjercicio 2 (página 69)
Según la teoría atómica de Dalton, un elemento está formado por átomos iguales; ¿ será posible obtener a partir de él una sustancia nueva mediante cambios químicos? Explica tu respuesta. Un cambio químico implica la aparición de sustancias nuevas. Si una sustancia está formada por átomos iguales, no será posible obtener una sustancia diferente, pues solo tendremos átomos de una clase.
GSDEjercicio (pagina og) y ejercicio
(página 69)*
¿Por qué decimos que el grafito es una sustancia simple? El grafito es una sustancia simple porque está formada por átomos de un mismo elemento, carbono. Existen otras sustancias, como el diamante, que están formadas, al igual que el grafito, por átomos de carbono. Busca información sobre la estructura del diamante y compárala con la del grafito de la página anterior. Explica las diferencias que encuentres entre ambas.
GSDEjercicio 5 (página 69)
Explica la diferencia entre elemento y compuesto según la teoría atómica. Una sustancia simple, está formada por átomos de la misma clase, mientras que un compuesto está formado por átomos de clases diferentes. Cada clase de átomos se denomina elemento químico.
GSDCaracterísticas de los átomos
TAMAÑO
- El tamaño de los átomos es muy pequeño, del orden de 10-10 m.
- La materia es discontinua, ya que está formada por partículas.
- Entre ellas debe existir una espacio vacío.
Comparación entre tamaños
o Proteínas Célula animal Huevo de gallina Mitocondria Óvulo humano Átomo Virus Célula vegetal Lípidos Huevo de rana Bacteria Huevo de avestruz 10-10 10-9 10-8 10-7 10-6 10-5 10-4 10-3 10-2 10-1 1 (m) ¡Debido a que el tamaño de los átomos es ínfimo, percibimos la materia continua!
GSD
Humano adultoCaracterísticas de los átomos
PARTÍCULAS QUE FORMAN EL ÁTOMO
- Se descubrió que el átomo era divisible y que estaba formado por 3 partículas (partículas subatómicas): protón, neutrón y electrón.
- Según el "modelo planetario" podemos distinguir dos zonas:
- Núcleo atómico: formado por los protones y neutrones, con un volumen muy pequeño comparado con el resto del átomo.
- Resto del atomo o corteza: espacio vacío donde se encuentran los electrones orbitando alrededor del núcleo.
Protón (carga positiva) Neutrón Electrón (carga negativa)
GSDCaracterísticas de los átomos
CARACTERÍSTICAS DE LAS PARTÍCULAS SUBATÓMICAS
Unidades del SI Unidades atómicas Partícula Carga (C) Masa (kg) Carga Masa (u) Protón +1,6 · 10-19 1,673 · 10-27 +1 1 Neutrón O 1,675 · 10-27 O 1 Electrón -1,6 · 10-19 9,109 · 10-31 -1 1/1830
- La masa del protón y el neutrón son parecidas.
- La carga de un protón y un electrón son iguales en valor absoluto pero de signo contrario.
- Los átomos son eléctricamente neutros, es decir, tienen igual número de protones y de electrones.
GSDEjercicio 6 (página 90)
¿Cuáles son las partículas que forman un átomo? ¿ Qué semejanzas y diferencias hay entre ellas? Organiza la información de tu respuesta en un esquema.
- Protones, neutrones y electrones.
- Protones y neutrones tienen una masa parecida, muy superior a la de los electrones.
- Electrones y protones tienen carga eléctrica, los neutrones no.
GSDEjercicio 7 y 11 (página 90)
Describe el núcleo del átomo y el resto del átomo. ¿ Qué hay entre estas dos partes del átomo? El núcleo del átomo está formado por protones y neutrones, por tanto tiene carga positiva. El resto del átomo, la denominada corteza, es un espacio vacío en el que se mueven los electrones, con carga negativa. Calcula la masa de un átomo formado por cuatro protones, cinco neutrones y expresa tu resultado en unidades de masa atómica. Sumamos protones y neutrones y tenemos 9 u.
GSDElementos químicos
- Un elemento químico es el conjunto de todos los átomos que tienen el mismo valor de
número atómico (Z).
A X Z o El número atómico (Z) es el número de protones que tiene un átomo. o El número másico (A) es la suma de protones y neutrones que tiene un átomo. Es la masa de un átomo en u.m.a. A = Z + N o Los símbolos químicos (X) pueden tener una o dos letras. Si tienen dos, la primera va en mayúsculas y la segunda en minúsculas.
https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom es.html
GSDElementos químicos
https://www.youtube.com/watch?v=5x9w1gBefzg
- El Sistema Periódico es una clasificación de los elemento químicos colocados en orden
creciente de su número atómico (Z). Consta de:
- 7 filas o periodos.
- 18 grupos, columnas o familias (propiedades químicas parecidas).
- Podemos distinguir
4
grupos
dependiendo de sus propiedades:
- Metales.
- Semimetales
- No metales.
Lantanidos 58 140,12 Ce 59 140,91 60 144,24 Pr Nd PHASEDOUMIO NEODIMIO 61 (147) Pm PROMENIO 62 150,35 Sm SAMARIO 63 151,96 Eu LEUBOPIO 64 157,25 Gd 65 158,92 Td TERBIO Dy DISPROSIO 67 164,93 Ho HOLMIO 68 167.26 Er 69 168,93 Tm JULIO 70 173.04 Yb 71 174,97 Lu LULECIO o Actínidos Th Pa U Np 94 (244) Pu 95 (243) Am AMERICIO 96 (247) Cm CURIO 97 (247) Bk 98 (251) 99 (252) Cf Es 100(257) Fm FERMIO 101 (258) Md MENDELEVIO 102 (259) No OT BRON 103 (262) Lr LAURENCIO
GSD
Metales Semimetales No metales Gases nobles Elementos químicos desconocidos 1 Número atómico Masa atómica ESTADO DE AGREGACIÓN 1º 1 1,008 H HIDRÓGENO B BORO -Símbolo Ne Gaseoso 13 14 15 16 17 2 4,003 He HELIO 5 10,811 B BORD C 7 14,007 N NITRÓGENO 8 15,999 O OXÍGENO 13 26,981 14 28,086 15 30,97 16 32,064 18 39,95 3.º Na SODIO Mg MAGNESIO 3 4 5 6 7 8 9 10 11 12 ALUMINIO FÓSFORO AZUFRE ARGÓN 19 39,102 21 44,956 22 47,90 23 50,942 24 51,996 25 54,938 26 55,847 27 58,933 28 58,71 29 63,54 31 69,72 32 72,59 34 78,96 4.º K Ca Sc Ti V Cr Mn MANGANESO Fe HIERRO Co COBALTO Ni NÍQUEL Cu COBRE Zn CINC Ga GALIO Ge GERMANIO 33 74,922 As ARSENICO 35 79,909 Br 36 83,80 Kr KRIPTÓN POTASIO 37 85,47 CALCIO 38 87,62 39 88,905 40 91,22 41 92,906 42 95,94 44 101,07 45 102,90 46 106,4 47 107,87 49 114,82 50 118,69 51 121,75 53 126,90 5.º Rb RUBIDIO Sr Y Zr CIRCONIO Nb NIOBIO Mo MOLIBUENO 43 (98) TC LECNECIO Ru RUTENO Rh RODIO Pd PALADIO Ag Cd CADMIO Sn ESTAÑO Sb ANTIMONIO 52 127,6 Te TELURQ 54 131,30 Xe XENÓN 55 132,9 56 137,34 57 138,91 72 178,49 73 180,95 74 183,85 75 186,2 76 190,2 77 192,2 78 195,09 79 196,97 80 200,59 81 204,37 82 207,19 83 208,9 84 (210) 85 (210) 6.º Cs CESIO Ba La Hf Ta W Re HENIO Os OSMIO Ir IBIDIO Pt PLATINO Au OBO Hg TI Pb Bi Po At ASIALO 86 (222) Rn HADÓN 87 (223) 88 (226) 89 (42/) 104 (265) 105 (268) 7.º Fr FBANCIO Ra RADIO Ac Rf Db DUBNIO 106(2/1) Sg 107 (2/0) Bh 108 (277) 109 (276) Mt Hs HASSIO 110 (281) Ds 112 (285) Cn 113 (284) Uut LUNUNTRIO 114 (289) FI FLEROVIO 115 (268) Uup LUNUNEENIO 116 (293) Lv 117 (294) Uus LINUNCERTO 118 (294) Uuo UNONOCHIO ACHINIO HUMMERFOUND SEABONGIO BOHHIQ MELLNERIO DARMSTADYO COFERNICKI 111 (280) Rg BOENIGEN O MHHCURID JALIO PLOMO BISMUTO POLONIO BARIQ LANIANO HAENIO TANIALO WOLFRAMIC ESTRONCIO PLAIA INDKY Si SILICIO P S 9 18,998 F FLÚOR 17 35,453 CI CLORO 10 20,183 Ne NEÔN 2.º Li 4 9,012 Be BERILIO Hg Líquido Fe Sólido Cf Sintético 3 6,939 6 12,011 Nombre CARBONO 11 22,99 12 24,305 AI Ar 20 40,08 ESCANDIO ILIANIO VANADIO CHOMO SELENIO BROMO 48 112,4 In YODO CERIO 90 232,04 91 (231) 92 238,03 93 (237) Gases nobles. PROSACINIO URANIO NEPTUNIO PLUTONIO BERKELIO ICALIFOHNIO EINSTENIO 66 162,5 GADOLINKO) EHBIO YIERBIO 18 5 10,811 - 2 Se 30 65,37
GSDEjercicio 11 y 12 (página 73)
Indica de qué elemento se trata en cada caso: a) Tiene 6 protones. b) Su número atómico es 9. c) Su símbolo es Ni. d) Si símbolo es N. a) Carbono; b) Flúor; c) Níquel; d) Nitrógeno Indica el nombre de los elementos químicos cuyos símbolos son: Ni, Mg, Ne, Ca, I y K. Níquel, magnesio, neón, nitrógeno, calcio, yodo y potasio
GSDEjercicio 13 y 14 (página 73)
Calcula el número de protones y neutrones de estos átomos: a) Z = 6; A = 14 b) Z =1; A =1 a) 6 protones y 8 neutrones; b) 1 protón y ningún neutrón. Indica el grupo y el periodo al que pertenecen estos elementos químicos, y escribe su símbolo químico: litio, sodio, berilio, aluminio, carbono, fósforo, azufre, oxígeno, cloro, potasio y nitrógeno. Sodio: grupo 1 y tercer período, Na. Berilio: grupo 2 y segundo período, Be. Aluminio: grupo 13 y tercer período, Al. Carbono: grupo 14 y segundo período, C. Fósforo: grupo 15 y tercer período, P. Azufre: grupo 16 y tercer período, S. Oxígeno: grupo 16 y segundo período, O. Cloro: grupo 17 y tercer período, Cl. Potasio: grupo 1 y cuarto período, K. Nitrógeno: grupo 15 y segundo período, N.