Compuestos oxigenados en química orgánica, Universidad Nacional Río Negro
Diapositivas de la Universidad Nacional Río Negro sobre Compuestos Oxigenados. El Pdf, un material de Química para Universidad, aborda la clasificación, nomenclatura y propiedades físicas de alcoholes, éteres, aldehídos, cetonas, ácidos carboxílicos y ésteres.
Ver más47 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Universidad Nacional Río Negro
Química Orgánica - 2024
u. Universidad Nacional Río Negro Sede Atlántica Química Orgánica- 2024 Licenciatura en Nutrición
Unidad III: Compuestos Oxigenados
Unidad III: Compuestos Oxigenados Capítulo XII y XIII (Fernández Cirelli, "Aprendiendo Química Orgánica") Capítulo XVII al XXIII (Morrison y Boyd, "Química Orgánica")
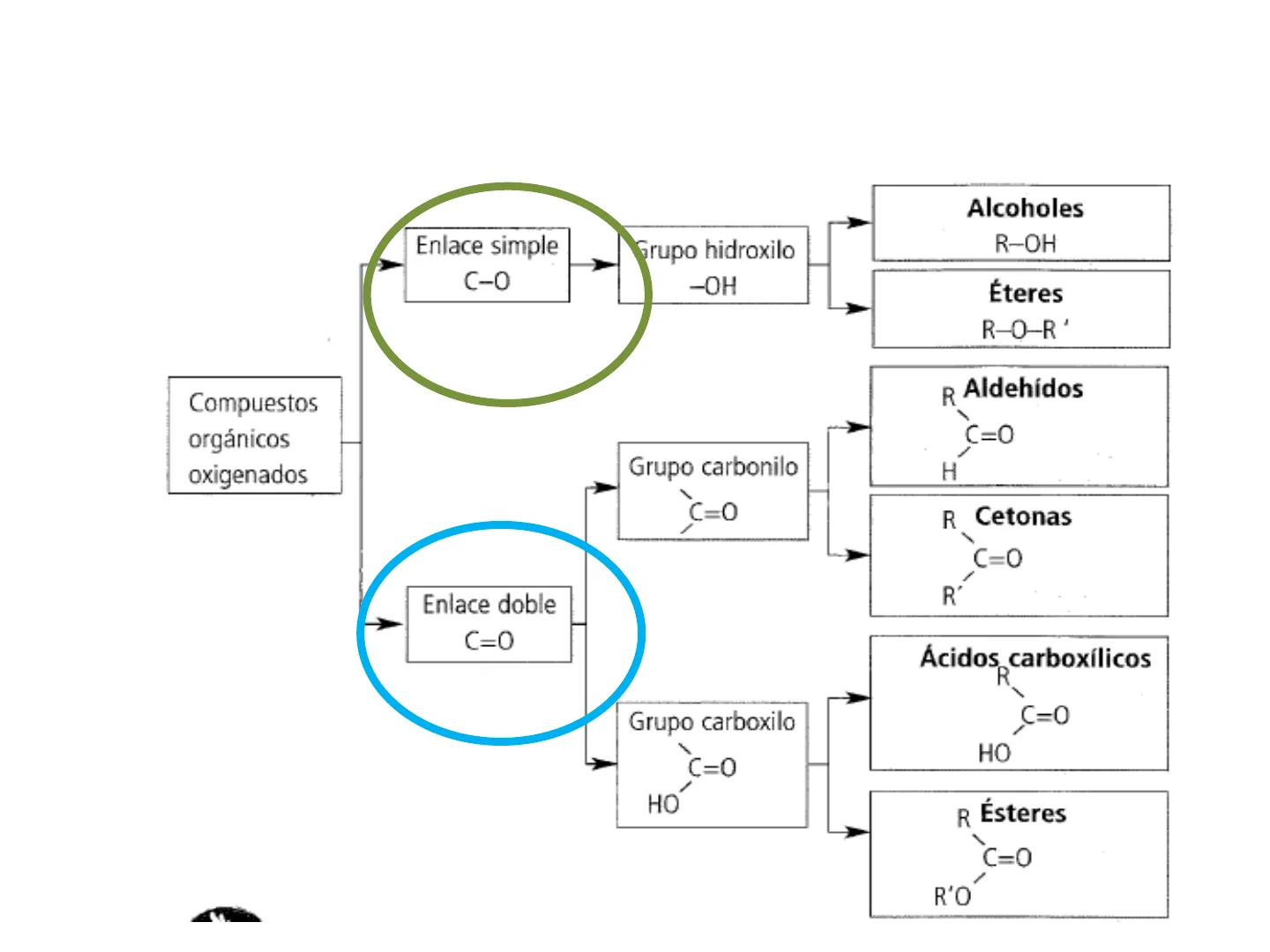
Compuestos Oxigenados
Compuestos Oxigenados
Alcoholes
Alcoholes R-OH Enlace simple C-0 Grupo hidroxilo -OH
Éteres
Éteres R-O-R'
Aldehídos
Aldehidos R C=0 H
Cetonas
R Cetonas C=0 R Enlace doble C=0
Ácidos Carboxílicos
Ácidos carboxílicos R - C=0 Grupo carboxilo C=0 HO HO R
Ésteres
Ésteres C=0 - R'O
Grupo Carbonilo
Compuestos orgánicos oxigenados Grupo carbonilo C=0
Alcoholes
Alcoholes hibridación sp 3 todos enlaces simples C-C grupo funcional hidroxilo-> C-OH terminación "ol"
Ejemplos de Alcoholes
ETHANOL 90% P.A. CH3-CH2-OH Methanol Methylalkohol CH3-OH R: 11-23/24/25- 39/23/24/25 S: 7-16-36/37-45 22 Giftklasse: 3
Nomenclatura de Alcoholes
Ejemplos para nombrar H I H - C -OH Metanol エ H .C C 1 H H H Etanol Methanol Methylalkohol CH3-OH R: 11-23/24/25- 39/23/24/25 S: 7-16-36/37-45 Giftklasse: 3 224 H3C *OH CH3 2-metilbutanol H
Características de los Alcoholes
Los alcoholes son compuestos que poseen un grupo hidroxilo, -OH, unido a una cadena carbonada. En el laboratorio los alcoholes son quizá el grupo de compuestos mas empleado como reactivos en síntesis. Se caracterizan por la gran variedad de reacciones en las que intervienen, estos son subproductos normales de la digestión y de los procesos químicos en el interior de las células, y se encuentran en los tejidos y fluidos de animales y plantas.
Clasificación de Alcoholes
Según el tipo de carbono al cual esta unido el grupo hidroxilo en la cadena, los alcoholes se clasifican en primarios, secundarios y terciarios.
Alcoholes Primarios
CH3-CH2-OH CH3-CH2-CH2-OH CH3-CH-CH2-OH CH3 ALCOHOLES PRIMARIOS ethanol propan-1-ol 2-methylpropan-1-ol
Alcoholes Secundarios
OH CH3-CH-CH3 OH CH3-CH-CH2-CH3 OH CH3-CH2-CH-CH2-CH3 ALCOHOLES SECUNDARIOS propan-2-ol butan-2-ol pentan-3-ol
Alcoholes Terciarios
ALCOHOLES TERCIARIOS OH - CH3-C-CH3 - CH3 OH 1 CH3-CH2-C-CH3 CH3 2-methylpropan-2-ol 2-methylbutan-2-ol
Propiedades Físicas de Alcoholes
Propiedades físicas Punto de ebullición, de fusión y solubilidad: El OH le confiere polaridad y la posibilidad de formar puentes de hidrógeno entre ellos mismos dando "moléculas asociadas" por lo que poseen puntos de ebullición y fusión superiores a los alcanos respectivos y mayor solubilidad en agua. Entre las moléculas de alcohol hay enlaces por puentes de hidrógeno. En los alcanos las únicas fuerzas intermoleculares son las fuerzas de dispersión de London
Unión Puente de Hidrógeno
Recordando !!! Unión puente de Hidrógeno (caso particular dipolo-dipolo): Son aquellos tipos de fuerzas que se dan entre el hidrógeno y un átomo pequeño y muy electronegativo. Este requisito lo cumplen el nitrógeno, oxígeno y el fluor. H N- -H O ....-- H H O HH H HH HH H H-F .------ H H H O N N ...... H-F HH HH HH H H O ----- H N H N Ejemplos: El agua (H2O), el fluoruro de hidrógeno (HF) y el amoníaco (NH3).
Solubilidad de Alcoholes
La parte carbonada es no-polar y resulta hidrófoba. Cuanto mayor es la longitud del alcohol su solubilidad en agua disminuye y aumenta en disolventes poco polares. Muy soluble en agua Poco soluble en hexano Partes hidrófobas . . Partes hidrófilas Muy poco soluble en agua Muy soluble en hexano
Acidez de Alcoholes
Acidez: Los alcoholes son especies anfoteras (anfiproticas), pueden actuar como ácidos o bases. En disolución acuosa se establece un equilibrio entre el alcohol, el agua y sus bases conjugadas. ROH + HO K a = RO ion alcóxido + H3 [H3O IRC ] Ka = [ROH] pKa = - logKa CH OH pKa = 15.5 CH3CH2OH pKa = 15.9 (CH3)2CHOH pKa = 17.1 (CH3)3COH pKa = 18 menos ácido CH3CH2OH pKa = 15.9 CICH2CH2OH pKa = 14,3 FACCH OH pKa = 12,4 más ácido
Estabilidad del Ion Alcóxido
La acidez de un alcohol se puede establecer cualitativamente observando la estabilidad del ion alcóxido correspondiente. CH OH > pri mario : secundario > terciario Acidez creciente Más ácido Menos ácido CHO > 1º-0° > 2-0° > 3º-0° Inestabilidad creciente Más Menos estable estable
Alcoholes en la Naturaleza
CH2OH geraniol Forman parte del aceite de geranio y aceite de rosas, usado en perfumería. HO colesterol Constituyente de membranas biológicas y base estructural de hormonas. R CH2OH HO R alcohol coniferílico (R=OCH3, R' = H) alcohol sinapílico (R=R'=OCH3) alcohol cornarílico (R=R'=H) Forman parte de la lignina, componente de las paredes de células vegetales
Éteres
Éteres hibridación sp3 todos enlaces simples C-C grupo funcional → C-O-C Son compuestos que resultan de la unión de dos radicales alquílicos o aromáticos a través de un puente de oxígeno
Nomenclatura de Éteres
1- Palabra "éter" seguida de los dos grupos unidos al oxígeno (orden alfabético). El primero con terminación "il" y el segundo con terminación "oico" 2- Nombrar los dos grupos alquilo en orden alfabético seguido por la palabra "éter"
Ejemplos de Éteres
Ejemplos para nombrar CH3 3 / 0-CH2 CH3 3 Éter etil etanoico CH3CH2OCH2CH3 Etil metil éter 1 -- - M
Propiedades Físicas de Éteres
Propiedades físicas Los éteres tienen propiedades muy diferentes a las de los alcoholes; debido a que NO POSEEN átomos de hidrógeno unidos al oxígeno, no forman puentes de hidrógeno y sus propiedades físicas se parecen más a las de los alcanos. Los de bajo peso molecular tienen bajos puntos de fusión y ebullición.
Aldehídos y Cetonas
Aldehídos y Cetonas O=( C R R El grupo carbonilo consiste de un átomo de oxígeno enlazado a un carbono mediante un doble enlace. El doble enlace está formado por el solapamiento de órbitales sp2. El C=O y los otros dos átomos enlazados al carbono son co-planares.
Características de Aldehídos
Aldehídos: grupo funcional carbonilo-> C=O siempre en un carbono primario terminación "al"
Características de Cetonas
Cetonas: grupo funcional carbonilo-> C=O siempre en un carbono secundario terminación "ona"
Ejemplos de Nomenclatura
Ejemplos para nombrar C C H3C CH3 3 Butanal Propanona E alamy a a a a a alamy a CHỊCOCH Propanone (acetone) a ! alamy a a a H
Momento Dipolar del Grupo Carbonilo
El doble enlace del grupo carbonilo tiene mayor momento dipolar debido a que el oxígeno es más electronegativo que el carbono y los electrones enlazantes no están igualmente compartidos. - R R . 1 c=0. < - +C-0: .. R R mayoritario minoritario
Propiedades Físicas de Aldehídos y Cetonas
Propiedades físicas Los aldehídos y cetonas poseen un elevado momento dipolar que hace que existan entre sus moléculas intensas fuerzas de atracción del tipo dipolo-dipolo, por lo que estos compuestos tienen puntos de fusión y de ebullición más altos que los de los hidrocarburos de análogo peso molecular. CH,CH,CH,CH3 CH3-0-CH,CH3 butano pe =0℃ metoxietano pe = 8°℃ 0 II CHỊCH,-C-H propanal pe =49°℃ CH2-C-CH2 0 acetona pe =56℃ CH,CH,CH,-OH 1-propanol pe =97ºCEl grupo carbonilo rige la química de los aldehídos y cetonas de dos maneras: a) Proporciona un sitio para la adición nucleofílica. b) Aumenta la acidez de los H unidos al C a. La reacción común de aldehídos y cetonas es la adición nucleofílica. : Z Z Z R' + R - R I C HO R'-C R OH Reactivo trigonal) Reactivo de transición 'tetraédrico) Producto Z 8- C=0 C R R
Adición Nucleofílica
Adición nucleofílica Un nucleófilo es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinandose y enlazándose covalentemente con ella. Puede ser un anión o una molécula neutra con un par de electrones libres. Ej: I - ; Br- ; Cl- ; OH- : Z Z Z R' 1 HO 2 R'-C - R R- R OH Reactivo (trigonal) Reactivo de transición 'tetraédrico) Producto Z R' 8+ 0=0 R 8- C C - R-Los aldehídos sufren adición nucleofílica con mayor facilidad que las cetonas. Esto se debe a dos factores: · Electrónico: el grupo alquilo libera e-, por lo que debilita el estado de transición. Cuando más grupos alquilos están unidos más estable es la carga parcial positiva del carbono del grupo carbonilo y por ende más estable es el compuesto. 8. 8. :0: :0: S. + 8. H R R' 1 - · Estéricos: donde el aldehído tiene un H, la cetona tiene un grupo alquilo que es mas grande.
Importancia en la Naturaleza
Importancia en la naturaleza Las cetonas se usan para sintetizar la vitamina A. Formaldehido: en solución acuosa se usa para embalsamar o preservar (formalina). Se usa en materiales aislantes en la construcción Acetona- solvente industrial más utilizado. Monosacárido y disacáridos: Aldosas (glucosa) y cetosas (fructosa)
Reacciones Importantes
Oxidación de Aldehídos
Reacciones importantes Oxidación de aldehídos Con Reactivo de Tollens: el reactivo oxida al aldehído y se reduce a sí mismo formando un espejo de plata. se reduce CH,-CHO + Ag(NH.) + + 2 OH - CH .- COOH + Ag(s) + 2 NH, + H,O 3 2' 3 2 etanal ácido etanoico (o su sal CH- COO Na+) 3 se oxida
Oxidación con Licor de Fehling
Con Licor de Fehling: desaparece el color intenso azul del licor y precipita óxido cuproso rojo. Esta reacción se utiliza para calcular el porcentaje de azúcar en solución. se reduce CH,-CHO + 2 Cu +2 - + 4 0H 3 CH .- COOH + |Cu O .. + 2 H.O 13 2 ácido etanoico : óxido cuproso (rojizo) etanal se oxida
Ácidos Carboxílicos
Ácidos Carboxílicos todos los enlaces simples C-C grupo funcional carboxilo-> HO-C=O siempre en el carbono 1 se antepone la palabra ácido y terminación "oico" = C R OHSon compuestos muy abundantes en la naturaleza, por ello, un gran numero de ellos presentan nombres comunes relacionados con su origen. Los de bajo PM son líquidos incoloros y de olor penetrante y desagradable.
Nombres Comunes y IUPAC
| Atomos de carbono | Fórmula | Origen | Nombre común | Nombre IUPAC |
| 1 | HCOOH | hormigas (latín, formica) | ácido fórmico | ácido metanoico |
| 2 | CH3COOH | vinagre (latín, acetum) | ácido acético | ácido etanoico |
| 3 | CH3CH2COOH | leche (griego, protos pion, grasa principal) | ácido propiónico | ácido propanoico |
| 4 | CH3(CH2)2COOH | mantequilla (latín, butyrum) | ácido butírico | ácido butanoico |
| 5 | CH3(CH2)3COOH | raíz de valeriana (latín, valere, ser fuerte) | ácido valeriánico | ácido pentanoico |
| 6 | CH3(CH2)4COOH | cabras (latín, caper) | ácido caproico | ácido hexanoico |
| 7 | CH3(CH2)5COOH | enredadera en flor (griego, oenanthe) | ácido enántico | ácido heptanoico |
| 8 | CH3(CH2)6COOH | cabras (latín, caper) | ácido caprílico | ácido octanoico |
| 9 | CH3(CH2)7COOH | pelargonio (una hierba que presenta cápsulas, en forma de cigüeña, que contienen las semillas; del griego, pelargos, cigüeña) | ácido pelargónico | ácido nonanoico |
| 10 | CH3(CH2)8COOH | cabras (latín, caper) | ácido cáprico | ácido decanoico |
Grupo Funcional Carboxilo
El grupo funcional de un ácido carboxílico es el grupo carboxilo O . -C -COOH -CO2 H 1 H-Ö: La formula general de un ácido carboxílico alifático es RCO2H
Propiedades Físicas de Ácidos Carboxílicos
Propiedades físicas En los estados sólidos y líquidos, los ácidos carboxílicos se unen mediante enlaces de hidrógeno entre dos estructuras dímeras. 8- 8+ 8+ 8-Los ácidos carboxílicos son compuestos polares y forman enlaces intermoleculares muy fuertes por puentes de hidrógeno. -Tienen más altos puntos de ebullición que otros compuestos orgánicos de similar peso molecular. -Son más solubles en agua que los alcoholes, éteres, aldehídos o cetonas con similar peso molecular.