El modelo atómico actual y sus aplicaciones en la química
Documento de Bachillerato sobre el modelo atómico actual y sus aplicaciones. El Pdf explica los números cuánticos (principal, secundario, magnético y de spin) y la regla de Kernel para la configuración electrónica, incluyendo una actividad práctica. También aborda la configuración gráfica y el diagrama energético en Química.
Ver más14 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Electrones y Niveles de Energía
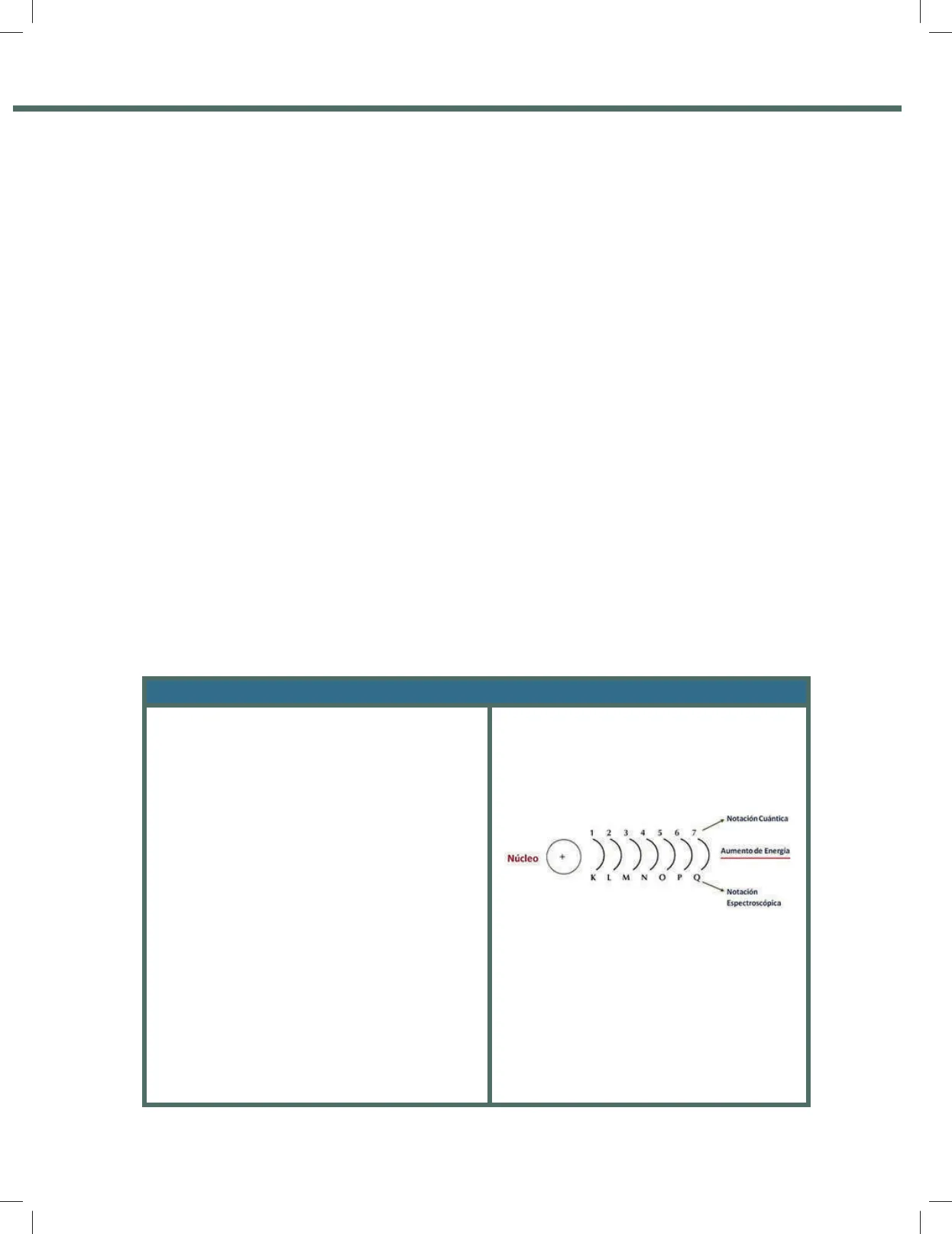
· Los electrones de un átomo se localizan en siete niveles de energía, siendo el 1 el más cercano y el 7 el más alejado. · En cada nivel energético, los electrones se encuentran distribuidos en diferentes subniveles de energía, que por la forma gráfica en que se aprecian en el revela- do de una placa fotográfica resultado del espectro de emisión electromagnético (semejante a una radiografía) reciben los nombres de sharp, principal, difusse y fundamental. Simbólicamente se representan por: s, p, d y f.
Números Cuánticos
Los números cuánticos son parámetros asociados a magnitudes numéricas que ayudan a determinar la distribución de los electrones en un átomo. Los números cuánticos nos ayudan a entender la forma en que se distribuyen los electrones en los orbitales atómicos. Se basan en la teoría cuántica que considera que el átomo presenta un núcleo atómico formado por protones y neutrones y los electrones se encuentran rodeándolo en niveles de energía específicos, describien- do trayectorias definidas, con una orientación determinada y los electrones girando además sobre su propio eje. Los números cuánticos permiten determinar estas ca- racterísticas. A continuación estudiaremos los números cuánticos.
Número Cuántico Principal
- Se representa con la letra (n).
- Determina el nivel de energía en el que se en- cuentra un electrón.
- Se representa por números enteros y toma valores a partir de 1.
- En Química se representan mediante letras mayúsculas iniciando con la letra K.
- Para los átomos que se conocen hasta ahora, el máximo nivel de energía que ocupan los electrones es 7.
- Se relaciona con la distancia promedio del electrón al núcleo.
- Este número cuántico representa la energía dentro del átomo, por lo tanto, a mayor valor, mayor energía.
- El máximo número de electrones que puede soportar un nivel de energía se calcula mediante la expresión 2n2, donde n es el nivel de energía.
Notación Cuántica Núcleo O 1 2 3 4 5 6 7 Aumento de Energía KLMNOPQ Notación Espectroscópica En este esquema la letra n=1=K, n=2=L, n=3=M, n=4=N, n=5=O, n=6= P, n=7=Q. 121B loquel
Número Cuántico Secundario
- Se representa con la letra ( e).
- También se conoce como número cuántico azimutal.
- Determina la forma del orbital.
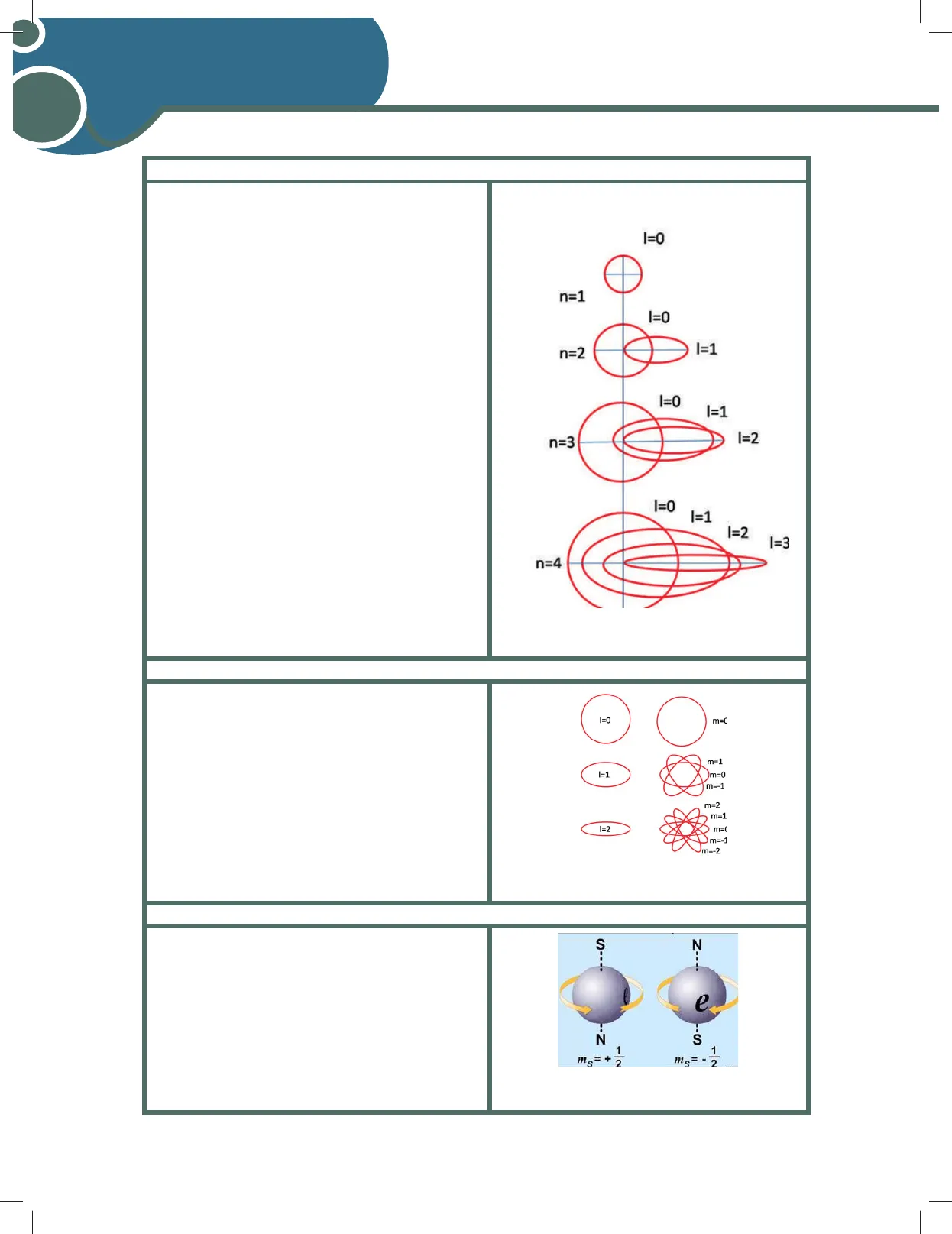
- Toma valores desde 0 hasta n-1, es decir, a cada nivel energético le corresponde un número específico de subniveles u orbitales. Por ejemplo: Si n = 1, entonces e = 0, lo que indica que, en el primer nivel energético, el orbital tendrá una sola forma. Si n = 2, entonces / puede tener dos valores: 0 y 1. Si / = 0 se le asigna la letra s y si | = 1 se le asigna la letra p. Si n = 3, entonces / tiene 3 valores: 0, 1 y 2, lo que indica que para el tercer nivel de energía, habrá tres subniveles: s, p y d. Si n = 4, entonces / tiene 4 valores: 0,1, 2 y 3, lo que indica que para el cuarto nivel energético, habrá 4 subniveles: s, p, d y f
- A cada subnivel, se le asignan las letras s, p, dyf.
- Cada orbital soporta como máximo 2 electrones.
- Para los átomos que actualmente se conocen son suficientes cuatro subniveles.
I=0 n=1 I=0 I=1 n=2 I=0 I=1 1=2 n=3 I=0 I=1 1=2 1=3 n=4 Representación del número cuántico secundario o azimutal.
Número Cuántico Magnético
- Se representa por la letra (m).
- Determina la orientación del orbital en el espacio (número de orbitales).
- Se representa desde + / hasta - / incluyendo el cero.
1=0 m=0 m=1 I=1 m=0 m =- 1 m=2 m=1 1=2 m=C m =- 1 m =- 2 El número cuántico magnético se representa con la letra m.
Número Cuántico Spin
- Se representa por la letra s.
- Número cuántico de spin.
- Se relaciona con el giro del electrón.
- Toma sólo dos valores + 1/2 y - 1/2.
- Gráficamente se puede representar por dos vectores en dirección opuesta. Como se indica en la figura 14.
N 5 ---- Z ---- e e N S 1 ms=+2 ms =- 2 El número cuántico spin, tiene relación con el giro del electrón, a la derecha (+), a la izquierda (-). 122Explicas el modelo atómico actual y sus aplicaciones
Valores de los Números Cuánticos
Valores que toman cada uno de los números cuánticos
| Orbital | Número máximo de electrones que acepta |
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
| Orbital | Valor de l | 1 | Valores de m | Valores de m ( -.... + .... () |
| s | 0 | 0 | 1 | |
| p | 1 | -1, 0, +1 | 3 | |
| d | 2 | -2, -1, 0, +1,+2 | 5 | |
| f | 3 | -3,-2, -1, 0, +1,+2, +3 | 7 |
Con lo anterior podemos determinar el valor de los números cuánticos. En este momento veremos una representación general de éstos. En el siguiente tema los integraremos.
Ejemplo de Determinación de Números Cuánticos
Ejemplo: A partir de una configuración electrónica correctamente escrita es posible determinar los valores de los cuatro números cuánticos. a) 1H = 1s1 Analicemos ahora esta información para determinar los valores de los cuatro números cuánticos 1. El elemento del que se trata es el hidrógeno y tiene un solo electrón. 2. Es importante identificar los siguientes elementos de esta configuración. 3. Como puedes observar, la figura nos indica que el electrón se ubica en el primer nivel de energía, por lo tanto n = 1.
Número cuántico principal (n) Número de Electrones 1S1 Subnivel de energía (Orbital) 123Bloque !!!
4. Otro elemento importante es el subnivel, el cual indica que es el orbital s, por lo tanto e = 0. 5. Si el valor de m depende del valor de e, entonces puedes concluir que si e= 0, m = 0. 6. Por último, sabes que en el subnivel s, sólo hay dos electrones y en este caso nos indica que es 1, se trata del primer electrón, el cual gira hacia la derecha (+) S= +- 1 2 0 1.
Actividad 5: Mapa Conceptual de Números Cuánticos
Aplica lo aprendido Actividad 5 Instrucciones: Siguiendo el esquema que se encuentra a continuación, desarrolla un mapa conceptual en tu cuaderno de trabajo con la información que se te solicita sobre los números cuánticos. Consulta la rúbrica que se te propone al final del blo- que para apoyar la realización de tu actividad. Puedes hacer tu propio modelo de mapa conceptual.
Números cuánticos
n m S
Nombre: Representa: Valores que toma:
Nombre: Representa: Valores que toma:
Nombre: Representa: Valores que toma:
Nombre: Representa: Valores que toma:
No olvides revisar la retroalimentación en el apéndice 2 al final del libro. 124Explicas el modelo atómico actual y sus aplicaciones
Reflexión sobre la Actividad 5
Reflexionemos sobre la actividad 5 ¿De qué te das cuenta? Los números cuánticos son parámetros desarrollados que te permiten conocer la ubicación más probable de un electrón en un átomo.
Configuración Electrónica
Aprende más Configuración electrónica Cuando se hace referencia a la configuración electrónica del átomo de un elemen- to determinado estamos hablando de la probable distribución de los electrones de acuerdo con los parámetros cuánticos. La configuración electrónica de un átomo es la distribución más estable de sus electrones en los diferentes niveles, subniveles y orbitales en orden de energía creciente. La configuración electrónica permite identificar las propiedades y comportamiento químico de los átomos de un elemento al conocer el número de electrones que se encuentran en el nivel de energía más lejano al núcleo atómico. A estos electrones se les conoce como electrones de valencia. Para elaborar las configuraciones electrónicas se siguen los siguientes principios o reglas.
Principio de Exclusión de Pauli
Principio de exclusión de Pauli Establece que un orbital sólo puede tener un máximo de dos electrones, los cua- les deben tener un spin opuesto, por lo que dos electrones en un mismo átomo no pueden tener iguales sus números cuánticos. El número máximo de electrones se puede calcular con la fórmula 2n2. 125B loquel
| Valor n | Según la fórmula 2n2 | Número máximo de electrones |
| 1 | 2(1)2 | 2 |
| 2 | 2(2)2 | 8 |
| 3 | 2(3)2 | 18 |
| 4 | 2(4)2 | 32 |
s2= 11 s2 incorrecto
s2= - s2
correcto
Regla de Edificación Progresiva o Principio de Aufbau
Regla de edificación progresiva o principio de Aufbau Establece que cada nuevo electrón añadido a un átomo entrará en el orbital dis- ponible de menor energía. Los electrones deben acomodarse primero en aquellos subniveles cuya suma de n + e sea la de menor valor. El principio de Aufbau señala una serie de instruccio- nes acerca de la ubicación de los electrones en los orbitales de un átomo e indica la asignación de elec- trones en función de su energía ascendente. Para elaborar la configuración electrónica de los áto- mos, se sigue el orden que está marcado con la flecha roja de la figura, iniciando con 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, etc.
diagrama de Moeller 15 25 25 35 3x 3d 48 4p 40 Af 55 50 50 5f Gs Sp Gd 7's 7p Esquema del llenado de los orbitales atómicos.
Recordemos que los exponentes o superíndices indi- can el número máximo de electrones que acepta un orbital de acuerdo con el nú- mero de orientaciones. La regla de las diagonales es el resultado de la regla de la máxima sencillez o regla de Yeou-Ta, que dice que los electrones se disponen primero ocupando los orbitales en los que la combinación n + e es de menor valor.
| Valor de n | Valor de e | n + e | |
| 1 | 0 | s | 1 |
| 2 | 1 | p | 3 |
| 2 | d | 5 | |
| 3 | 1 | p | 4 |
| 0 | s | 3 | |
| 3 | f | 7 | |
| 2 | d | 6 | |
| 4 | 1 | p | 5 |
| 0 | s | 4 |
| Valor de n | Valor de l | n + e | |
| 3 | f | 8 | |
| 2 | d | 7 | |
| 5 | 1 | p | 6 |
| 0 | S | 5 | |
| 2 | d | 8 | |
| 6 | 1 | p | 7 |
| 0 | S | 6 | |
| 1 | p | 8 | |
| 7 | 0 | S | 7 |
126Explicas el modelo atómico actual y sus aplicaciones Para comprender la tabla anterior y el esquema de las diagonales como resultado de ella, observa con detenimiento la siguiente tabla:
| 1 | 1+0 | 1s | 2 |
| 2 | 2+0 | 2s | 2 |
| 3 | 2+1 | 2p | 6 |
| 3 | 3+0 | 3s | 2 |
| 4 | 3+1 | 3p | 6 |
| 4 | 4+0 | 4s | 2 |
| 5 | 3+2 | 3d | 10 |
| 5 | 4+1 | 4p | 6 |
| 5 | 5+0 | 5s | 2 |
| 6 | 4+2 | 4d | 10 |
| 6 | 5+1 | 5p | 6 |
| 6 | 6+0 | 6s | 2 |
| 7 | 4+3 | 4f | 14 |
| 7 | 5+2 | 5d | 10 |
| 7 | 6+1 | 6p | 6 |
| 7 | 7+0 | 7s | 2 |
| 8 | 5+3 | 5f | 14 |
| 8 | 6+2 | 6d | 10 |
| 8 | 7+1 | 7p | 6 |
Si observas el orden de esta tabla y lo comparas con el esquema de las diagonales, comprobarás que es idéntico.
Principio de Máxima Multiplicidad o Regla de Hund
Principio de máxima multiplicidad o regla de Hund Establece que los electrones de un mismo nivel energético se distribuyen de uno en uno con espines en el mismo sentido, en orbitales separados, siempre que sea posible. La distribución electrónica de cada uno de los átomos se puede comprender de mejor manera con la representación gráfica de los electrones, sustituyendo los superíndices o exponentes (número de electrones) por flechas o vectores, como se muestra a continuación:
3s1= 3s 2p 2p 2p 405= 1\\\\ 4d 4d 4d 4d 4d 47= 1 1 4f 4f 4f 4f 4f 4f 4f Para desarrollar la configuración electrónica se siguen los siguientes pasos: 1. Se tiene presente el esquema de la regla de las diagonales: 1s212s22p6 /3s23p6/4s23d104p6 15s24d105p6 /6s24f145d106p6 17s25f146d107p6 2. Se identifica el elemento y su número atómico, recuerda que: Z= p+ y e 127