Le particelle subatomiche e il modello atomico nucleare
Documento sulle particelle subatomiche e il modello atomico nucleare. Il Pdf, utile per la scuola superiore in Fisica, esplora l'evoluzione dei modelli atomici da Dalton agli orbitali, discutendo cariche elettriche, legge di Coulomb e il principio di indeterminazione di Heisenberg.
Mostra di più14 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Teoria Atomica di Dalton
Sulla base numerosissimi dati scientifici, raccolti in due secoli di pratica chimica e in accordo con quanto sostenuto dalle leggi ponderali, John Dalton, elaborò la propria teoria. Egli intuì che solo immaginando la materia discontinua e formata da particelle infinitamente piccole , ma finite, indistruttibili, indivisibili, e non creabili si potevano spiegare i rapporti di combinazione tra esse, esprimibili sempre e solo da numeri interi e piccoli.
La Teoria Atomica di Dalton (1808) sostiene che ciascun elemento chimico sia formato da particelle elementari, piccolissime ed indivisibili chiamate atomi. Gli atomi di ciascun elemento chimico sono uguali tra loro per massa, volume e proprietà. Atomi diversi si combinano per formare dei composti e il rapporto tra le quantità di atomi dei singoli elementi in ciascun composto è costante.
Nella seconda metà del XIX secolo la comunità scientifica iniziò a porsi dei quesiti sulla completezza della teoria di Dalton. Esistevano infatti delle evidenze che questa teoria non era in grado di spiegare:
- la comparsa di cariche elettriche su corpi strofinati
- l'evidenziarsi di cariche elettriche in soluzioni attraversate da corrente
- l'emissione spontanea di radiazioni da particolari sostanze (radioattività)
Limiti della Teoria di Dalton
QUINDI LIMITI DI DALTON-> ho pensato che la materia era fatta di atomi senza considerare le cariche elettriche
- comparsa di cariche elettriche su corpi sfregati ex: pena sfregata su lana attacca la la la carta
- E evidenziarsi di carica elettriche in soluzioni attraversate da corrente ( ex: soli che nell'acqua si ionizzano permettono il passaggio della corrente)
- scoperta della radioattività
Gli scienziati iniziarono a chiedersi se l'atomo fosse davvero la particella "ultima" e iniziarono a cercare l'eventuale presenza di particelle subatomiche.
Cariche Elettriche e Legge di Coulomb
L'esistenza di due tipi di carica elettrica fu scoperta dal fisico francese Cisternay du Fay nel settecento, egli le chiamò elettricità resinosa: prodotta dallo strofinio di materiali come l'ambra e la gomma; ed elettricità vetrosa: prodotta dallo strofinio di materiali come il vetro e la mica.
alla base delle forze elettriche che si manifestano tra corpi c'è la carica elettrica= una grandezza che misura lo stato di elettricità dei corpi-> questa proprietà si può manifestare in due forme: carica positiva (+) e carica negativa (-).
tra cariche elettriche dello stesso tipo si manifestano forze repulsive mentre tra cariche elettriche di tipo contrario vi sono forze attrattive.
un contributo fondamentale alle conoscenze sulla carica elettrica venne per opera dello scienziato francese C. Coulomb, che condusse esperimenti per stabilire la relazione tra le cariche elettriche e le forze che si manifestano tra esse utilizzando la bilancia di torsione.
- Nel 1785 il fisico francese C.A. de Coulomb dedusse sperimentalmente una legge, nota come legge di Coulomb.
La Legge di Coulomb
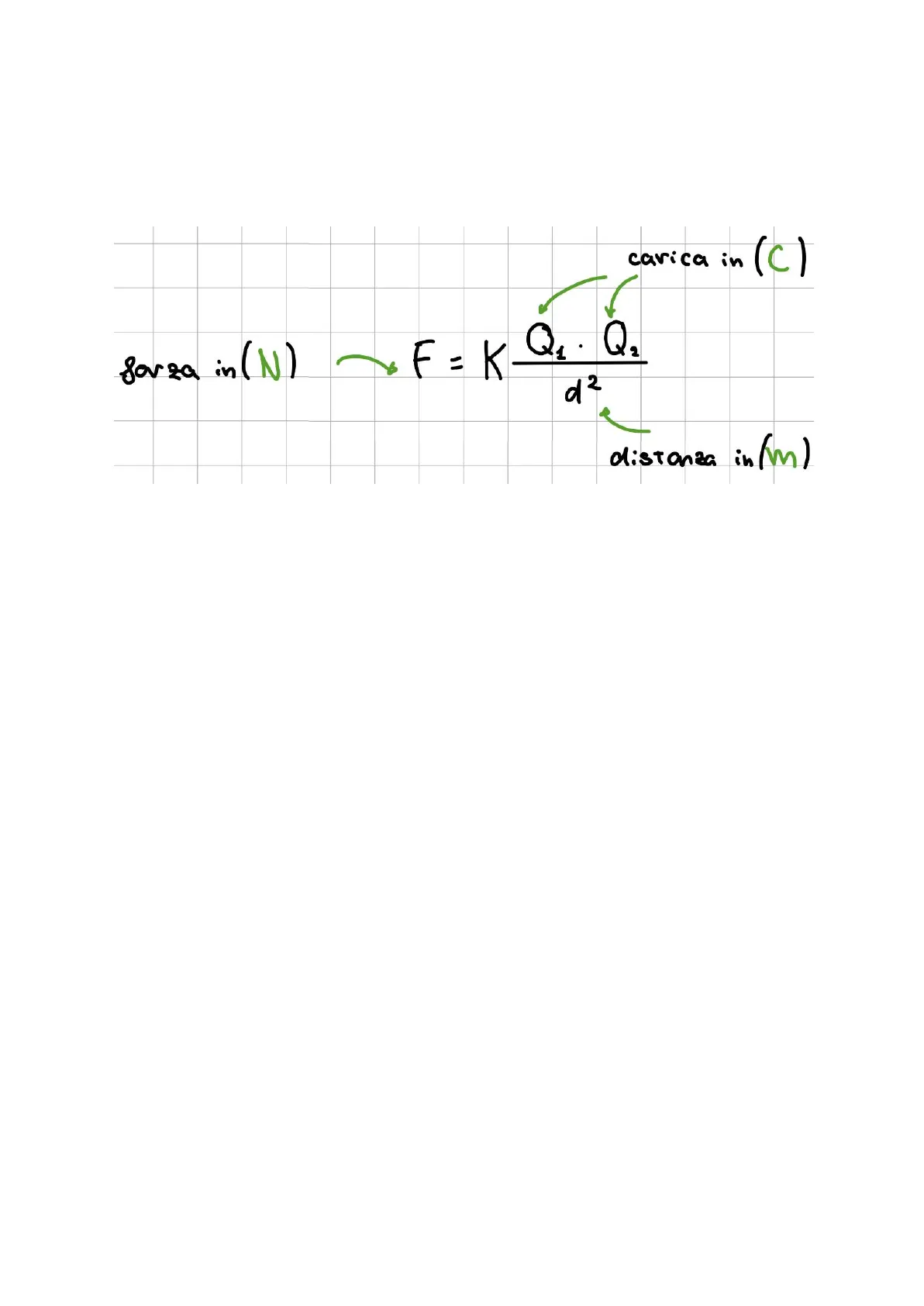
LA LEGGE DI COULOMB-> stabilisce che l'intensità della forza che si manifesta tra due cariche elettriche è direttamente proporzionale a ciascuna carica e inversamente proporzionale al quadrato della distanza che le separa.
arica in (C) carica in forza in (N) F = K Q1. Q. 3 distanza i in (m)
il valore della costante K cambia seconda del materiale che si interpone tra le cariche, nel vuoto vale 9,0 · 10^9 N·m^2/C2. nell'aria secca il suo valore si può approssimare a quello indicato per il vuoto.
la forza di coulomb è:
- attrattiva = per cariche di segno opposto
- Repulsiva= per cariche con lo stesso segno
La Ricerca delle Particelle Subatomiche
Per dare una spiegazione ai fenomeni elettrici fu quindi indispensabile indagare sulla struttura degli atomi. La scoperta che gli atomi sono formati da particelle più piccole fece crollare il primo punto dell'ipotesi di Dalton, quello della loro indivisibilità. gli atomi sono costituiti da particelle denominate particelle subatomiche.
l'atomo non è indivisibile ed è costituito da tre tipi di particelle subatomiche:
- GLI ELETTRONI= (e^-) dotati di carica elettrica negativa scoperti da Thomson nel 1897
- I PROTONI= (p^+) di carica elettrica positiva individuati dal fisico Rutherford nel 1919
- I NEUTRONI= (n) non presentano carica elettrica, individuati dal fisico Chadwick nel 1932
elettroni, protoni e i neutroni sono le particelle subatomiche più importanti per il lavoro dei chimici: queste particelle costituiscono gli atomi di tutti gli elementi ad eccezione degli atomi di idrogeno, che non hanno un neutroni.
queste particelle sono ancora più piccole degli atomi, la massa viene spesso indicata in unità di massa atomica (u) cioè l'unità di misura degli atomi ( può essere espressa in kilogrammi). I protoni neutroni hanno all'incirca la stessa massa mentre la massa di un elettrone è 1836 volte più piccola della massa di un protone. Protoni ed elettroni hanno una carica elettrica con lo stesso valore ma di segno contrario +1 per i protoni e -1 gli elettroni.
in genere i corpi sono elettricamente neutri: la materia contiene un numero di elettroni uguale a quello dei protoni quindi gli effetti delle cariche opposte si annullano reciprocamente.
L'elettrizza azione è dovuta al trasferimento di elettroni da un materiale all'altro. Per esempio strofinando una bacchetta di plastica con un panno sia un trasferimento di elettroni dal 2panno alla bacchetta, che assume una carica elettrica temporanea negativa. poiché la carica elettrica dipende dal trasferimento di un numero intero di elettroni essa può assumere solo valori multipli della carica dell'elettrone detta anche carica elementare. I corpi elettrizzati poi tendono a scaricarsi attraverso manifestazioni come il fulmine o le scosse che si avvertono; in ogni caso la scarica ripristina la situazione situazione di normale elettroneutralità
Dopo circa mezzo secolo dalla formulazione della teoria atomica di Dalton gli scienziati, sulla base di numerose esperienze sperimentali, supposero che l'atomo fosse costituito da particelle più piccole, portatrici di cariche elettriche. Per definire la natura delle cariche elettriche presenti nell'atomo e individuare la struttura interna ci sono voluti circa settanta anni di ricerche. Tali esperimenti si concentrarono principalmente sullo studio di gas rarefatti attraversati da corrente.
L'elettrone fu la particella subatomica individuata per prima, scoperta grazie esperimenti effettuati con particolari tubi di scarica in vetro, i tubi di Crookes.
- Il tubo di vetro sotto vuoto (con una pressione interna pari a 1· 10-3 atm) conteneva due placche metalliche.
- Una placca era collegata al polo negativo di un potente generatore elettrico e l'altra al polo positivo.
- La placca negativa tu chiamata catodo (-) e la placca positiva anodo (+)
- La radiazione proveniente dal catodo fu chiamata raggi catodici sono formati da particelle cariche negativamente chiamate elettroni
Con questi tubi si studiava l'emissione di radiazioni, i cosiddetti raggi catodici a seguito delle scariche elettriche prodotte da un generatore di corrente continua sui gas gas elefanti in essi contenuti.
1860 -1888 Wiliam Crookes condusse numerosi esperimenti utilizzando un tubo di vetro contenete gas rarefatto attraversato da corrente elettrica.
alla pompa a vuoto catodo - anodo + 50000 Pa generatore di corrente continua A Quando un gas rarefatto è attraversato dalla corrente elettrica, si forma inizialmente una scintilla che procede a zig-zag.
alla pompa a vuoto catodo - anodo + 700 Pa generatore di corrente continua B - Si crea poi una luminosità diffusa, che riempie il tubo come un'insegna al neon.
Riducendo ulteriormente la pressione ( con una bombola a vuoto, fino ad arrivare ad una pressione minore di 0,1 Pascal) del gas vide comparire sull'anodo una luce fluorescente. Egli ipotizzò che questa luce derivasse dall'interazione tra l'anodo e i raggi emessi dal catodo (raggi catodici).
Per scoprire cosa fosse la fluorescenza hanno condotto ulteriori esperimenti.
Osservazioni di Crookes sui Raggi Catodici
Crookes osservò che i raggi catodici:
- Proiettano l'ombra di un piccolo oggetto interposto sul loro cammino: i raggi si propagano in linea retta
- se venivano poste due piastre di segno opposto lungo il cammino, i raggi subivano una deflessione verso la piastra positiva: i raggi sono carichi negativamente
- Posizionando un piccolo mulinello all'interno del tubo, i raggi, urtandolo, lo mettevano in rotazione: non si trattava di raggi ma di particelle (cariche negativamente). ( natura corpuscolare)
dopo la scoperta degli elettroni si era già ipotizzata l'esistenza dei protoni in quanto siccome gli elettroni hanno carica negativa doveva esserci qualcosa con la carica positiva siccome l'atomo è neutro.
Thomson nel 1897 scoprì che i raggi catodici avevano sempre lo stesso rapporto carica/massa, indipendentemente dalla natura del gas e degli elettrodi, perciò tutti gli atomi contenevano le stesse particelle negative, tali particelle vennero successivamente definite da Thomson elettroni.
R.E. Millikan, nel 1909, determinò la carica dell'elettrone: 1,60 · 10-19 C (Coulomb).
1919, ripetendo l'esperimento di Crookes utilizzando un catodo forato, rilevò la presenza di particelle con carica positiva: i protoni.
Scoperta del Protone e Raggi Catodici
SCOPERTA PROTONE E RAGGI CATODICI (video) Gli elettroni dei raggi catodici urtano gli atomi di gas che, perdendo elettroni, si trasformano in ioni positivi.
Gli ioni positivi si muovono verso il catodo, creando un flusso di raggi che colpisce lo schermo e lo fa diventare fluorescente.
atomo di gas catodo con fori anodo + -0 elettrone catodo - ione schermo positivo di solfuro di zinco
E. Goldstein ha creato uno speciale tubo conosciuto come "tubo dei raggi anodici". Questo tubo solitamente ha due sezioni, tra queste due vi è il catodo (disco metallico perforato posto all'interno del tubo in sovraccarico). Lo spazio tra anodo (+) e catodo (-) contiene un piccolo numero di molecole residue del gas rarefatto (idrogeno ). L'anidride ed il catodo sono collegati ad un generatore ad alto voltaggio. Gli elettroni emessi dal catodo( raggi catodici ) si scontrano con le molecole residue del gas; queste collisioni rilasciano un elettrone da ogni atomo gassoso, generando ioni carichi positivamente (ionizzano il gas) , questi ioni, attratti dal catodo ( negativo ), ne attraversano i fori. In questo modo alle spalle del catodo, si crea un fascio di luce di particelle positive. attraversano catodo e vanno contro un rilevatore. Le particelle positive prodotte dall' anodo creano i raggi "anodici", e vennero chiamate protoni
La scoperta del neutrone avvenne diversi anni dopo, nel 1932, grazie agli studi sulla radioattività di J. Chadwick.
Ricorda: nonostante gli atomi contengano particelle cariche elettricamente, se non elettrizzati (es. per strofinio), sono NEUTRI 4