Preparazione estrattiva e analisi spettrofotometrica UV in Chimica
Documento sull'alimentazione, preparazione estrattiva e analisi spettrofotometrica UV. Il Pdf, adatto a studenti universitari di Chimica, esplora i principi alimentari, la classificazione degli alimenti e il processo di preparazione estrattiva, inclusi campionamento e conservazione, con un focus sull'analisi UV dell'olio d'oliva.
Ver más57 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
PREPARAZIONE ESTRATTIVA
L'alimentazione consiste nell'assunzione da parte dell'organismo di alimenti indispensabili al suo metabolismo e alle sue funzioni vitali quotidiane prendendo in considerazione tutte le trasformazioni fisiche, chimiche e fisico-chimiche che i nutrienti assunti subiscono nel processo di digestione e/o assimilazione.
L'alimentazione viene sempre più considerata come uno strumento fondamentale per il benessere fisico e psichico.
A disposizione del consumatore esiste un'ampia scelta di alimenti e vengono fatti numerosi studi per determinare la composizione, valore nutrizionale e sensoriale degli alimenti.
Gli alimenti sono divisi in:
- Funzionali
Sono sostanze nutritive che hanno un reale effetto benefico sulla salute e sono divisi in:
- Convenzionali: cibi che contengono nutrienti (sono ad esempio noci, mandorle, nocciole e frutta secca in generale)
- Modificati o arricchiti: cibi a cui vengono addizionate sostanze biologicamente attive (sono ad esempio il latte al quale è aggiunto il calcio o i cereali con più vitamine e minerali).
Fanno parte di questi anche gli alimenti impoveriti di sostanze biologicamente attive (come, ad esempio, il latte senza lattosio)
- Integratori
Sono prodotti destinati ad integrare la comune dieta e costituiscono una fonte concentrata di sostanze nutritive. Queste sostanze possono essere utili per compensare delle carenze nutrizionali o coadiuvare alcuni processi fisiologici.
Contengono: vitamine, minerali, aa, acidi grassi, fibre vegetali, erbe ed estratti con effetto nutritivo e/o fisiologico.
Si possono trovare sotto forma di capsule, compresse, bustine e/o flaconcini
- Nutraceutici
Sono principi nutritivi contenuti negli alimenti che hanno effetti benefici sulla salute e si trovano in natura.
Possono essere estratti e usati come integratori alimentari o addizionati ad altri alimenti.
Le sostanze nutraceutiche derivano da piante, alimenti e fonti microbiche e tra essi ci sono i probiotici, gli antiossidanti, gli omega-3, gli omega-6 e le vitamine.
I principali estratti sono ottenuti da fonti vegetali ed animali e sono usati come coloranti naturali, nutraceutici, alimenti funzionali, conservanti, aromi e fragranze, oli e grassi commestibili, farmaci, integratori vitaminici, standard chimici e profumi.
In passato questi estratti venivano usati come dei farmaci e attualmente vengono spesso utilizzati per prevenire le malattie croniche, per migliorare lo stato di salute e per ritardare il processo di invecchiamento.
CARATTERIZZAZIONE DI UN ESTRATTO
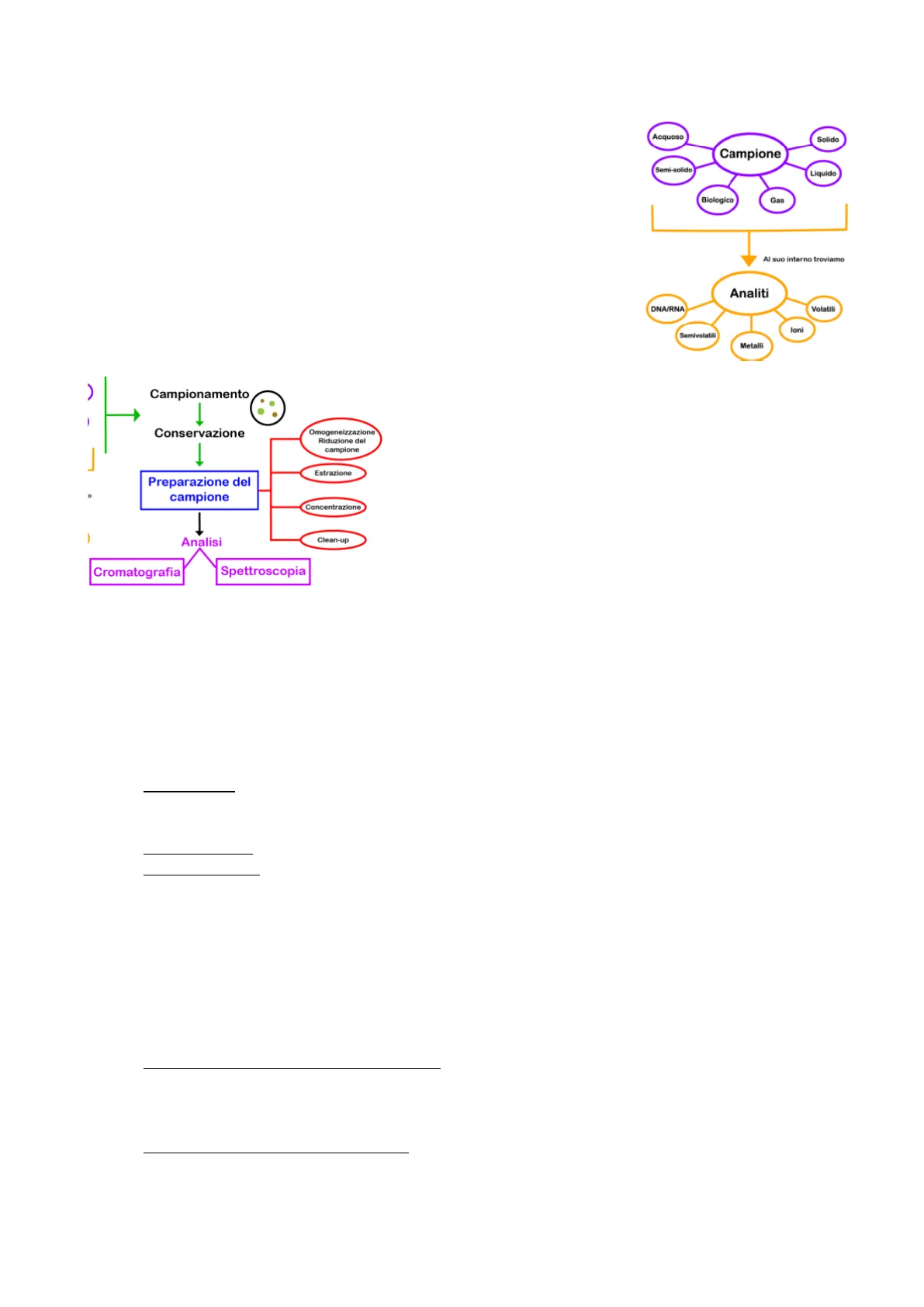
Per effettuare un'analisi quali-quantitativa dell'estratto è necessario eseguire un processo analitico sull'estratto e sul prodotto iniziale. L'estratto viene chiamato CAMPIONE che si può presentare sotto forme fisiche (solido, liquido o gas). All'interno del campione ci sono i composti che vogliamo caratterizzare detti ANALITI anch'essi presenti in diverse forme e sui quali è necessario effettuare un'analisi quali-quantitativa per questi ultimi.
Tipi di Campione e Analiti
Acquoso Solido Campione Semi-solido Liquido Biologico Gas
Al suo interno troviamo Analiti DNA/RNA Volatili loni Semivolatili Metalli
Fasi del Processo Analitico
Campionamento 1 Conservazione Omogeneizzazione Riduzione del campione 1 Estrazione Preparazione del campione Concentrazione Analisi Clean-up Cromatografia Spettroscopia
Processo analitico prevede diverse fasi:
- CAMPIONAMENTO
Rappresenta il primo stadio e bisogna prestare attenzione a non commettere errori perché questi si ripercuoterebbero su tutto il processo analitico. Il campione deve essere rappresentativo dell'oggetto investigato cioè il campione deve avere la stessa composizione dell'oggetto che voglio analizzare (cioè se un oggetto è formato da due sostanze presenti in % diversa anche nel campione dovranno essere presenti queste due sostanze nella stessa % dell'oggetto) e omogeneo (di solito liquidi e gas sono omogenei mentre se il campione è solito deve essere omogeneizzato).
- CONSERVAZIONE o STOCCAGGIO
Durante questa fase possono avvenire diversi fenomeni di tipo fisico, chimico o di biodegradazione che portano ad una alterazione del campione. Lo stoccaggio si esegue in contenitori di vetro, plastica o metallo che viene scelto in base a quello considerato più idoneo al campione. Ci sono alcune pratiche da evitare durante i vari processi:
- Processi fisici: volatilizzazione, diffusione e assorbimento sulle pareti interne del contenitore, perdita o accumulo di acqua. La quantità di acqua deve essere controllata perché l'eccesso può far aumentare la proliferazione di alcuni enzimi.
- Processi chimici: reazioni fotochimiche, ossidoriduzioni, precipitazione
- Biodegradazione: chimica, biologica e enzimatica
Lo stoccaggio è molto importante perché è quello che determina il tempo che trascorre dal campionamento all'analisi vera e propria. I campioni facilmente biodegradabili possono essere conservati in congelatore (-18 ℃) o in frigorifero, riducendo il più possibile il tempo di stoccaggio.
- PREPARAZIONE DEL CAMPIONE
Prevede diverse fasi:
- Omogeneizzazione riduzione del campione: i solidi vanno macinati mentre i liquidi di solito sono omogenei ma, ad esempio, nell'olio che si trova nei silos o nel vino conservato in grandi quantità si può formare gradiente di concentrazione, quindi, è necessaria l'omogenizzazione cioè un rimescolamento di queste masse di liquidi
- Estrazione, concentrazione e Clean-up: estrazione di composti bioattivi con concentrazione di essi seguita da una purificazione clean-up. L'estrazione viene effettuata usando una fase estraente liquida che viene messa a contatto con campione e analita.
2Quanto però si effettua l'estrazione con una fase liquida con un grande volume di solvente i composti attivi se sono presenti in piccole tracce vengono troppo diluiti dalla fase liquida, quindi, è necessario effettuare una concentrazione (grazie a questa si elimina gran parte del solvente usato per l'estrazione, ad esempio, tramite l'evaporatore rotante in laboratorio). Dopo l'estrazione e la concertazione il campione subisce una purificazione clean-up che serve per rimuovere eventuali sostanze interferenti Il clean-up serve per trasferire gli analiti in solventi alternativi, aumentare la concentrazione di un analita prima dell'analisi e rimuovere le sostanze interferenti e ad aumentare la concentrazione di un analita prima dell'analisi e a trasferire gli analiti in solventi alternativi.
Queste ultime 3 fasi son o quelle più importanti e che richiedono più tempo ma sono necessarie per ottenere se si utilizzano tecniche come la spettroscopia e la cromatografia.
Ci sono molti aspetti che influenzano la scelta della tecnica di estrazione adeguata infatti la scelta dipende principalmente da:
- Composto che vogliamo isolare
- Tecnica strumentale che vogliamo usare per la determinazione analitica finale
METODI DI ESTRAZIONE
Durante il corso verranno trattati metodi classici di estrazione solido-liquido ed estrazione liquido-liquido insieme a metodi che sono stati sviluppati di recente come l'estrazione a microonde, estrazione supercritica e estrazione accelerata.
Le tecniche di estrazione sono classificate in base allo stato fisico della matrice: sono diverse se l'oggetto è solido o liquido.
Tecniche di estrazione matrici solide
Queste tecniche vengono dette "tecniche tradizionali". La matrice solida si può trovare come:
- Matrice fresca (es. olive, agrume ... )
- Mantice essiccata (es. noci, nocciole ... )
SPREMITURA
Si usa quando si ha una matrice fresca. È una tecnica antica che permette di effettuare una separazione meccanica tra solido e liquido ed è basata sull'applicazione di pressione mediante apparecchi Permette di effettuare estrazione tramite l'utilizzo di pressioni, generalmente elevate, mediante apparecchi che nel tempo sono diventati più sofisticati che nel tempo sono diventati più sofisticati (grosse pietre, pestello e mortaio, molazze, presse, torchio ecc. ).
La spremitura trova il suo maggiore impiego nell'industria alimentare, in particolare nell'estrazione: di succhi freschi (ricchi in vitamine), oli essenziali (da bucce di agrumi) e oli vegetali da semi e frutti oleaginosi.
Il vantaggio della spremitura è quello di non utilizzare alcun gradiente termico, cosa che potrebbe indurre, ad esempio, la perossidazione degli oli estratti.
ESTRAZIONE CON SOLVENTE
Viene usata quando si ha una matrice essiccata. La matrice essiccata viene estratta grazie al contatto con un solvente.
L'estrazione per contato con solvente non è applicata solo quando si hanno matrici solide ma anche quando è sconsigliata la solubilizzazione totale del campione perché perché permette di portare in soluzione solo gli analiti di interesse lasciando la matrice quasi intatta.
- Estrazione solido-liquido: isolamento da una miscela solida dei composti più solubili per trattamento unico o ripetuto con opportuno solvente
3- Estrazione liquido-liquido: la separazione di attua per distribuzione dei componenti della miscela fra due fasi liquide immiscibili
ESTRAZIONE N.1
Useremo la spremitura (usata con matrici fresche) perché ricercheremo dell'acido ascorbico in una serie di succhi di frutta. Infatti, bisogna portare arance, limoni, kiwi o peperoni che contengono molto acido ascorbico.
Alla base di questa esercitazione c'è una reazione di ossidoriduzione tra la vitamina C e lo iodio (la vit. C si ossida in presenza dello iodio).
Lo scopo è ad esempio quello di confrontare la quantità di vitamina C tra la spremuta fresca e quella spremuta da più tempo.
La vitamina C è presente, oltre che nella frutta e nella verdura, anche nella carne degli animali che sintetizzano la propria vitamina C. gli alimenti che vengono conservati per molto tempo subiscono una notevole perdita di vitamina C. Si ha una perdita di vitamina C anche negli alimenti che subiscono abbondante lavaggio con acqua e successiva cottura. Invece se s sbollentano e poi congelano gli alimenti si riducono le perdite infatti spesso i surgelati hanno più vitamina C della frutta e della verdura conservata in frigorifero per giorni.
La vitamina C è sensibile a calore e ossigeno ed è molto idrosolubile È importante determinare la quantità di vitamina C perché è un indicatore di qualità dell'alimento con il quale si sta lavorando.
L'acido ascorbico tende a ossidarsi producendo:
- Acido semideidroascorbico
- Acido deidroascorbico
Dato che è molto antiossidante viene usata nell'industria come conservante (ad esempio viene usata negli alimenti in scatola per la conservazione). Questa vitamina C usata come conservante viene creata in laboratorio, quindi, è di origine sintetica.
Quando è usata come conservante viene inserito in etichetta la sigla E seguita da un numero che corrisponde alla forma dell'additivo vitamina C nell'alimento (E300 indica che è presente acido ascorbico mentre E301 indica che è presente sodio ascorbato, E302 corrisponde al calcio ascorbato, E303 al potassio ascorbato ecc .. ).
Alimenti che contengono più vitamina C: arancia, limone, pompelmo, kiwi.
Procedimento
la determinazione quantitativa si esegue tramite titolazione. Faremo 2 saggi:
- Qualitativo: serve a determinare se c'è vit C nell'estratto
- Quantitativo: serve a determinare quanta vit C c'è
La presenza di vitamina C viene determinato tramite la variazione di colore. Useremo: salda d'amido, una soluzione di iodio, provette da saggio, succo di frutta o di arancio o altro.
Prepareremo una soluzione di salda d'amido ed essa reagisce con lo iodio e si crea colore blu. Questa reazione che avviene tra iodio e salda d'amido è unica quindi la salda d'amido è indicata come indicatore specifico. Il meccanismo secondo il quale si forma questo complesso blu/violaceo non è noto.
Se a questo complesso blu si aggiunge acido ascorbico lo iodo reagisce con quest'ultimo e lo iodo viene ridotto da I2 e I-. Quando viene trasformato in I- viene a mancare il colore blu.
La determinazione quantitativa invece si determina sempre tramite reazione tra acido ascorbico e iodio. Lo iodio si lega ai carboni coinvolti nel doppio legame e per un momento si ha sia OH che iodio legati al doppio legame poi lo iodio e l'H se ne vanno e si ha un riarrangiamento dei legami. Per fare questo mescoliamo 4