Reacciones metabólicas y la importancia de las enzimas
Documento de Ana Gloria Fernández Belloso sobre las reacciones metabólicas y la importancia de las enzimas. El Pdf, un material de estudio universitario de Biología, explora las características de las reacciones metabólicas y los mecanismos de inhibición enzimática, incluyendo diagramas explicativos.
Ver más14 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Características de las reacciones metabólicas
BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA TEMA 13. LAS REACCIONES METABÓLICAS. LA IMPORTANCIA DE LAS ENZIMAS.
- - Características de las reacciones metabólicas.
- - Enzimas y reacciones enzimáticas. 2.1. Mecanismo de las reacciones enzimáticas.
- - Cinética enzimática.
- - Factores que influyen en la velocidad de las reacciones enzimaticas.
- - Mecanismos para aumentar la eficacia enzimática.
- - Regulación de la actividad enzimática. 6.1. Activación enzimática. 6.2. Inhibición enzimática. 6.3. Alosterismo.
- Clasificación de las enzimas
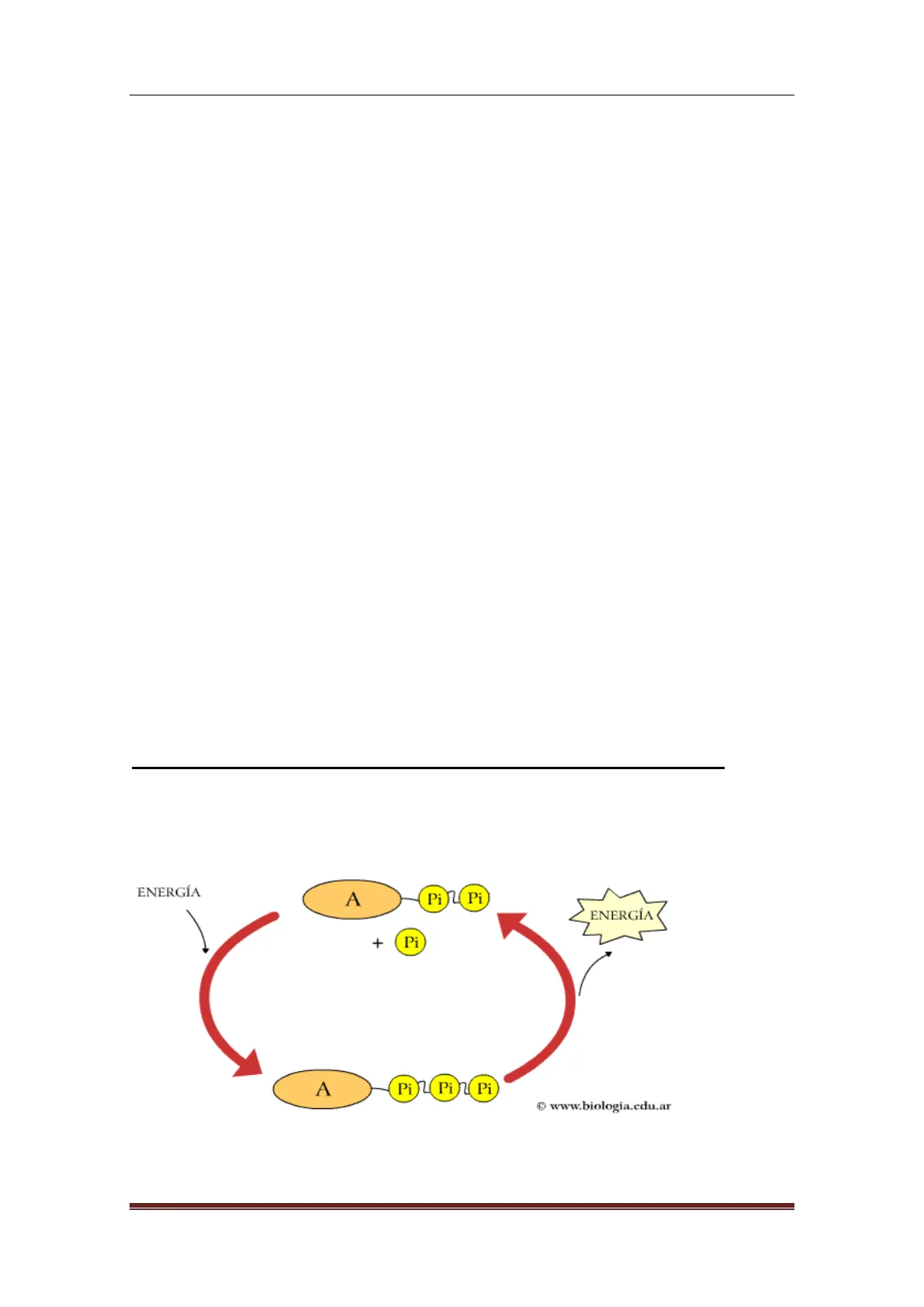
1 .- CARACTERÍSTICAS DE LAS REACCIONES METABÓLICAS. Las reacciones metabólicas son reacciones químicas que tienen lugar entre moléculas dentro de los organismos vivos. Todos los procesos vitales se llevan a cabo a través de reacciones metabólicas.
ENERGÍA A Pi Pi ENERGÍA + Pi A Pi Pil Pi @ www.biologia.edu.ar Fig. 13.1. Ejemplo de reacción metabólica. 2012/2013 Página 1BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA Aunque hay un gran número de reacciones diferentes, pueden destacarse unas características generales:
- Son secuenciales. Es decir, el producto final de una reacción es el origen de la siguiente. Por este motivo también se denominan vías metabólicas o rutas metabólicas. A las sustancias intermedias que intervienen en la reacción se les denomina Metabolito, mientras que a la inicial, Sustrato y a la final Producto.
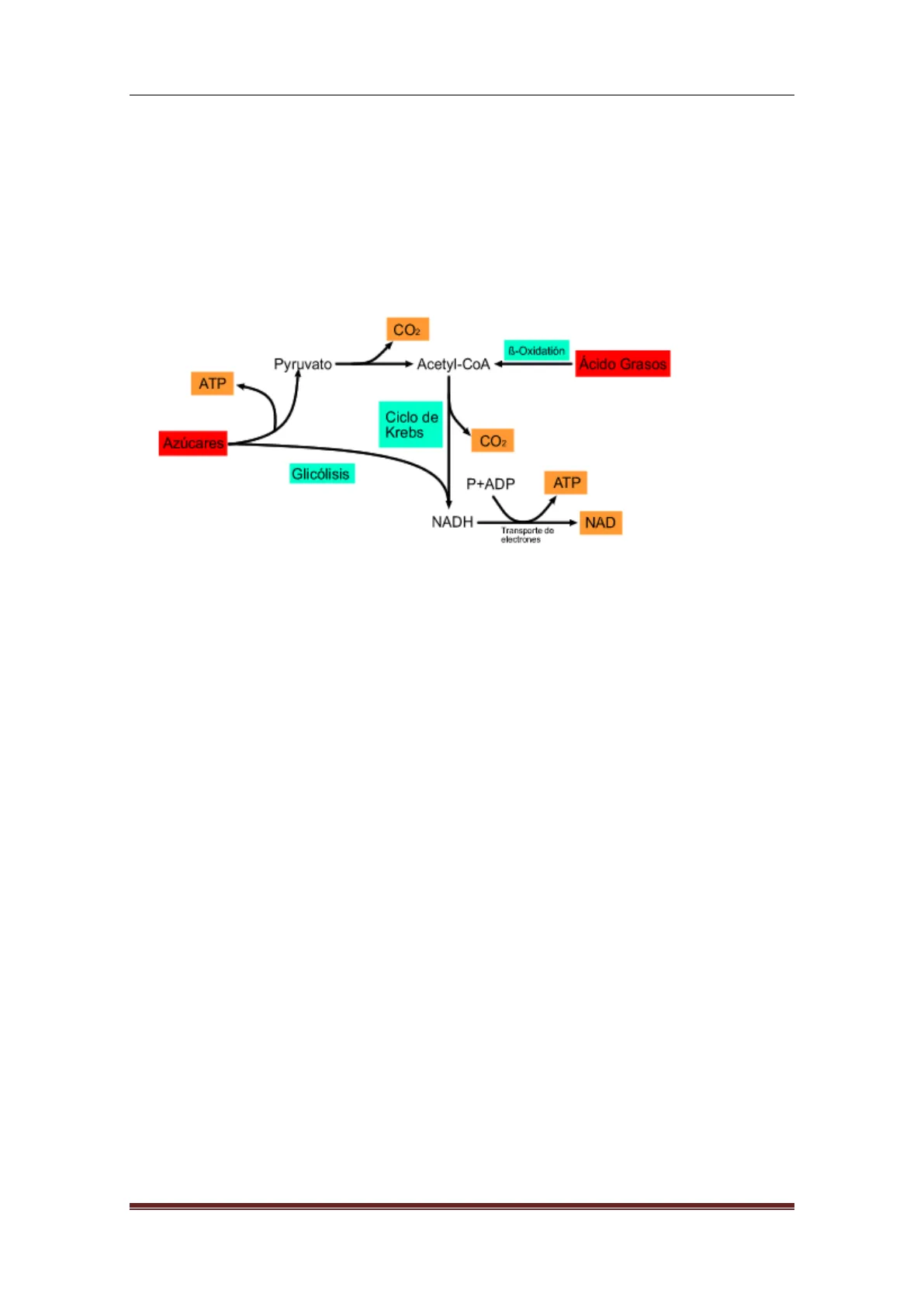
- Pueden ramificarse.
CO2 3-Oxidatión Pyruvato Acetyl-CoA Ácido Grasos ATP Ciclo de Krebs Azúcares CO2 Glicólisis P+ADP ATP V NADH NAD Transporte do electrones Fig. 13.2. Ejemplo de ruta metabólica secuencial y ramificada
- Pueden ser convergentes o divergentes.
- Son comunes a la mayoría de los seres vivos. (Lo que demuestra un origen común).
- Nos encontramos con dos tipos de rutas:
- ANABÓLICAS. Son reacciones donde las moléculas sencillas se unen para formar moléculas complejas. Por tanto son constructivas y requieren para ello energía (que se proporciona en forma de ATP). Además son reacciones de reducción (el poder reductor lo proporcionan las coenzimas)
- CATABÓLICAS. Son reacciones donde se degradan moléculas complejas y se obtienen las moléculas sencillas de las que se componen. Por tanto son reacciones de destrucción, de rotura de enlaces de desprenden energía química, que se almacena en forma de ATP. También son reacciones oxidativas, donde se liberan electrones y protones que se guardan en las coenzimas.
- Todas las reacciones metabólicas son catalizadas por Enzimas. Cada reacción es mediada por una enzima diferente.
2012/2013 Página 2BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA Sustancias complejas Catabolismo: Reacciones degradativas ATP ADP + P ENERGÍA NAD+ NADPH Anabolismo: Reacciones restitutivas Sustancias simples Fig. 13. 3. Interdependencia anabolismo-catabolismo.
Enzimas y reacciones enzimáticas
2 .- ENZIMAS Y REACCIONES ENZIMÁTICAS Las enzimas son biocatalizadores, es decir, catalizadores biológicos que aumentan la velocidad de las reacciones metabólicas. Químicamente son proteínas. De acuerdo a su complejidad las enzimas se clasifican como: SIMPLES: Fomadas por una o más cadenas polipetídicas. ENZIMAS CONJUGADAS: Contienen por lo menos un grupo no proteico enlazado a la cadena polipeltídica. En las proteínas conjugadas podemos distinguir dos partes: - Apoenzima: Es la parte proteica de la enzima. - Cofactor: Es la parte no proteica de la enzima o tambien denominado Grupo Prostético La combinación de la apoenzima y el cofactor forman la holoenzima. Los cofactores pueden ser: · lones metálicos: Ejemplos: Fe2+, Mg2+, Cu2+, K+, Na+ y Zn2+ · La mayoría de los otros cofactores son coenzimas las cuales generalmente son compuestos orgánicos de bajo peso molecular, por ejemplo, las vitaminas del complejo "B" son coenzimas que se requieren para una respiración celular adecuada. 2012/2013 Página 3BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA Las características de las enzimas son las siguientes:
- Aceleran la reacción.
- Se desnaturalizan (al ser proteínas).
- Tienen una alta especificidad, ya que sólo reaccionan sobre un sustrato (moléculas a las que se unen). Para cada sustrato hay una enzima diferente.
- No se consumen en la reacción por lo que pueden actuar repetidamente.
- Su temperatura óptima de actuación es a la del ser vivo donde se encuentren.
Mecanismo de las reacciones enzimáticas
2.1. Mecanismo de las reacciones enzimáticas Una reacción química se produce por la rotura de unos enlaces (del reactivo) y la creación de otros nuevos (del producto). El estado en el que se han roto los enlaces pero todavía no se han formado los nuevos se denomina "estado de transición". Para alcanzar el estado de transición (y para que así se produzca la reacción) se necesita una cantidad de energía denominada Energía de activación. En ciertas reacciones (espontáneas) esta energía es muy baja. En otras reacciones es muy alta y se necesita aplicar calor para alcanzarla.
Complejo activado Estado de transición Energía potencial Energía de activación - Reactivos AH < 0 Productos Transcurso de la reacción Fig. 13.4. Los catalizadores se encargan de rebajar la energía de activación necesaria para alcanzar antes el estado de transición, pero sin consumirse en la reacción. 2012/2013 Página 4BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA Estado de transición Energía libre de activación (no catalizado) Energía libre Energía libre de activación (catalizado) - Estado inicial (reactivos) estado final (productos) progreso de reacción Fig. 13.5 Una reacción catalizada por enzimas se desarrolla en tres etapas:
- Unión del sustrato a la enzima para formar el "complejo enzima-sustrato" ([ES]). Esta unión es muy específica. Se debe a la estructura de la enzima (proteína) que tiene una zona física denominada "centro activo" donde se acopla físicamente el sustrato ("Modelo llave-cerradura). Esta unión es reversible, por lo que es lenta.
Substrate + Active site a b ES complex a C b Enzyme Fig. 13.6. Complejo ES
- Se lleva a cabo la reacción y se obtiene el producto. Esta etapa es muy rápida e irreversible.
- El producto se libera del centro activo y la enzima queda libre para nuevas reacciones (no se ha consumido).
2012/2013 Página 5 CBIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA E + S ES E+ P Fig 13.7.
Cinética enzimática
3 .- CINÉTICA ENZIMÁTICA Si representamos la velocidad de una reacción enzimática respecto de la concentración del sustrato resulta la siguiente gráfica:
Vmax C B V 1/2 V max A [ S ] Fig. 13.8. La velocidad va aumentado conforme aumentamos la concentración de sustrato, hasta un punto donde no varía aunque siga aumentando [S]. Esto es debido a que todas las enzimas están "ocupadas", es decir, están formando el complejo enzima- sustrato [ES]. Esta etapa es limitante (limita la velocidad) y por tanto tiene una constante de equilibrio que puede calcularse del siguiente modo:
E + S K1 K2 2 ES K. KA 4 E + P 2012/2013 Página 6BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA K M = [E] [S] [ES] Como [E]=[ES], entonces Km = [S], siendo KM la constante de Michaeles-Menten. Se define KM, como la concentración de sustrato a la cual la reacción alcanza la velocidad semimáxima (1/2 vmax):
V V máx 4 Vmáx[S] 1/2 V máx V= 2 Km+[S] 0 0 Km 2 4 [S] Fig. 13.9 Pudiendo calcularse la velocidad de la reacción en cualquier momento según la siguiente ecuación:
VO= Vmax's Km+ S en donde: vo es la velocidad inicial de la reacción Vmax es la velocidad máxima Km es la constante de Michaelis y Menten= [S] es la concentración de sustrato La KM es característica de cada enzima y cuanto menor sea, menor será la concentración de sustrato a la cual se alcance la velocidad máxima, ya que la velocidad es mayor con menos sustrato. Es decir, la afinidad de la enzima por el sustrato es menor. Si tomamos los valores inversos:
2012/2013 Página 7ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA BIOLOGÍA 2º BACHILLERATO 1 V V max Km(1) x[S] + 1 Vm max Obtenemos la representación siguiente, conocida como gráfica de Lineweaver-Burk, en la que resulta una recta:
slope of line KM/ Vmax 1/Vo O y intercept 1 / V. 1 + -1/ KM 1 / [S] Fig 13.10.
Factores que influyen en la cinética enzimática
4. FACTORES QUE INFLUYEN EN LA CINÉTICA ENZIMÁTICA Son factores que pueden modificar la velocidad de la reacción:
- Concentración del sustrato: A más sustrato mayor velocidad, hasta alcanzar la velocidad máxima
- El pH. Cada enzima tiene un pH al cuál la velocidad es máxima. Este pH se denomina pH óptimo. Por encima o debajo de este pH, la enzima va más lenta debido a que se desnaturaliza.
2012/2013 Página 8BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA Variación de la actividad enzimática con el pH. Actividad enzimática pH óptimo 1 2 3 4 5 6 7 8 9 10 11 12 13 14 pH Fig. 13.11
- La Temperatura. Al igual que el pH, hay una temperatura óptima a la cual la velocidad es máxima. Por debajo, la enzima va más despacio aunque sigue funcionando, pero por encima, la enzima se desnaturaliza y la velocidad se hace cero.
Variación de la actividad enzimática con la temperatura Actividad enzimática Temperatura óptima 0 10 20 30 40 50 Temperatura C Fig. 13.12.
Mecanismos para aumentar la eficiencia enzimática
5. MECANISMOS PARA AUMENTAR LA EFICIENCIA ENZIMÁTICA. Las rutas pueden ser largas, para optimizar la velocidad, las células tienen diferentes mecanismos:
- Compartimentación celular: las enzimas están en las membranas de los orgánulos y actúan mejor que si estuvieran sueltas ( y juntas en el citoplasma)
2012/2013 Página 9BIOLOGÍA 2º BACHILLERATO ANA GLORIA FERNÁNDEZ BELLOSO DPTO BIOLOGÍA Y GEOLOGÍA.IES FERNANDO DE MENA
- Reacciones en cascada: cuando el producto de una reacción actúa de enzima para otra reacción nueva y así sucesivamente, de modo que cada vez hay más moléculas.
- Complejos multienzimáticos: agrupaciones de enzimas que llevan a cabo reacciones consecutivas en una ruta metabólica.
- Existencia de Isozimas. Son enzimas con la misma acción pero distinta velocidad (distinta KM) y se utilizan según se precise una velocidad u otra.
Regulación de la actividad enzimática
6. REGULACIÓN DE LA ACTIVIDAD ENZIMÁTICA No siempre interesa que todas las enzimas estén funcionando a la vez, por lo que es necesaria una regulación de su actividad. Esto se hace por varios mecanismos:
Activación enzimática
6.1. Activación enzimática Se utilizan moléculas conocidas como Activadores, que hacen que enzimas inactivas comiencen a funcionar. Por ejemplo pueden ser cationes como el Mg+2 o Ca+2, moléculas orgánicas o la presencia del propio sustrato.
activadores sustrato sustrato - Enzima inactiva Enzima activa activador activador Los activadores se unen al centro regulador, cambian la configuración del centro activo, que hasta ese momento estaba inactivo y desencadenan la catálisis enzimática. Fig. 13.13
Inhibición enzimática
6.2. Inhibición enzimática Disminuyen o anulan la actividad enzimática. Pueden ser iones, moléculas orgánicas o la presencia del producto final. En este último caso se produce un "Feed-back" o 2012/2013 Página 10