Bioquímica estructural y metabólica de las proteínas: definición y funciones
Documento de Gan sobre Bioquímica Estructural y Metabólica de las Proteínas. El Pdf, útil para estudiantes universitarios de Biología, aborda la definición, estructura, clasificación, síntesis, digestión, absorción y metabolismo de las proteínas, así como su calidad en los alimentos y la disponibilidad de aminoácidos.
Ver más30 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
GASTRONOMÍA + NUTRICIÓN
Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De dónde?
MÓDULO 1: BIOQUÍMICA ESTRUCTURAL Y METABÓLICA DE LAS PROTEINAS
- Las proteínas: Definición
- Estructura y clasificación de las proteínas
- Síntesis proteica
- Digestión, absorción y metabolismo proteico
- Funciones de las proteínas
- Calidad proteica de los alimentos
- Disponibilidad de aminoácidos
La estructura del organismo está constituida por proteínas. Las proteínas son el componente principal de las células y tienen como función básica la regeneración y reparación de tejidos corporales como el músculo, el cabello, las uñas ... , por otro lado, intervienen en la regulación de funciones metabólicas y el mantenimiento de la homeostasis celular, realizando funciones enzimáticas, hormonales, reguladoras, entre otras.
1GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De dónde?
LAS PROTEÍNAS: DEFINICIÓN
Las proteínas son macromoléculas formadas por carbono, oxígeno, nitrógeno, hidrogeno, y en menor cantidad pueden contener: fosforo, azufre y otros elementos como magnesio, cobre y hierro.
Son cadenas de unidades de aminoácidos que se encuentran unidos por medio de enlaces peptídicos entre los grupos carboxilo y el grupo amino.
ESTRUCTURA Y CLASIFICACIÓN DE LAS PROTEINAS
LOS AMINOÁCIDOS
Los aminoácidos, estructura básica de las proteínas, son compuestos orgánicos que contienen un grupo funcional amino (NH2) y un grupo carboxilo (COOH).
El ser humano sintetiza varios tipos de aminoácidos, pero los más importantes son los que forman parte del grupo de los a-aminoácidos.
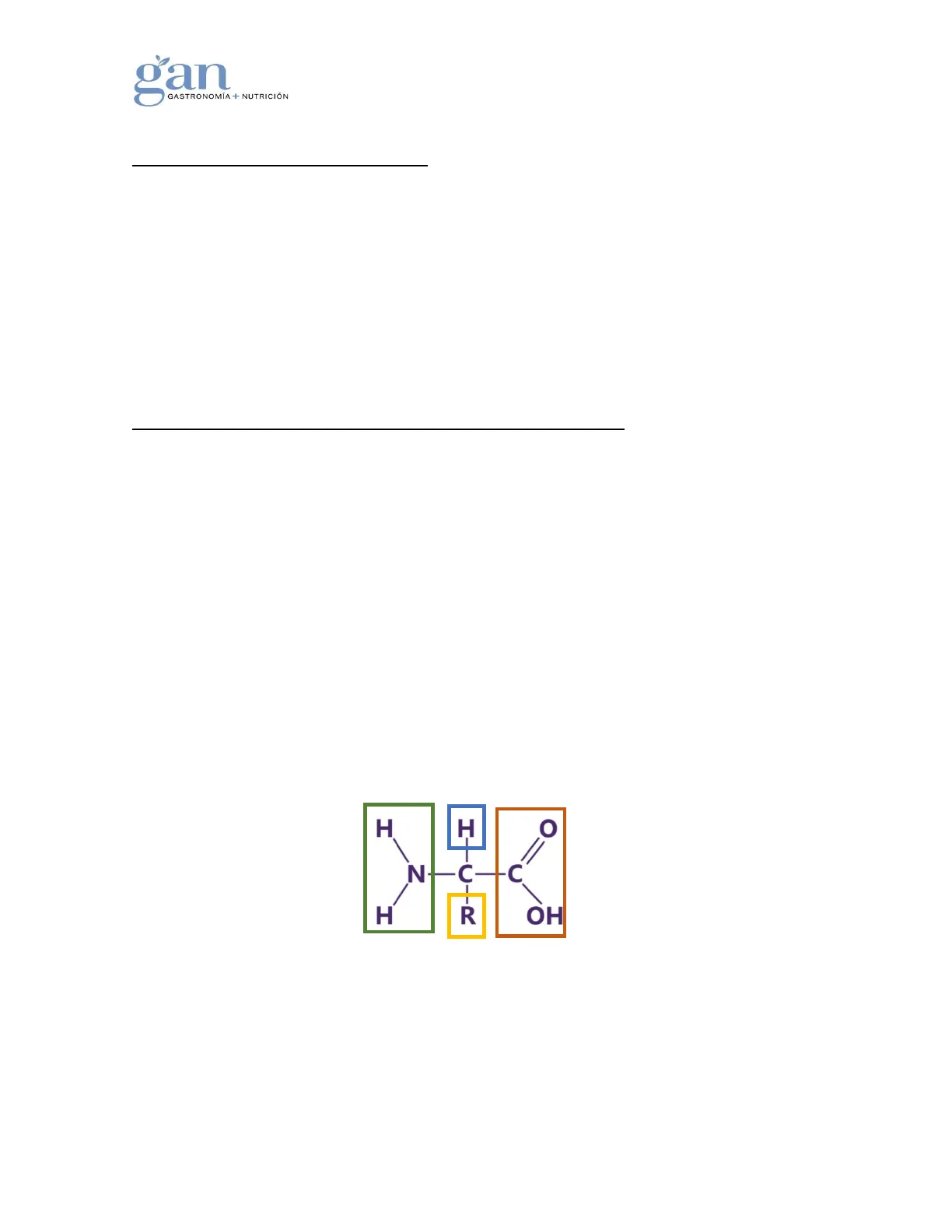
Estos se diferencian por tener, como se observa en la figura 1, un grupo NH2 (verde) y un grupo COOH (naranja) unidos al mismo átomo de carbono, denominado carbono a, un átomo de hidrogeno (azul) y una cadena lateral específica para cada aminoácido (amarillo).
H H O NHC-FC H R OH Imagen 1. Formula general de un aminoácido.
2GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De dónde?
Clasificación de los aminoácidos
Los aminoácidos que componen las proteínas son 20, y se clasifican en dos grupos, según la capacidad del organismo para sintetizarlos:
- Aminoácidos no esenciales: Aminoácidos que pueden ser sintetizados por el organismo; Alanina, arginina, ácido aspártico, asparragina, cisteína, ácido glutámico, glutamina, glicina, prolina, serina, tirosina.
- Aminoácidos esenciales: Aminoácidos que no pueden ser sintetizados por el hombre, a la velocidad o cantidad suficiente para disponer de ellos, por lo que tienen que ser aportados por los alimentos de la dieta y esto condiciona su esencialidad.
Tabla 1. Aminoácidos esenciales (Aa) según situación fisiológica
Adultos (8 Aa) Val, Leu, Ile, Lys, Phe, Trp, Thr, Met Niños 10-12 años (10 Aa) Val, Leu, Ile, Lys, Phe, Trp, Thr, Met, His, Arg Bebés prematuros (11 Aa) Val, Leu, Ile, Lys, Phe, Trp, Thr, Met, His, Arg, Cys Casos especiales. Por ejemplo, los fenilcetonuricos (1 Aa) Tyr
Arginina (Arg), cisteína (Cys), histidina (His), isoleucina (Ile), leucina (Leu), lisina (Lys), metionina (Met), fenilalanina (Phe), treonina (Thr), triptófano (Trp), valina (Val).
Fuente. Nutriguía. Manual de Nutrición Clínica.
Enlaces peptídicos
Los aminoácidos se unen entre sí mediante enlaces peptídicos, que se define como la unión del grupo COOH de un aminoácido y el grupo NH2 del siguiente liberándose, con esta unión, una molécula de agua.
3GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De donde?
H O H R1 C .H 1 I H 0 H Pe ++ HD H H 0 I H3N~ C-N. H 0- H Pe + aa3 H. R1 H R3 I-Z 0=0 C. 0- -N" C H C-N. 0= A H Pc Imagen 2. Formación de un enlace peptídico
La unión de varios aminoácidos por medio de enlaces peptídicos, da como resultado la formación de cadenas de diferentes tamaños denominadas péptidos que se dividen en:
- Oligopeptidos: Si el número de aminoácidos que forman la molécula está en el rango de 2 a 10.
- v Polipéptidos: Si el número de aminoácidos que forman la molécula es superior a 10 aminoácidos.
- Proteínas: Si el número de aminoácidos que forman la molécula es superior a 50 aminoácidos.
ESTRUCTURA DE LAS PROTEÍNAS:
Las proteínas se dividen en cuatro niveles de estructuras: primaria, secundaria, terciaria y cuaternaria.
4GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De donde?
Estructura Primaria
Está constituida por la secuencia de aminoácidos de la cadena polipeptídica. Las proteínas se diferencian por:
- El número de aminoácidos
- El tipo de aminoácidos
- El orden en que se encuentran los aminoácidos dispuestos.
Cualquier alteración en el orden de estos aminoácidos determinará una proteína diferente.
Estructura Secundaria
La estructura secundaria es el plegamiento que forma la cadena polipeptídica debido a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico.
Los puentes de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico. En este caso el -CO- actúa como aceptor de H y el NH como donador de H, de esta manera, la cadena polipeptídica adoptará conformaciones de mayor estabilidad.
El nivel secundario de organización de las proteínas incluye a las siguientes estructuras que son las más frecuentes:
- Hélice a
- Lamina ß
5gam GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De dónde?
Hélice a
La estructura secundaria en la Hélice-a se forma cuando la cadena polipeptídica se enrolla de manera helicoidal, como una estructura en espiral, sobre un eje imaginario. El grupo carboxilo de cada aminoácido se une mediante un puente de hidrógeno al grupo amino de otro aminoácido.
Lámina ß
Esta estructura es conocida también como lamina plegada. La cadena queda estirada y en forma de zigzag formando láminas. Los grupos R sobresalen de la lámina en ambos sentidos y de manera alterna.
Val TN Hélice a 1 Lámina plegada ₿ 1 2-I ... 0=0 1 1 1 0 OHH OHH R O HH 1 1 C-NOSC-NoCC-NOSC-Noc, C-NOSC-N.c,C-NOUSC-NCC 1 1 O=0. 1 H R 0 R H O H R H H R H 1 NNNN-CN-CN-CON-C 1 R I-Z 0= H U=0 Z-I Z-I ... 0=0 Z-I I-0-2 2-I ヒ ー ロ ー エ SO . .. I-Z H 1 Z-I ... 0=0 O H R -I ... 0=0 1 R JEO ... I-Z H I R R-C-H 1 1 R HH ₹-I. .. 0=4 1 1 1 Z-I ... O=0 O O=0 1 Imagen 3. Estructura secundaria (Lámina ß y Hélice a)
Estructura Terciaria
La estructura terciaria ocurre cuando existen atracciones entre Laminas ß y Hélices-a. Esta estructura es específica para cada proteína y determinará la función de dicha proteína.
6 I-Q-₡GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De dónde?
Para dar lugar a la estructura terciaria es necesario que primero se agrupen conjuntos de estructuras denominadas dominios, que luego se articularan para formar la estructura terciaria definitiva.
Se le llama dominio a las regiones de la proteína que tienen una estructura secundaria definida.
La estructura terciaria da lugar a dos tipos de proteínas:
- Proteínas con estructura terciaria de tipo fibroso: las hélices-a o láminas ß que lo conforman, mantienen su orden y no tienen grandes modificaciones, solo ligeros giros longitudinales.
- Proteínas con estructura terciaria de tipo globular su forma es aproximadamente esférica. En este tipo de estructuras se forman regiones con estructuras al azar, hélices-a y láminas ß y acodamientos.
Hablamos de desnaturalización de una proteína en el momento en que se pierde la estructura terciaria de la proteína y por lo tanto esta pierde su función, es decir; supone la ruptura de las interacciones débiles que mantienen la estructura tridimensional. La mayoría de las proteínas se pueden desnaturalizar por calor, pH extremos, entre otros.
Un ejemplo de desnaturalización proteica se observa con el huevo. Al cocinarlo y aplicar calor, la proteína de la clara que inicialmente era transparente y líquida, se coagula y cambia de color ya que se ocasiona una modificación en la estructura proteica.
Los enlaces que se dan en la estructura terciaria pueden ser:
- Covalentes
- Formación de puentes disulfuro.
- Formación de un enlace amida.
7gam GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De donde?
- No covalentes
- Fuerzas electrostaticas.
- Puentes de hidrógeno.
- Interacciones hidrofóbicas.
- Fuerzas de polaridad.
Estructura Cuaternaria
La estructura cuaternaria implica la interacción de más de una cadena polipeptídica. Es, por lo tanto, la asociación de diferentes subunidades para formar complejos funcionales, en forma de dímeros, (unión de dos monómeros) trímeros (unión de tres monómeros), etc.
Niveles de organización de las proteínas
Estructura primaria de las proteínas Es la sequencia de una cadena de aminoácidos Aminoácidos Hoja plegada Hélice alfa Estructura secundaria de las proteínas ocurre cuando los aminoácidos en la secuencia interactúan a través de enlaces de hidrógeno Hoja plegada Estructura terciaria de las proteínas ocurre cuando ciertas atracciones están presentes entre hélices alfa y hojas plegadas Hélice alfa Estructura cuaternaria de las proteínas es una proteína que consiste de más de una cadena de aminoácidos Imagen 4. Estructuras de las proteínas
8g'am GASTRONOMÍA + NUTRICIÓN Los cuatro ejes del consumo de proteínas ¿Por qué? ¿ Cuánto? ¿ Quién? ¿ De donde?
CLASIFICACIÓN DE LAS PROTEÍNAS
Las proteínas se clasifican dependiendo de su estructura, sensibilidad, composición química, solubilidad entre otros.
De acuerdo a su composición las proteínas se clasifican en:
- Holoproteínas o proteínas simples.
Son proteínas formadas únicamente por aminoácidos. Se dividen en globulares o fibrosas. Algunos ejemplos son:
- Globulares
- Prolaminas
- Gluteninas
- Albúminas
- Hormonastirotropina
- Enzimas
- Fibrosas
- Colágenos
- Queratinas
- Elastinas
- Fibroínas
- Heteroproteínas o proteínas conjugadas
Las heteroproteínas están formadas por una fracción proteica y por un grupo no proteico, que se denomina grupo prostético.
Dependiendo del grupo prostético existen varios tipos de heteroproteínas:
- Glucoproteínas Son moléculas formadas por una fracción glucídica y una fracción proteica unidas por enlaces covalentes. Son glucoproteínas algunas hormonas y determinadas enzimas por ejemplo.
9