Bioquímica: Metabolismo, Bioenergética y Ciclos Metabólicos Clave
Documento de Bioquímica sobre metabolismo, bioenergética y ciclos metabólicos clave. El Pdf, de nivel universitario y materia Biología, aborda el metabolismo, la bioenergética, el ciclo de Krebs y la gluconeogénesis, con diagramas y gráficos explicativos.
Ver más42 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Introducción al metabolismo
Introducción
Metabolismo: Suma de todos los procesos químicos que ocurren en el organismo al mismo tiempo, dentro de la célula.
Sus objetivos son:
- Obtener energía a partir de nutrientes o de la luz del sol
- Realizar reacciones biosintéticas
- Degradar macromoléculas
ATP: fosfato gamma de ATP es el que nos importa (pero no hay reservorio de ATP como tal lo más parecido es la creatina fosfato)
Para:
- Ejecutar trabajo mecánico, como la contracción muscular
- Transportar activamente iones y moléculas
- Crear nuevos tejidos
... Cualquier proceso que involucre el ATP (síntesis o degradación entraría aquí) !!! Todas las vías entran en contacto con otras vías.
Bioenergética
Estudia los cambios de energía que hay dentro de una reacción. Se suele liberar energía calorífica o mecánica
- Una reacción ENDERGÓNICA absorbe energía libre del ambiente y no es espontánea. (Hielo)
- Una reacción EXERGÓNICA (favorable) se da con una liberación neta de energía libre y es espontánea. (Combustión
A - - B Products 1 Free energy Amount of energy required ("G> 0) Energy Reactants Progress of the reaction (b) Endergonic reaction: energy required Reactants I 4 Amount of energy released (PG < 0) Free energy Energy Products Progress of the reaction (a) Exergonic reaction: energy released Comvista &: 2006, Pearson Freatine Ine. Publicina an Pearson Rartierin Camminns Ad ditets satablet Se mide según la energía libre de gibbs: Si es positiva endergónica, si es negativa exergónica.
Acoplamiento de reacciones
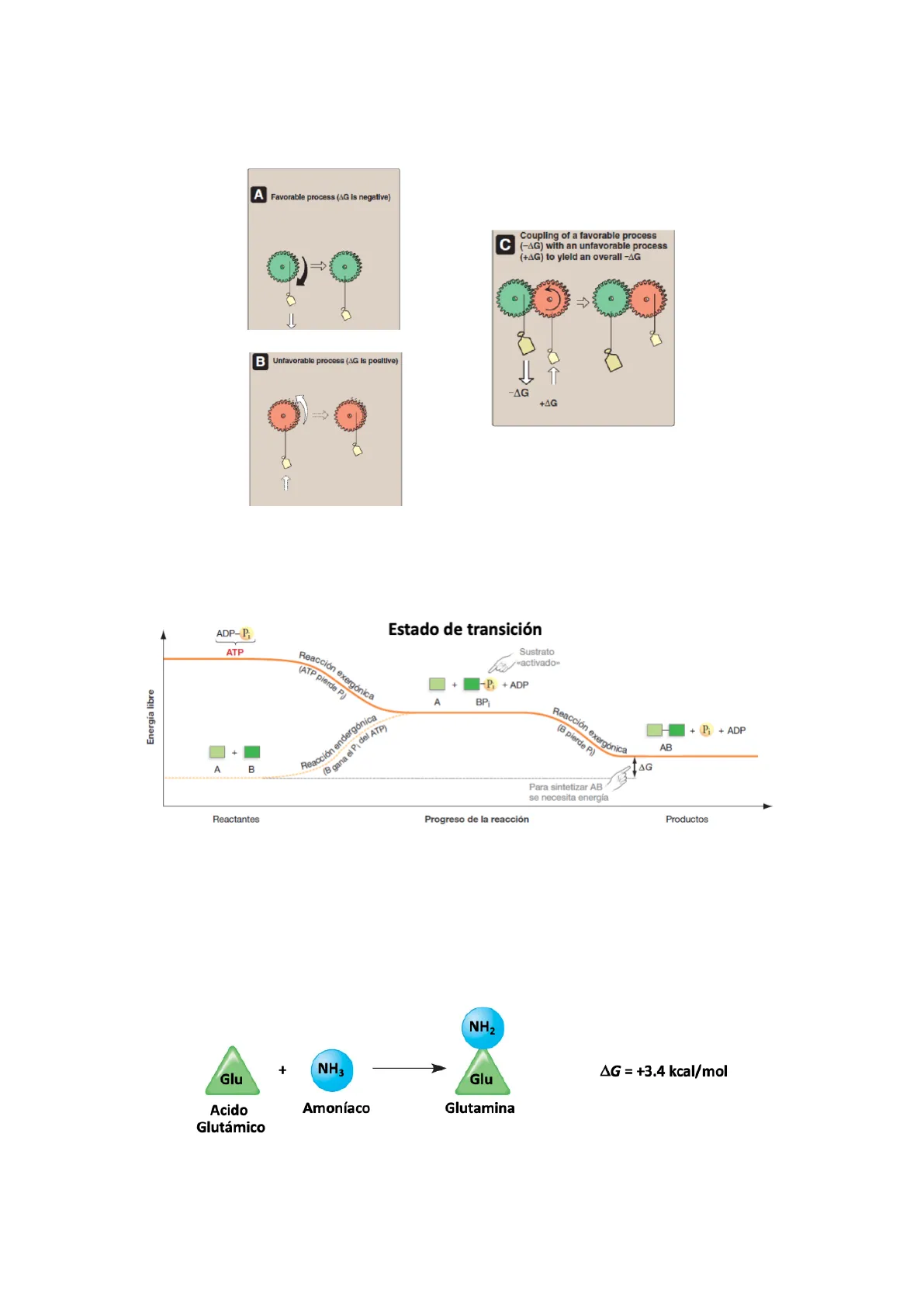
1Acoplar dos reacciones -> aprovecho la energía que me da una para realizar la siguiente A Favorable process (AG is negative) C Coupling of a favorable process (-AG) with an unfavorable process (+AG) to yield an overall -AG B Unfavorable process (AG Is positive) -AG +AG Aprovechamos la energía que libera una reacción exergónica (-) para realizar una reacción endergónica (+).
ADP-P; Estado de transición ATP Sustrato «activado» Energía libre A BP (B pierde P)) + Pi + ADP AB TAG A B Para sintetizar AB se necesita energía Reactantes Progreso de la reacción Productos Moléculas que se forman en el impas entre sustrato y producto.
Reacción endergónica
Reacción endergónica: AG es positivo, la reacción no es espontánea NH2 + NH3 Glu Glu AG = +3.4 kcal/mol Acido Glutámico Amoníaco Glutamina Reacción exergónica + Reacción endergónica (B gana el Pi del ATP) + P + ADP (ATP pierde P) Reacción exergónica 2Reacción exergonica: AG es negativo, la reacción es espontánea ATP + H2O ADP + Pi AG = - 7.3 kcal/mol Reacciones acopladas: el AG total es negativo; Las reacciones juntas, son espontánea AG = - 3.9 kcal/mol Por naturaleza nunca se dará la formación de glutamina ya que es endergónica. Lo que usamos es la hidrólisis que hará que en global la reacción sea exergónica.
Tipos de metabolismo
- Catabolismo (destruye): Liberación de energía que se aprovecha para la síntesis de ATP predominan las reacciones de oxidación
- Anabolismo (construye): Utilización de energía en forma de ATP predominan las reacciones de reducción
Oxidar: perder e- // Reducción: ganar e-
Heat Heat Cell macromolecules Energy- containing nutrients Proteins Polysaccharides Lipids Nucleic acids Carbohydrates Fats Proteins Larger molecules (for cytoplasmic membrane, cell wall, ribosomes, etc) Anabolism Metabolism Catabolism ADP+HPO2 NAD+ NADP+ FAD Anabolism Catabolism ATP NADH NADPH FADH2 Wastes Nutrients Chemical energy Precursor molecules Energy- depleted end products Amino acids Sugars Fatty acids Nitrogenous bases CO2 H2O NH2 Acoplando a la hidrólisis del ATP (a) Written as a one-step reaction COO- COO H3N-CH ATP ADP + P. H3N-CH CH2 CHz + NH3 CHz CH2 C O 0 NH2 Glutamate Glutamine ATP NH ADP COO H3N-CH 2 P CH2 CH2 C Enzyme-bound glutamyl phosphate (b) Actual two-step reaction 3 ATP Smaller molecules (amino acids, nucleotides, etc) CRubber Carotenoid pigments Steroid hormones Phospholipids Isopentenyl- pyrophosphate Cholesterol Bile acids Triacylglycerols Fatty acids Mevalonate Starch Alanine Phenyl- alanine Acetate Glycogen Glucose Pyruvate Acetoacetyl-CoA Eicosanoids (acetyl-CoA) Serine Leucine Isoleucine (a) Converging catabolism Citrate CDP-diacylglycerol Phospholipids Oxaloacetate (b) Diverging anabolism CO2 CO2 (c) Cyclic pathway Acetyl-coA (molecula central del metabolismo energetico) podemos generar muchas otras moléculas Glucosa no está en los azules porque no se puede generar a partir del Acetil-coA; no podemos producir glucosa a partir de las grasas (hay una pequeña excepción casi insignificante)
Moléculas clave
ATP
(a) El ATP está compuesto por tres grupos fosfato, ribosa y adenina. NH2 O O o= O H-C C-H O"-P-O-P-O-P-O -- CH2 N o Adenina H H Grupos fosfato H H OH OH Ribosa O O -- P-OH OH PPP PP + H2O + P + ATP Agua ADP Fosfato inorgánico 7,3 kcal/mol ATP Energía O -0 O (b) Cuando el ATP se hidroliza, se libera energía. 4
Metabolismo: Oxidación/Reducción
Vitamin K Cholesteryl esters Sucrose Fatty acids Triacylglycerols NMETABOLISMO: Oxidación/ Reducción oxidación pierden electrones -4 - 3 - 2-1 0+1 +2+3+4 +5 +6 ganan electrones reducción Reduction Compound B gains electrons e B Oxidising agent (oxidant) Reduced Molécula oxidada: pierde electrones Agente oxidante: coge electrones de otra molécula. Sustancia que se reduce Molécula reducida: gana electrones Agente reductor: dona electrones a otra molécula. Sustancia que se oxida
NAD/NADH
NAD+ Oxidado H O C-NH2 + H+ + 2e" Nicotinamida Fosfato Oxidado Ribosa Fosfato Adenina Ribosa NADH (transportador de electrones) Reducido H H O Reducción C-NH2 Oxidación N Nicotinamida Fosfato Reducido Ribosa Fosfato Adenina Ribosa Los protones salen de la base nitrogenada (saltan dos e-) NADH -> forma reducida NAD+ -> forma oxidada A Oxidation Compound A loses electrons A Oxidised Reducing agent (reductant) B NAD+ (sin e-) -> NADH (B gana electrones) 5
FAD/FADH2
FAD/FADH2 (2 ATP en ETC) FAD (oxidized form) FADH2 (reduced form) Flavin O H CH3 N 2H+ + 2 e- N N O CH3 N N O 1 1 1 CH2 Ribitol ADP H HCOH - NH2 HCOH - HCOH O O N N = ǁ ADP CH2-0-P-O-P-O-CH2 O H H H H OH OH FAD La coenzima FAD (flavín adenín dinucleótido) formada por riboflavina (vitamina B2) y adenosina difosfato se reduce a FADH2 añadiendo dos átomos de hidrógeno. FADH2-> forma reducida FAD-> forma oxidada
NADP/NADPH
NADP/NADPH Importante en la síntesis de ácidos grasos (se necesita gran cantidad) NADP+ oxidized form H O = nicotinamide ring + İN NH2 P P RIBOSE H- ADENINE ADENINE P-O- P RIBOSE RIBOSE O O P P this phosphate group is missing in NAD+ and NADH NADPH reduced form H H O C N NH2 N N 0 0 H O H CH3 N CH3 Ribitol RIBOSE 6
Metabolitos y rutas
NADH/NAD NADP/NAPH Metabolitos reducidos ATP ADP Metabolitos reducidos NAD+ quinasa NAD+ (oxidado) NADP+ (oxidado) Deshidrogenasas Transporte electrónico y fosforilación oxidativa Ruta de las pentosas fosfato Reductasas NADH (reducido) NADPH (reducido) Metabolitos oxidados Transhidrogenasa mitocondrial ligada a la energía NADP+ NAD+ Metabolitos oxidados CATABOLISMO (ruta oxidativa) - Flujo electrónico ANABOLISMO (ruta reductora) Predominan reacciones de reducción
Producción y almacenaje de ATP
Fosforilación oxidativa
Fosforilación oxidativa MITOCHONDRION Inner membrane _ Outer membrane ADP + Pi ATP Complex V (F1 domain) Matrix -Intermembrane space NAD+ 1/202 H2O MITOCHONDRIALNADH MATRIX ATP/ADP transporter e- Electron flow e Complex V (F) domain) Complex I Complex Complex IV INTERMEMBRANE SPACE H H H H ADP ATP Si no hay mitocondrias basan su metabolismo en la fermentación. La fosforilación oxidativa produce ATP en las mitocondrias al usar electrones para generar un gradiente de protones que impulsa la ATP sintasa. 7
Fosforilación a nivel de sustrato
Fosforilación a nivel de sustrato Glucolisis - 2 ATP A Intermediates in the biochemical pathway B K P: B~P I C~P ADP D + ATP Substrate-level phosphorylation La fosforilación a nivel de sustrato genera ATP directamente al transferir un grupo fosfato desde un sustrato a ADP, sin necesidad de una cadena de electrones.
Sistema creatina fosfato
Sistema creatina fosfato ADP ATP HO H2N HO OH NH NH2 Creatine ADP ATP Phosphocreatine Muscle at rest ATP from metabolism + creatine - ADP + phosphocreatine Working muscle Phosphocreatine + ADP creatine kinase + Creatine + ATP ATP Metabolismo aeróbico Energía - Metabolismo anaeróbico Segundos-+ Minutos -+ Horas -+ Coge ATP y coge creatina para generar fosfocreatina Durante un esfuerzo corto e intenso, como un sprint o levantamiento de pesas, la fosfocreatina se descompone rápidamente, liberando energía que permite regenerar ATP. -> sistema que se consume muy rápido El sistema creatina fosfato proporciona energía rápida al transferir un grupo fosfato de la fosfocreatina al ADP, formando ATP, durante actividades de alta intensidad y corta duración. ADP ATP N HO IZ N OH NH2+ O NH Creatine ADP Phosphocreatine ATP 8
Creatina fosfato y su función
Creatina fosfato H2N. HO-Arginine + Glycine Creatine biosynthesis GAMT Creatine cerebro · muscular Guanidinoacetate > Arginina glicina amidin transferasa Cr .. Bloodstream Creatine transporter JUU JUUU TRABAJO Cardiomyocyte P REPOSO ATP Cr Cr + ATP 1. Buffering ATP/ADP Mt-CK version mitocondrial de la entima 3. Energy storage + estable que ATP MM-CK version citoplasma de entima Mitochondria ADP + P Cr P Cr + ADP Phosphocreatine lo hace. la creatina kinasa La creatina se fosforila para almacenar energía, ya que la creatina fosforilada (fosfocreatina es mucho más estable que el ATP (esto ocurre en el cardiomiocito). Por lo tanto cuando la celula esta en reposo la mitocondria fosforilará la creatina a través de una enzima (creatina quinasa) y cuando la celula este trabajando desfosforilará (a través de la creatina quinasa que se encuentra en el citosol) la creatina y así podrá ser utilizada. Heart: * Energy requirement: 6 Kg ATP/day ( No puede vivir con met. anaerobico) Tejido rico en mitocondrias * > 90% ATP generated by oxidative phosphorylation * ATP pool: 0,6 g (<20 sec of normal cardiac function) 9
Enzimas
AGAT Imp. Cr cardiaco creating se elimina en Queannina a traves Creatine P + de la orina ( Fallos renales) 2. Energy transportEnzimas Especificas para su sustrato. Catalizan una reacción concreta. Utilizan cofactores (moleculas que ayudan a la actividad enzimatica). Se pueden inhibir. . - Substrate (a) - Active site Key (substrate) Lock (enzyme) Enzyme (b) Lock-Key Complex Enzyme-Substrate Complex No es del todo correcto ya que la enzima (el centro activo) se acopla un poco al sustrato para que acabe de encajar. (a) No enzyme Substrate (metal stick) Transition state (bent stick) Products (broken stick) (b) Enzyme complementary to substrate Magnets ES (c) Enzyme complementary to transition state ES E P Las enzimas aceleran la reacción pero no cambian la AG Course of reaction without enzyme EA without enzyme EA with enzyme is lower Free energy Reactants Course of reaction with enzyme AG is unaffected by enzyme Products Progress of the reaction Si km menor es por su sustrato o producto no se llevará acabo reacción Lo que hacen enzimas es disminuir Ea (AG no canvia ), es lo que llamamos estado de transición que tiene que ser óptimo para enzima. En su sitio activo hay modificaciones para que el estado de transición tenga afinidad óptima y eso es lo que realmente acelera la reacción. 10