Amminoacidi: struttura, funzioni e metabolismo delle proteine e dei lipidi
Documento dall'Università sugli Amminoacidi. Il Pdf esplora la struttura e le funzioni degli amminoacidi, i monomeri delle proteine, e ne descrive la classificazione in base alla polarità. Il Pdf, utile per lo studio della Biologia a livello universitario, approfondisce il metabolismo delle proteine, lipidico e dei composti azotati, con un focus sulla lipolisi e il ciclo dell'urea.
Mostra di più24 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Amminoacidi
Gli amminoacidi sono i monomeri costituenti le proteine, sono 20 ordinari che costituiscono le proteine (standard, primari). Alcuni amminoacidi sono essenziali dal punto di vista nutrizionale perché non sono sintetizzarti dal nostro organismo, quindi, devono essere introdotti con la dieta. Alimenti ricchi di amminoacidi essenziali come il latte e i formaggi. I legami tra i vari amminoacidi sono detti peptidici. Gli amminoacidi essenziali sono 8 e vengono indotti con la dieta, gli amminoacidi si dividono in polari e apolari a secondo della distribuzione asimmetrica o simmetrica degli elettroni dei gruppi R.
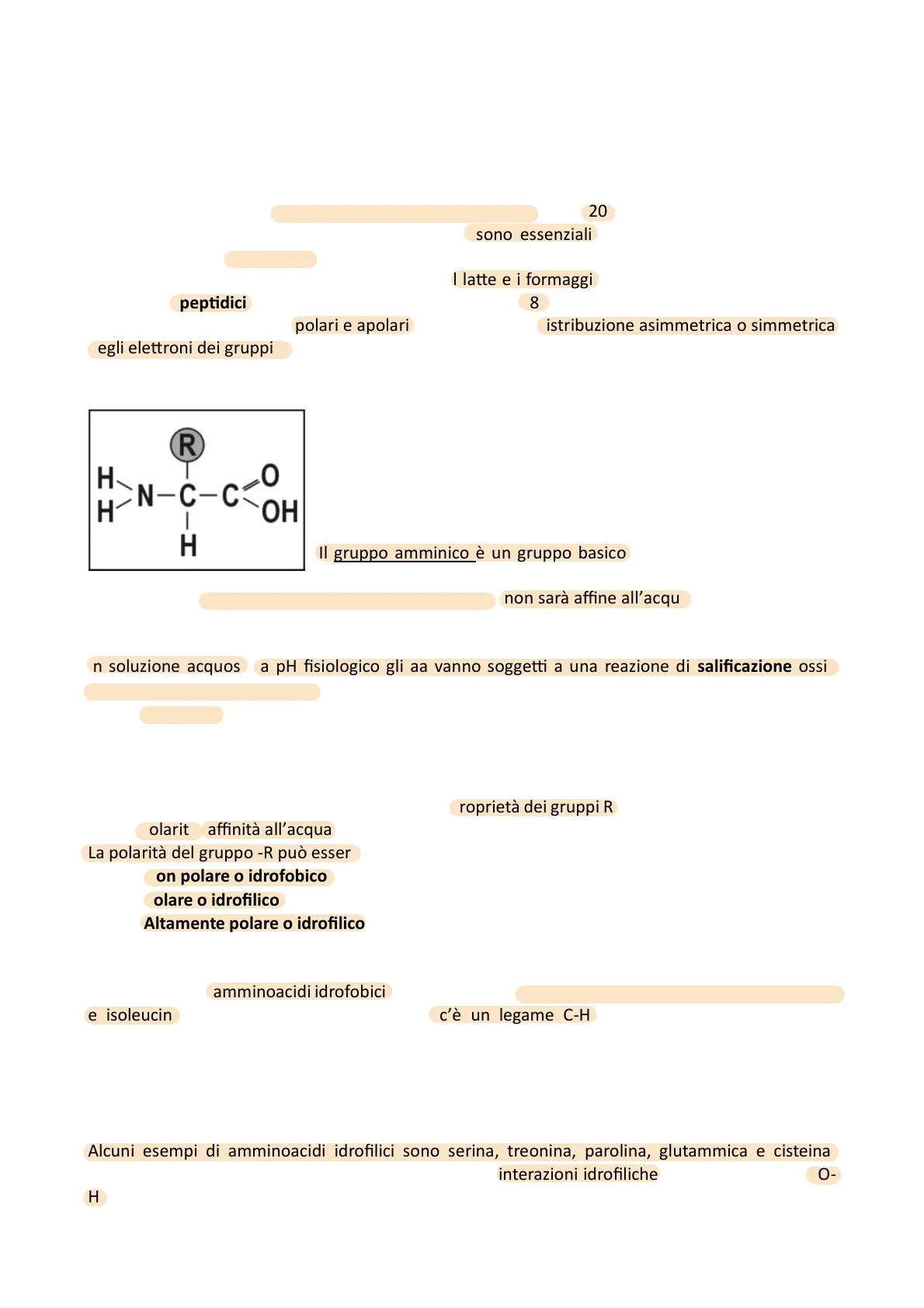
Formula generale degli amminoacidi
R II H N-C-C -c- OH 1 H C'è un carbonio centrale noto come carbonio alfa (Chirale) a cui è legato un idrogeno (H), un gruppocarbosillio COOH (acido in grado dietare ioni H+), un gruppo amminico NH2 (base: in grado di cedere ioni H+) e un gruppo R. C'è un gruppo R, che è diverso per i 20 diversi amminoacidi, la glicina è l'amminoacido più semplice ed R per la glicina è un atomo di idrogeno.
Il gruppo amminico è un gruppo basico, in grado di legare ioni H+ invece il gruppo carbossilico è un gruppo acido secondo in gradi di cedere ioni H+. Se il gruppo R è un gruppo non polare, non sarà affine all'acqua ma sarà un gruppo idrofobico, se il R è un gruppo polare sarà affine all'acqua quindi sarà idrofolico.
In soluzione acquosa, a pH fisiologico gli aa vanno soggetti a una reazione di salificazione ossia formazione di un sale interna (un acido e una base reagiscono). Quindi si presentano nella loro formula ionizzata (dipolare dove ha una carica - e una carica +). Il gruppo carbossilico cede il protone H+ al gruppo amminico NH2 che diventa NH3+.
CLASSIFICAZIONE DEGLI AMMINOACIDI
Gli amminoacidi vengono classificati in base alle proprietà dei gruppi R e in particolare considerando la loro polarità (affinità all'acqua) o tendenza ad agire con H20 a PH fisiologico.
Polarità del gruppo -R
La polarità del gruppo -R può essere:
- Non polare o idrofobico, non affine ad H2O, come C-H;
- Polare o idrofilico ossia affine all'acqua, si sarà un legame O-H o N-H o S-H (tiolo);
- Altamente polare o idrofilico ossia affine all'acqua.
AMMINOACIDI IDROFOBICI
Alcuni esempi di amminoacidi idrofobici (non polare) sono alanina, valina, leucina, glicina, metionina e isoleucina. Gli amminoacidi idrofobiche, c'è un legame C-H, daranno interiori idrofobiche. Promuovono interazioni idorofobiche che diventano particolarmente forti quando gli anelli aromatici (planari) sono impilati l'uno sull'altro. Il gruppo polare O-H della tirosina può formare legami di idrogeno ed agisce come gruppo funzionale importante nell'attività di alcuni enzimi.
AMMINOACIDI IDROFILICI
Alcuni esempi di amminoacidi idrofilici sono serina, treonina, parolina, glutammica e cisteina. Quest'aa hanno affinità con l'acqua quindi promuovo interazioni idrofiliche perché ha il gruppo O- H.Il gruppo -R polari carichi negativamente a PH fisiologico sono dissociati quando possiedono un secondo gruppo carbossilico COO-sono idrofilici. Questi amminoacidi detti monoammino perché hanno un gruppo amminico e bicarbossilici perché hanno gruppi carbosillici. Ci sono degli amminoacidi hanno un gruppo negativo come nella lisina, ha un secondo gruppo amminico protonato (positivo).
Le interazioni idrofobiche e idrofiliche sono responsabili del ripiegamento (folding) delle proteine in ambiente acquoso. Se -R nella cisteina è un gruppo CH2SH è un gruppo tiolico.
L'insulina è un ormone ipoglicemiazante, non è una vera e propria proteina perché si parla di proteine quando c'è una catena di amminoacidi, è un ormone peptidico. La struttura è tenuta ferma da dire ponti di solfuro.
LISINA E ASPARTATO
La vicinanza sulle proteine di residui di lisina, gli AA nel gruppo -R presenta una seconda carica positiva a residui di aspartato che negli AA nel quale -R presenta una seconda carica negativa, creano un ponte salino. Un legame stabilizza la struttura terziaria delle proteine. Gli amminoacidi creano dei ponti salini in cui uno di queste due cariche positive (aspartate e glutamate) e con uno di 3 cariche negative.
AMMIDI SECONDARIE
Quando un acido carbosillico reagisce con un gruppo amminico di un'ammina primaria (RNH2, la reazione avviene con l'eliminazione di una molecola l'acqua e si forma il legame carboamminico. Se amminoacido 1 R H3N-CH-C-OH +H-N-CH-COO O H R2 H2O amminoacido 2 il legame avviene tra due amminoacidi è detto peptico, dove il gruppo carbossilico di due amminoacidi, va via la molecola d'acqua e si forma il legame peptico. La doppia freccia indica che la reazione è reversibile, quindi che questo legame viene spezzato o idrolizzato. Se viene spezzato di riformano i due amminoacidi non legati. H2O 11 R1 H R2 H3N-CH-C-N-CH-COO Ö
- Peptide = è formato dall'unione di due o più amminoacidi legati con il legame peptidico -CO-NH;
- Oligopeptide = con l'unione di pochi amminoacidi;
- Polipetide = con l'unione di molti amminoacidi, porta alla formazione di una proteina. Ad esempio, il lisosima che ha un'azione antimicrobica;
- Dipeptide = due amminoacidi legati, quando viene spezzato vengono liberati gli amminoacidi.
Il processo di digestione è la premessa del metabolismo, ad esempio noi non metabolizziamo le proteine ma gli amminoacidi. I nostri carburanti sono il glucosio, acidi grassi e amminoacidi. Pentapeptide = legame CONH (legame peptidico).
Proteine
Le proteine sono delle macromolecole più abbondanti nelle cellule viventi di cui costituiscono il 50% del peso secco. Esse sono presenti in tutte le cellule, in tutte le loro parti, in migliaia di tipi differenti. Le proteine hanno tante funzioni:
- Catalizzatori ossia enzimi, tutti gli enzimi sono proteine;
- Trasportatori com emoglobina che trasporta ossigeno;
- Ormoni come l'insulina.Le proteine sono dei polimeri di amminoacidi, possiamo anche chiamare poli amminoacidi.
4 LIVELLI STRUTTURALI DI UNA PROTEINA
STRUTTURA PRIMARIA
Per struttura primaria si intende il numero e la sequenza degli amminoacidi, legati tra di loro con il legame peptidico. Dobbiamo pensare a un filo che indica la catena degli amminoacidi. La catena polipetidica la chiamiamo filo. La rotazione è impedita nel legame polipetidico perché è parzialmente doppio ed è consentito negli altri. Il legame peptidico si forma fra il gruppo carbossile di un amminoacido e il gruppo amminico dell'amminoacido adiacente, attraverso una reazione di condensazione in cui viene eliminata una molecola d'acqua. Molte patolgie hanno alla base una mutazione della struttura primaria delle proteine, come l'anemia falciforme che deriva da una mutazione della sintesi dell'emoglobina, i globuli ossi sono resi falciformi d'ala partecipazione dell'emoglobina.
STRUTTURA SECONDARIA
La struttura secondaria è un'organizzazione regolare e ricorrente nello spazio di residui di amminoacidi vicini, non è relativa a tutta la catena peptidica ma è relativa a segmenti della catena polipotedica. I pezzi del filo assumono una disposizione dello spazio regolare e ricorrente. La struttura secondaria è presente un legame ad idrogeno. I segmenti della proteina possono disporsi nello spazio in due modi:
- Alfa elica, i gruppi R sono di grandi dimensioni e puntano verso l'esterno (sono solo destrorse), struttura a bastoncino, la parte più interna è la catena polipetidica, la parte più esterna sono le catene laterali R, tutti i gruppi C=O E NH sono legati con un legame ponte a , Alfa elice `o-0-o ..... I-Z H -N-0-0 H 0=0 Beta foglietto idrogeno. I legami ad idrogeno avvengono all'interno della catena. Sono chiamati legami ad idrogeno intra catena;
- Beta foglietto, I gruppi R sono di piccole/medie T -I ..... O -O dimensioni. È una struttura estesa a pieghe. C=O O 3 legame J a idrogeno sono legati a NH con legami idrogeno di catene diverse e non tutte. Ad esempio, le porine hanno una struttura a beta-foglietto, sono immersi nella membrana cellulare. Sono dette porre perché fanno passare l'acqua, è l'unica molecola polare che è stata agevolata da un canale. Il legame ad idrogeno avviene tra due catene, tra i gruppi peptidici di una catena e i gruppi peptidici di una sonda catena quindi sono inter- catena.
Non c'è una proteina con un filo tutto ad alfa elica o beta foglietto ma ci sono proteine il cui filo è costituito d pezzi ad alfa elica, alfa elica e poi beta foglietto ...
STRUTTURA TERZIARIA
Se ho 8 segmenti sia che siano ad alfa elica o beta foglietto si riposano e danno origine a un gomitolo, il filo si ripiega e forma la sub-unità globulare oppure gomitolo. Quindi la struttura terziaria è il ripiegamento della catena polipetidca (subunità globulare). Ci sono proteine che si ripiegano. Cui segmenti sono tutti ad alfa elica come la mioglobina o proteine i cui segmenti sono a beta foglietto oppure proteine miste che si formano con il ripremuto di tratti ad alfa elica o beta foglietto come l'albumina. Stabilizzata da interazioni idrofobie interne alla molecola dove gli amminoacidi con -R idrofobico e da interazioni polari hanno legami H con interazioni ioniche sulla superficie della molecola. Ad esempio, con L'alfa elica abbiamo la mioglobina (8 filamneti che si ripiegano), con il beta foglietto il poina saccarosio specifica, con sia l'alfa elica che il beta foglietto albumina. I ponti disolfuro sono gli unici legami covalenti forti che si possono formare nel ripiegamento delle proteine e stabilizzano la struttura terziaria delle proteine. Stabilizzano la struttura terziaria:
- Ponti di solfuro;
- Legami ad idrogeno;
- Ponti salini;
- Interazioni idrofobiche
Nel sangue sono presenti delle proteine che hanno la capacità di tamponare a PH fisiologico perché c'è l'istidina (amminoacido), hanno capacità di tamponare.
STRUTTURA QUARTERNARIA
Quando la proteina è formata da una solo una sub-unità globulare sono dette proteine monomeriche. Assume la struttura quaternaria quando è formata da almeno due sub-unità polipetidiche si associano con interazioni deboli ossia legame ad idrogeno con interazioni idorofobiche e ponti salini, che se si associano 3 gomitoli. Perché una proteina abbia una struttura quaternaria deve avere almeno 2 sub-unità, non necessariamente solo 4. Struttura quaternaria significa che è l'associazione di almeno 2 sub-unità, ad esempio la emoglobina è detta tetramerica perché sono 4 sub-unità che si associano. Ad esempio l'emoglobina.
Ci sono proteine che hanno al massima hanno struttura primaria o secondaria che sono dette proteine fibrose, ad esempio il collagene, elastica e cheratina alfa e beta. Ci sono delle proteine che hanno struttura terziaria e quaternaria sono dette globulari, ad esempio l'emoglobina e l'albumina.
CLASSIFICAZIONE DELLE PROTEINE
Le proteine posso essere classificate in base alla composizione chimica:
- Se sono costituiti solo da amminoacidi sono dette semplici;
- Se nelle proteine è presente una compone non aminoacidica, è detta coniugata. La componente non amminoacidica è detta gruppo prostetico. Ad esempio, nelle lipo proteine i lipidi (devono essere trasportati nel sangue i trigliceridi e il colesterolo) o cromo-proteine in cui il gruppo protetico è il ferro eme. La parte proteica è coniugata alla parte non amminoacidica;
Le proteine sono classificate in base alla forma:
- Fibrose, hanno forma allungata;
- Globulari, hanno forma a gomitolo.
PROTEINE FIBROSE
Le proteine fibrose sono insolubili in acqua essendo costituite per la maggior parte da amminoacidi con il gruppo -R idrofobico. Presentano forma allungata e struttura secondaria ad alfa elica oppure beta foglietto.
ALFA CHERATINA
L'alfa cheratina è una proteina filamentosa ricca di zolfo contenuto nei residui amminoacidica di cisteina (Ponti di solfuro -s-s). È stabile e resistente. Costituite dello strato cornerò dell'epidermide e di appendici quali unghie, capelli, corna e piume degli uccelli. Nei capelli ci sono anche tanti ponti di solfuro che sono dati da un aminoacido solamente detto cisteina. La seta è una proteina detta beta cheratina perché la struttura secondaria è a beta foglietto