Biochimica metabolica: reazioni di ossidoriduzione e glucidi
Documento di Biochimica metabolica, lezione 02, che esplora le reazioni di ossidoriduzione e il ruolo dei cofattori NAD+ e FAD. Il Pdf, utile per lo studio universitario di Biologia, analizza la struttura e la funzione dei glucidi e il meccanismo d'azione degli enzimi chiave della glicolisi, come l'esochinasi e la gliceraldeide 3-fosfato deidrogenasi.
Mostra di più12 pagine
Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Reazioni di ossidoriduzione
Reazioni ossidative che generalmente servono per degradare le molecole e per ottenere energia tramite produzione di ATP. La volta scorsa ha introdotto i cofattori: NAD+ >nicotinammide adenin dinucleotide NADP-> nicotinammide adenina dinucleotide fosfato FAD-> flavina adenina dinucleotide FMN->flavina mononucleotide Sono cofattori importanti al livello delle ossidoriduzioni.
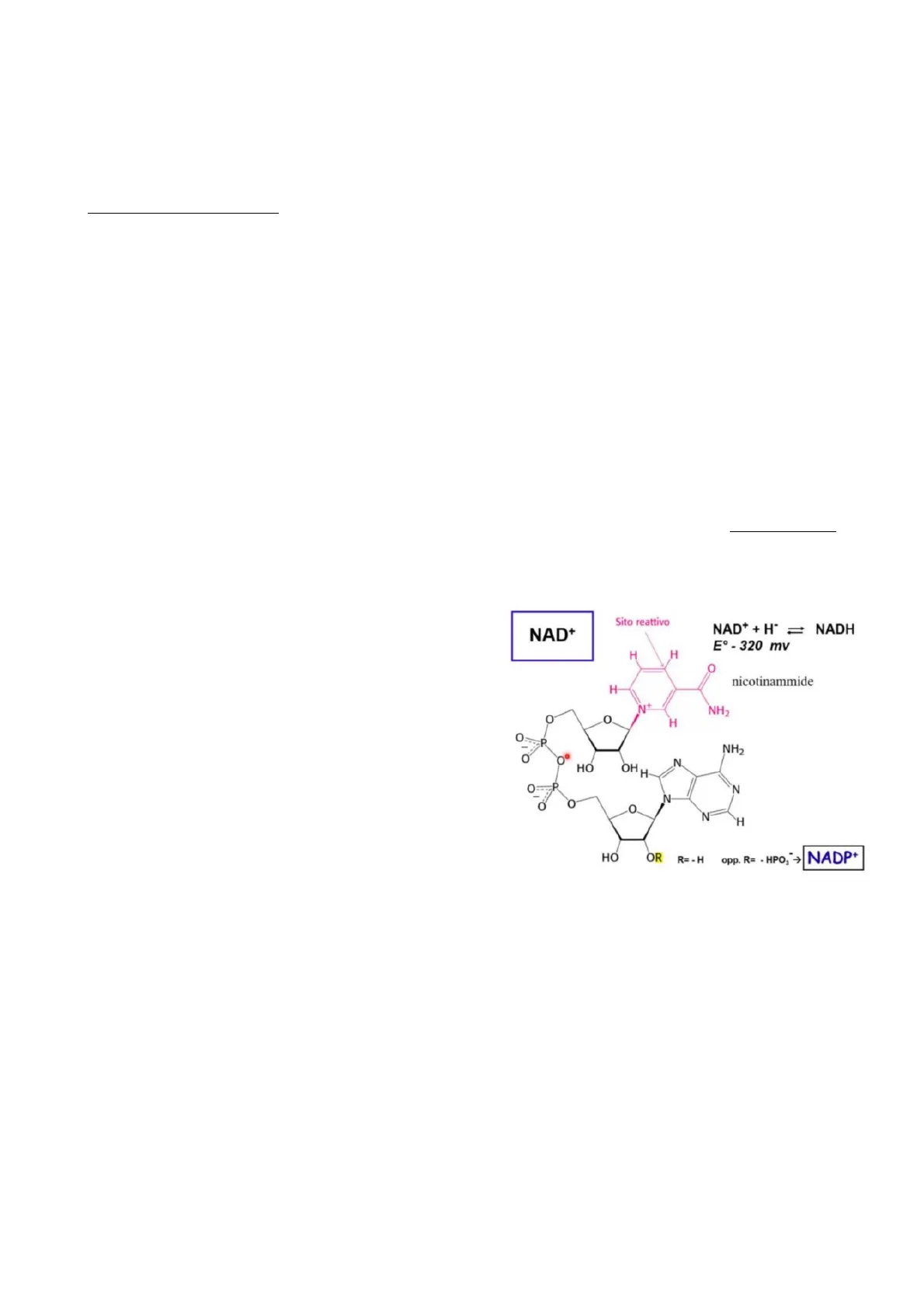
NAD+ Nicotinammide adenin dinucleotide
Come è possibile osservare nell'immagine, è un dinucleotide. In basso è presente l'AMP legato con la molecola superiore con un legame fosfoanidridico. Il secondo nucleotide è costituito dal gruppo fosfato, dal ribosio e in posizione 1' (del ribosio) si trova la nicotinammide. Questa è un derivato della piridina in cui in posizione 5 c'è un gruppo ammide (CONH2) che a sua volta deriva dall'acido nicotinico. La parte attiva della molecola del NAD è indicata in figura. La reazione a cui prende parte come cofattore è NAD++H NADH. Questa molecola è in grado di prelevare da una molecola di substrato uno ione idruro H (2e e 1 protone) e il risultato della reazione è la formazione della molecola nella sua forma ridotta. Sito reattivo NAD+ NAD+ + H" = NADH Eº - 320 mv H H O nicotinammide H N+ NH2 O O H L'idruro entra in quel determinato punto (sito reattivo) in o P NH2 seguito a determinate ragioni. I carboni C che si trovano in O O N posizione orto e para sono quelli che possono prelevare un HO OHH e- in più, perché se entra in questi siti la molecola P N O O N assumerebbe la neutralità. Quindi i siti in cui può legarsi N H una carica negativa sono 1,2,3 e tra queste la favorita è quella in 3'. Un motivo è dato dall'effetto induttivo, che fa HO OR R= - H opp. R= - HPO] > sì che ci sia maggiore attrazione, e di conseguenza maggiore polarizzazione dell'anello aromatico su quel punto e inoltre viene scelto questo perché è più accessibile, infatti, l'altro è nascosto dalla presenza del gruppo amminico (ragioni steriche).
NADP+
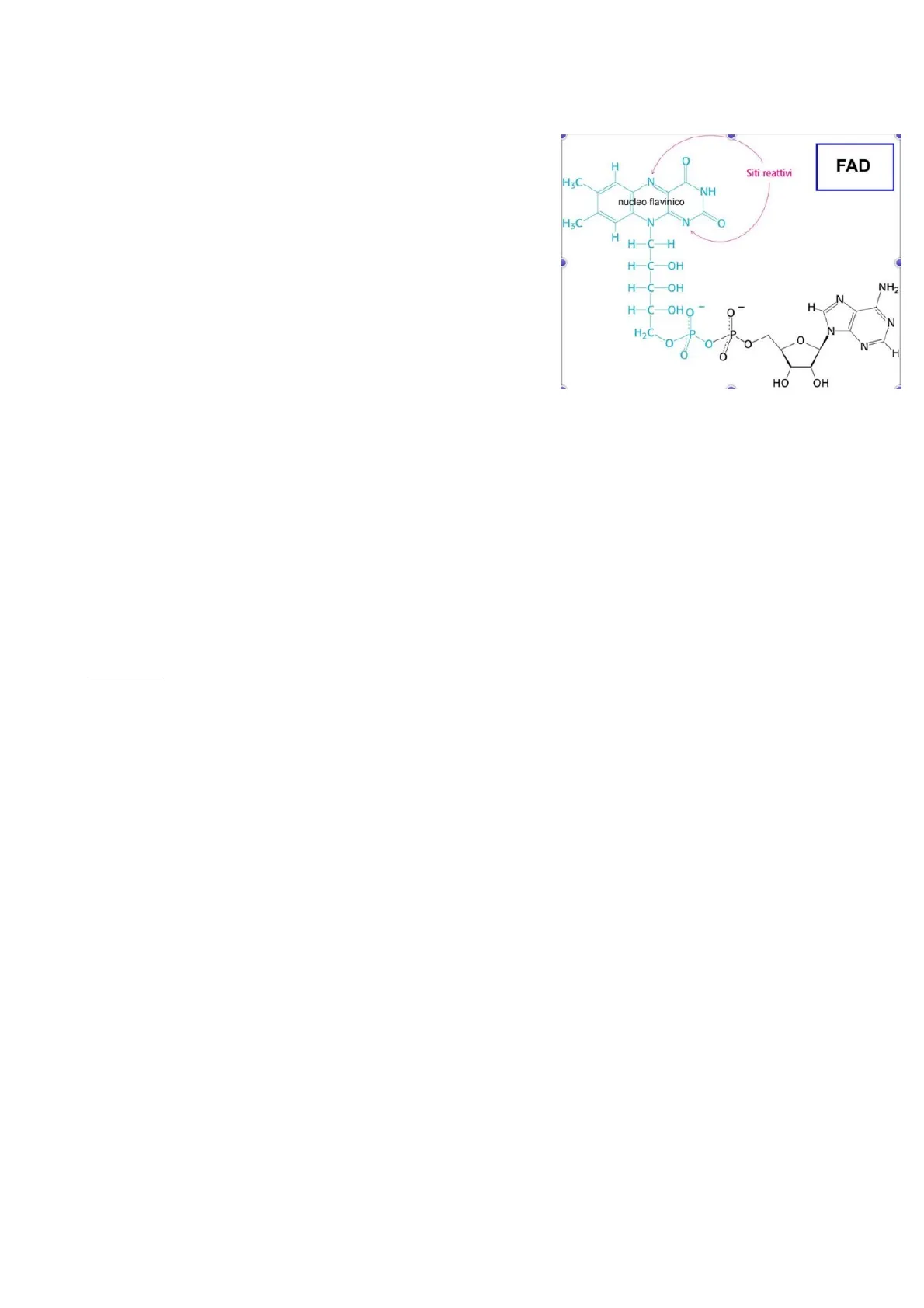
Per quanto riguarda il NADP+ si ha la stessa molecola ma con la presenza del gruppo fosfato in posizione 2' (C) dell'AMP. Si ha lo stesso tipo di reazione ed anche lo stesso potenziale redox (-320mV). Generalmente il NADPH è usato per le reazioni anaboliche mentre il NAD+ per le reazioni cataboliche (quasi esclusivamente). Quindi le reazioni sono: NAD++H++H NADH+H+ NADP++H++H+NADPH+H+FAD Flavin adenina dinucleotide Costituito da AMP e nucleo flavinico. In questo caso la reazione è: FAD+2H - FADH2 Eº =- 220mV In questo caso il cofattore preleva due atomi di idrogeno (2 protoni e 2 elettroni). Il potenziale redox ¿ minore rispetto alla coppia NAD+/NADH(Eº =- 320mV), ma comunque, la coppia FAD/FADH2 ha sempre capacità ossidante (ridotti nella reazione). Questo si rifletterà nella resa energetica poiché si otterranno circa 1,5 ATP per ogni molecola di FADH2 che viene ridotta, mentre dal NADH si otterranno 2,5 ATP. A differenza del NAD utilizzato sempre come ossidante libero e quindi il potenziale è sempre lo stesso, il FAD può essere utilizzato anche legato agli enzimi e a seconda dell'ambiente in cui si trova il nucleo flavinico, il potenziale redox può cambiare (può arrivare anche vicino a 0°). O H FAD H3C. N NH nucleo flavinico N N O H H-C-H H-C-OH H-C-OH NH2 N H H-C-OHOT O N H2C. P P O O O N H O HỒ OH Nel NAD+ la parte attiva è costituita dall'acido nicotinico derivato dalla vitamina B3 o vitamina PP (inserita sul ribosio fosfato) mentre nel FAD è derivato dalla vitamina B2, devono quindi essere acquisite tramite la dieta. È importante dire che i coenzimi non attraversano le membrane biologiche in nessun modo. Quindi all'interno dell'ambito cellulare la loro concentrazione rimane costante. La cellula è ben strutturata in modo tale che i diversi ambienti abbiano il loro proprio potenziale di ossidoriduzione ben definito. E non cambia se non temporaneamente, infatti eventuali modifiche al potenziale possono essere "mortali" per la cellula.
Glucidi
Contenuti soprattutto nei cereali (frumento, riso, segale ecc ... ), sono molecole piuttosto distribuite. Quelle più semplici si trovano come "pile" di unità glucidiche mentre quelle più complesse sono sottoforma di strutture polimeriche (amido, glicogeno). Con l'alimentazione, l'organismo umano introduce gran parte dei carboidrati sottoforma di amido (origine vegetale). Quest'ultimo è costituito da due tipi diversi di macromolecole: amilosio e amilopectina. L'altra molecola polisaccaridica è il glicogeno, introdotta con la carne e inoltre il glicogeno è sintetizzabile anche dall'organismo umano stesso; infatti, è possibile distinguere due tipi di glicogeno: epatico e muscolare. Il glicogeno epatico viene immagazzinato a livello del fegato dove ha lo scopo di "sostenere" la glicemia nei momenti di carenza di glucosio ovvero nelle ore lontano dai pasti, mentre il glicogeno muscolare ha lo scopo di fornire energia rapidamente in seguito alla contrazione muscolare. Poi introduciamo i disaccaridi come il saccarosio e lattosio e i monosaccaridi come glucosio, fruttosio e galattosio (possono essere assorbiti al livello intestinale). All'interno del nostro organismo abbiamo il glucosio che circola nei vasi sanguigni con una concentrazione di circa 4/5 millimolare ed è utile a "rifornire" i vari organi e tessuti che richiedono questa molecola. I monosaccaridi possono essere aldosi o chetosi; gli aldosi hanno il CHO all'estremità della molecola, mentre nei chetosi abbiamo un C=O all'interno della molecola. Quelli di nostro interesse sono costituiti da 3 a 6/7 atomi di C. Tra i disaccaridi si ha il saccarosio, il lattosio e il maltosio. Tra i polisaccaridi si ha l'amido, il glicogeno, la cellulosa (non digeribile dall'uomo) e l'eparina. N Siti reattivi H3CSACCAROSIO Costituito da una molecola di a-glucosio e una di ß-fruttosio unite dal legame a-1,2-glicosidico. (il prof. invita ad imparare la struttura del glucosio). OH Il glucosio ha una struttura alifatica a 6 atomi (piranosidica) e presenta un ponte ossigeno, cioè un legame emiacetalico, tra il carbonio 1 e il carbonio 5. La struttura ciclica si viene a formare quando il glucosio è in soluzione acquosa e al 95% lo ritroviamo in questa forma. Invece il fruttosio ha un anello ciclico a 5 atomi (furanosinico), di cui quattro sono carboni e uno è l'ossigeno. Il fruttosio è un chetoso (il gruppo C=O è sul carbonio 2, che forma un legame emiacetalico con la posizione 5 della molecola), mentre il glucosio è un aldoso (il gruppo CHO è sul carbonio 1). Il glucosio presenta legami equatoriali, mentre il fruttosio legami assiali (ovviamente i carboni sono tutti di tipo sp3, quindi hanno i legami orientati verso i vertici di una piramide tetragonale). но HO- OH CH,OH O OH ČH2OH OH
Lattosio
Formato da una molecola di ß-glucosio e una di ß-galattosio. Il galattosio è un epimero del glucosio, cioè possiedono la stessa struttura ma in posizione 4 l'ossidrile del galattosio è in posizione diversa rispetto a quello del glucosio (nel galattosio è in su, nel glucosio in giù). Inoltre, il ß-glucosio in posizione 1 ha il gruppo ossidrilico in forma equatoriale, mentre nell' a- glucosio è assiale, cioè verso il basso. OHOH H OH HO H HO HO- O -OH HO- H OH H H H H ß-galattosio OH O HO OH HO HO O O HO OH HO
Polisaccaridi
L'amilosio è un polimero del glucosio in cui sono presenti solo legami a-1,4, perciò è un polimero senza ramificazioni. Stessa cosa vale per la cellulosa, dove però abbiamo il glucosio di tipo ß; la cellulosa per noi non è digeribile, dato che non possediamo enzimi in grado di idrolizzare legami glicosidici di tipo ß, ma abbiamo quelli per catalizzare l'idrolisi dei legami a-1,4. L'amilosio è uno dei polisaccaridi contenuti nell'amido, quindi nei cereali. Tra i polisaccaridi ramificati abbiamo, in posizione 1,6, sia il glicogeno che l'amilopectina, che tra di loro presentano grosse differenze a livello di struttura. POLISACCARIDI Omopolisaccaridi Non ramificato (amilosio e cellulosa) Ramificato (glicogeno e amilopectina) Eteropolisaccaridi Due tipi di monomeri non ramificati Diversi tipi di monomeri ramificati ß-glucosio
Maltosio
Formato da due unità di a-glucosio tenuti insieme dal legame a-1,4-glicosidico (legame riscontrabile anche nel glicogeno e nell'amido). Il maltosio è prodotto della degradazione dei polisaccaridi; quando avviene la digestione di polimeri ottenuti dall'amido, si formano come prodotto di degradazione anche questi disaccaridi. H OH6CH2OH 5 CH2OH CH2OH CH2OH O 0 0 H H H H H H H H Estremità non riducente 4 1 a 4 OH H OH H OH H OH H O 3 2 H OH H OH OH H ÓH (a) Amilosio 6CH2OH O H H H 4 OH H punto di ramificazione (a1->6) Estremità riducenti X 6CH2 Estremità non riducenti XXX Amilopectina 4 1 OH H 0 0 Catena principale H OH (b) (c) La struttura dell'amilosio presenta un'estremità con gruppo ossidrilico in posizione 4 e un'estremità con gruppo aldeidico in posizione 1. Quest'ultima è detta estremità riducente perché il gruppo aldeidico è reattivo e tende ad ossidarsi prelevando ossigeno. Mentre l'altra estremità (non riducente) non reagisce poiché il gruppo ossidrilico è stabile. Nei punti di ramificazione abbiamo il legame fra il carbonio 6 e il carbonio 1 di una nuova catena; quindi, dal carbonio 6 possono partire nuove catene. Nel glicogeno ci sono molte più ramificazioni. Nella cellulosa i legami ß-1,4 fanno sì che si formino dei legami idrogeno intra-catena e trasversali tra catene diverse (struttura molto più stabile e rigida); per digerire la cellulosa sono necessari enzimi abbastanza complessi. ỌH OH II IHO 6 4 O 5 2 O 1 O HO- OH 1 ÓH Unità di D-glucosio unite con legami (B1->4) L'eparina_è un'anticoagulante, perciò deve essere una molecola in grado di impedire la coagulazione del sangue. Presenta molte cariche negative (SO3, COO*) e grazie a ciò è in grado di sequestrare ioni calcio. (utile all'anticoagulazione). eparina (anticoagulante) RO- CHE coo -CH2 0 0 0 OH OH OSOS OH O NHR' OH OSO3" HN -SO3 "so." R = H or SO3 R' = SO3 or COCH, METABOLISMO DEL GLUCOSIO È un metabolismo universale, tutte le cellule hanno questa capacità (demolire il glucosio). Per quanto riguarda il nostro organismo, il glucosio è contenuto nel sangue e la sua concentrazione normale oscilla intorno a 4,5-5 milliMolare cioè 70-100 mg/dl. Se la concentrazione (glicemia) si abbassa e permane per troppo tempo si possono avere seri danni all'organismo. In particolare, ne risentirebbero principalmente gli eritrociti e il cervello che utilizzano glucosio per ricavare energia per il loro metabolismo. Allo stesso tempo, la glicemia, non può raggiungere concentrazioni troppo elevate altrimenti si andrebbe incontro a malattie come il diabete. Estremità riducente 1 C 4 1 C 4 1 -O O O Amilosio 0 Ramificazione H ÓH O O H H H 0,5OCH2 -O COO OH 0. 1 3 O H H H H