Stereoisomeria: proiezioni di Fischer, ciclopentani e cicloesani
Slide dall'Università San Raffaele Roma sulla stereoisomeria. La Pdf esplora le proiezioni di Fischer, la stereochimica di ciclopentani e cicloesani, e la pro-chiralità su carboni sp2, argomenti fondamentali della chimica organica a livello universitario.
Mostra di più14 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Università San Raffaele Roma
Professore Gilda Aiello
Argomento Stereoisomeria 2T
Università San Raffaele
Roma
Gilda Aiello
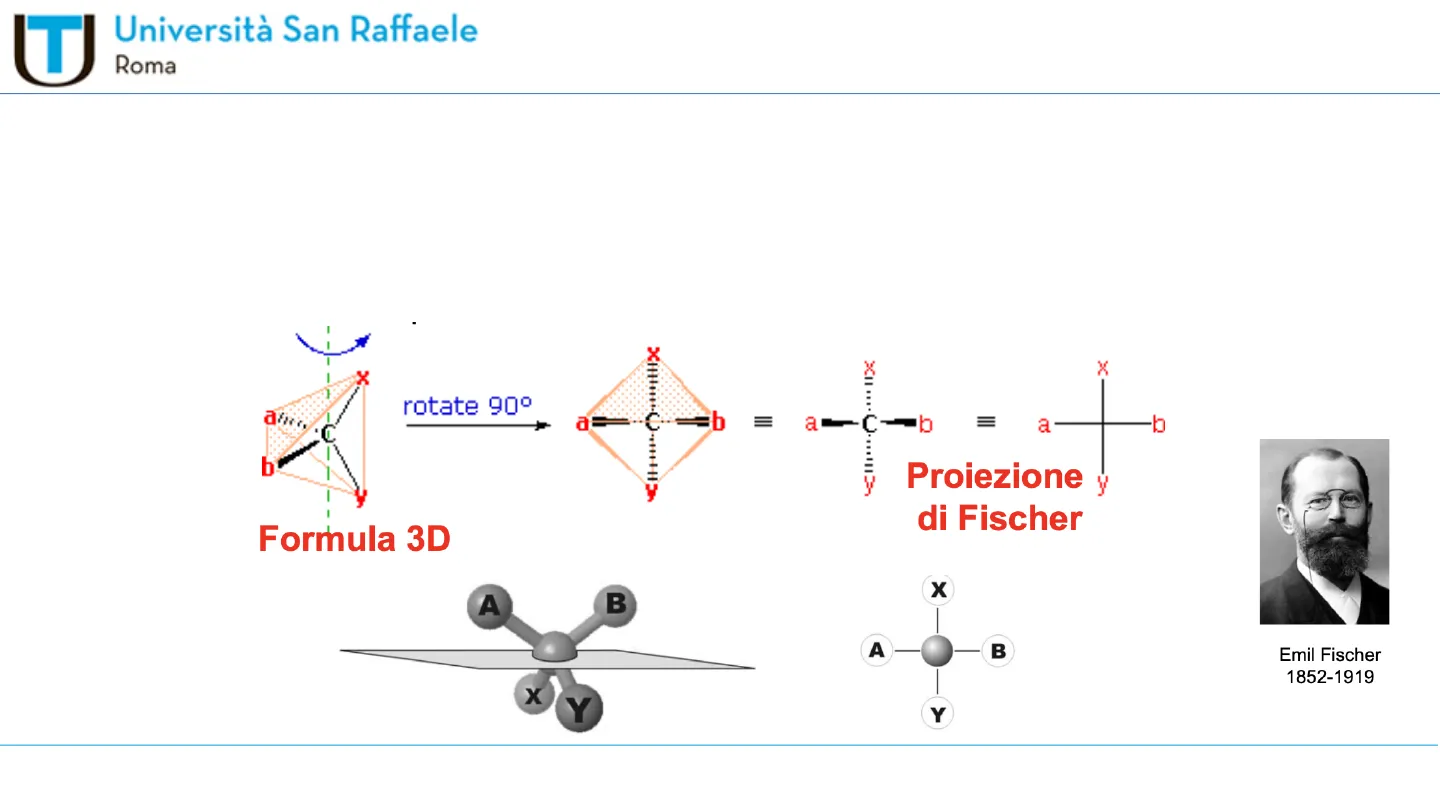
Proiezioni di Fischer (rappresentazione in due dimensioni)
La proiezione di Fischer è un modo convenzionale di rappresentare su un piano la struttura tridimensionale di una molecola chirale.
I quattro legami dell'atomo di carbonio chirale si intersecano in un punto che rappresenta il carbonio stesso.
. I due legami orizzontali si considerano diretti verso l'osservatore, i due legami verticali si considerano diretti
dietro il piano: è una convenzione.
rotate 90º
a
b
y
Proiezione
di Fischer
X
A
B
x
Y
X
X
a
-b
U ..
-C-
y
Formula 3D
A
B
Y
Emil Fischer
1852-1919
Stereoisomeria 2
2 di 14T
Proiezioni di Fischer: Carbonio Asimmetrico
Università San Raffaele
Roma
Gilda Aiello
Enantiomeri e Antipodi Ottici
carbonio
asimmetrico
I
enantiomeri
H Br
CI
o antipodi ottici
Br
TH
CI
modello spaziale (a cunei)
K
06
I
CI-Br
Br
CI orientamento secondo Fishe
H
H
CI-Br
H
Br-
CI
proiezione di Fisher
H
Stereoisomeria 2
3 di 14T
Regole per la manipolazione delle formule di Fischer: Rotazioni
Università San Raffaele
Roma
Gilda Aiello
- Una rotazione della formula di 180° nel
piano non comporta variazioni della
configurazione. - Una rotazione di 90° nel piano comporta
inversione di configurazione cioè si
ottiene l'enantiomero. - Ribaltando la formula rispetto al piano del
disegno (rotazione di di 180° sull'asse
verticale o orizzontale) si ottiene
l'enantiomero.
180°
a
C
d-
b = b-d
C
a
90°
a
d-
C
a
C
b
a
a
db = b-d
C
C
1
180°
C
180° -
C
a
b-
-
d-
-b
a
Stereoisomeria 2
4 di 14T
Regole per la manipolazione delle formule di Fischer: Scambi
Università San Raffaele
Roma
Gilda Aiello
- Scambiando una volta la posizione
reciproca di due sostituenti si ottiene
inversione di configurazione del centro
stesso cioè si ottiene l'enantiomero.
a
d
d
ab
C
C
- Scambiando due volte la posizione
reciproca di due sostituenti non si
osserva inversione di configurazione del
centro stesso.
a
d
b
d-
-b
a
b
ad
C
C
C
A
=
Stereoisomeria 2
5 di 14T
Assegnazione della configurazione assoluta mediante le proiezioni di Fischer
Università San Raffaele
Roma
Gilda Aiello
- Si disegna la molecola in proiezione di Fischer
- Si assegna la priorità ai gruppi.
- Si pone il gruppo 4 (a priorità minore) verso l'alto con una qualsiasi operazione di doppio
scambio. - Se gruppi 1,2 e 3 si susseguono ora in senso orario la configurazione assoluta è R, se in
senso antiorario la configurazione assoluta sarà S.
2
Et
3
Me
4
H
3 Me
H 4
Et
2
H
2 Et
Me 3
CI 4
CI
1
CI
1
1
configurazione R
Stereoisomeria 2
6 di 14T
Zuccheri e stereochimica
Università San Raffaele
Roma
Gilda Aiello
*
*
HOCH2-CH-CH-CH=O
OH OH
22=4
CHO
CHO
CHO
CHO
Hi OH
HO
i H
Hi OH
HOW H
I
H: OH
HOPAH
HOH
HOH
CH2OH
CH2OH
CH2OH
CH 2OH
A
B
C
D
Una coppia di enantiomeri
(eritrosio)
Una coppia di enantiomeri
(treosio)
Il suo diastereomero è il treosio.
A e B sono enantiomeri
C e D sono enantiomeri
A e C sono diastereoisomeri
A e D sono diastereoisomeri
B e C sono diastereoisomeri
B e D sono diastereoisomeri
Stereoisomeria 2
7 di 14T
Proprietà di simmetria e stereoisomeri
Università San Raffaele
Roma
Gilda Aiello
Certe molecole sono dotate di particolari proprietà di simmetria che riducono il numero di stereoisomeri ad
uno inferiore rispetto a quello previsto dalla regola 2n
Acido-2,3-diidrossisuccinico e Acido Tartarico
OH
Acido-2,3-diidrossisuccinico
COOH
HOOC
numero max di
stereoisomeri: 22=4
Acido tartarico
OH
COOH
COOH
COOH
H=
-OH
HOH
H-12-OH
HOSPH
H =!- OH
HO-2-H
HO -- H
H --- OH
COOH
COOH
COOH
COOH
A
B
c
D
Composto meso
o Mesoforma
Una coppia di enantiomeri
N.B .: I due C
asimmetrici
hanno lo
stesso set di
sostituenti!
A e B sono identici. Posseggono un piano di simmetria e quindi sono achirali.
C e D sono enantiomeri
Il numero di stereoisomeri è ridotto a 3
Stereoisomeria 2
8 di 14
Diastereoisomeri e mesoforme
COOH
₹(R)
(S)T
Università San Raffaele
Roma
Gilda Aiello
Eritrosio, Treosio e Acido Tartarico
(-) eritrosio
(+) eritrosio
acido meso tartarico
acido meso tartarico
CHO
CHO
COOH
COOH
H-OH
HO-+H
H -- OH
HO-
I
H-OH
HO-
I
H-OH
HO-H
CH2OH
CH2OH
COOH
COOH
CHO
CHO
COOH
COOH
HO-
-H
H-OH
H -- OH
HO-H
CH2OH
CH2OH
COOH
COOH
(-) treosio
(+) treosio
acido (+) tartarico
acido (-) tartarico
enantiomeri
enantiomeri
diastereoisomeri
diastereoisomeri
uguali
Il numero degli isomeri ottici possibili è 2" dove n rappresenta il numero di centri di
asimmetria non equivalenti (attenzione alle mesoforme!)
Stereoisomeria 2
9 di 14
Mesoforma Otticamente Inattiva
HO-H
H-+OH
H -- OH
HO-
-H
La forma meso è
otticamente inattiva
per compensazione
interna!T
Stereochimica e ciclopentani
Università San Raffaele
Roma
Gilda Aiello
OH
OH
OH
OH
OH
.OH
OH
OH
mesoforma
2 enantiomeri
mesoforma
2 enantiomeri
OH
OH
(R)
(S)
enantiomeri
'S)
-
OH
(R)OH
diastereoisomeri
uguali
-
OH
OH< />(R)
(S)
(R)
(S)
TIOH
OH
.
.
OH
OH
OH
OH
NH2
·"NH2
NH2
NH2
Esistono in 2 forme enantiomeriche
Stereoisomeria 2
10 di 14T
Stereochimica e cicloesani
Università San Raffaele
Roma
Gilda Aiello
OH
OH
OH
OH
NH2
NH2
NH2
NH2
Tutte queste molecole esistono sotto forma di coppie di enantiomeri
OH
OH
1
1
H2N
H2N
N.B: Queste molecole
sono ACHIRALI perché
hanno un piano di
simmetria!
Stereoisomeria 2
11 di 14T
Prochiralità su carboni sp2
Università San Raffaele
Roma
Gilda Aiello
Si dice che una molecola è
prochirale quando può essere
trasformata da achirale a chirale
attraverso un singolo passaggio
chimico.
2-Butanone e 2-Butanolo
0
OH
CH3-C-CH2CH3 - CH2-C-CH2CH3
H
2-Butanone
(Prochirale)
2-Butanolo
(Chirale)
Descrittori stereochimici: re e si
H
faccia re (senso orario)
I
1
1
O
3
2
H3C
CH2CH3
CH2CH3
1
faccia si (senso antiorario)
H3C -C-OH
-
H
(R)-2-Butanolo
Stereoisomeria 2
12 di 14
H3C-C-OH
(S)-2-Butanolo
CH2CH3
0T
Prochiralità su carboni sp3
Università San Raffaele
Roma
Gilda Aiello
Un atomo ibridizzato sp3 è
definito prochirale se cambiando
uno dei gruppi ad esso legato
l'atomo diviene un centro chirale.
Centro prochirale e chirale
Centro
prochirale
H
Centro
chirale
X
H3C-C-OH
-
H3C-C-OH
1
H
H
Etanolo
Atomi pro-R e Pro-S
Atomi pro-R e Pro-S: per distinguere i due idrogeni si immagina
una trasformazione che aumenti la priorità di un atomo rispetto
all'altro senza influenzare la sua priorità rispetto agli altri gruppi
legati
pro-R
pro-S
H
H
1
1
(S)
C
H&C
OH
H3C
OH
H3C
OH
Chirale
Chirale
Prochirale
2H
H
H
2H
C -(R)
0
Stereoisomeria 2
13 di 14T
Isomeri configurazionali
Università San Raffaele
Roma
Gilda Aiello
Composti differenti con la stessa formula molecolare
Isomeri di struttura (costituzionali)
Isomeri con un diverso ordine con cui sono
legati gli atomi nella molecole
Stereoisomeri
Isomeri con lo stesso ordine con cui sono
legati gli atomi nelle loro molecole ma con una
differente disposizione tridimensionale dei loro
atomi o gruppi di atomi nello spazio
Isomeri geometrici
Isomeri geometrici
cis/trans (E/Z)
Diastereoisomeri
Diastereoisomeri
Stereoisomeri le cui
molecole non sono l'una
l'immagine speculare
dell'altra
Enantiomeri
Enantiomeri
Stereoisomeri le cui
molecole sono l'una
l'immagine speculare
dell'altra
Stereoisomeria 2
14 di 14