Amminoacidi: proprietà chimiche, struttura e funzioni nelle proteine
Documento sugli Amminoacidi. Il Pdf, utile per lo studio universitario di Biologia, esplora in dettaglio gli amminoacidi, i costituenti fondamentali delle proteine, trattando proprietà chimiche, struttura, chiralità e classificazione.
Mostra di più15 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
AMMINOACIDI
le proteine mediano praticamente tutti i processi che hanno luogo nelle cellule e svolgono un numero enorme di funzioni le proteine sono le macromolecole biologiche PIÙ ABBONDANTI presentano tutti i tipi di cellule e in tutte le frazioni subcellulari la loro VARIETÀ è MOLTO GRANDE: in una sola cellula se ne possono trovare a migliaia di tipi diversi poichè la funzione moleocolare dipende dalle proteine esse possono essere considerate i PIÙ IMPORTANTI PRODOTTI FINALI sono gli strumenti molecolari mediante i quali si esprime l'informazione genetica unità monomeriche relativamente semplici sono alla base della struttura delle migliaia di differenti proteine: formate sempre dalla STESSA SERIE DI 20 AMMINOACIDI ogni amminoacido ha una catena laterale con specifiche proprietà chimica questi gruppi di 20 precursori è un ALFABETO con cui è scritto il linguaggio delle proteine le cellule sono in grado di proteine dotate delle più disparate proprietà e attività semplicemente unendo 20 amminoacidi in combinazioni differenti
AMMINOACIDI= unità costitutive con cui gli organismi possono generare prodotti molto diversi: enzimi, ormoni, anticorpi, trasportatori, fibre muscolari, piume, ragnatele ecc, gli enzimi sono i composti più vari e specializzati; catalizzatori di tutte le reazioni cellulari sono una chiave per la comprensione della chimica della vita
GLI AMMINOACIDI
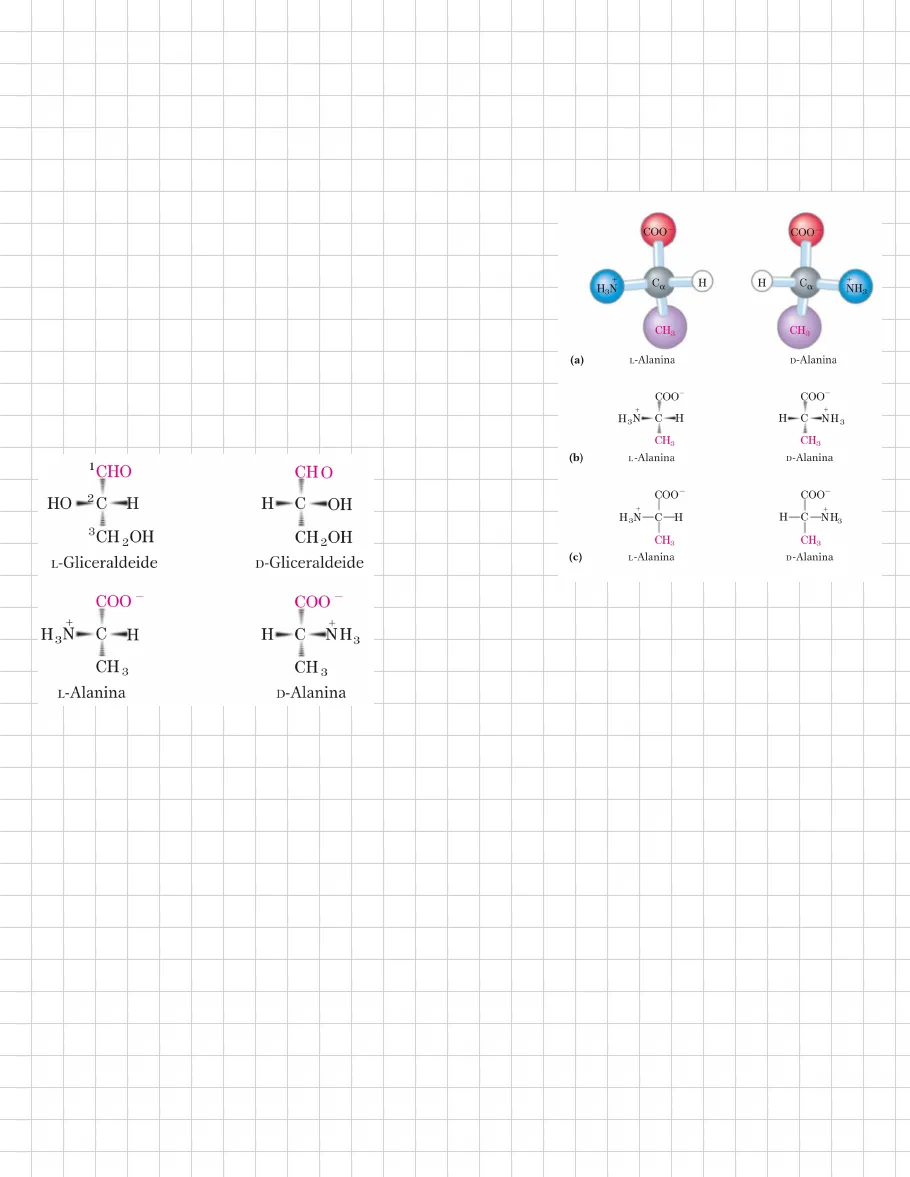
le proteine sono polimeri di AMMINOACIDI in cui OGNI RESIDUO AMMINOACIDICO è unito a quello vicino da uno specifico tipo di legame covalente residuo= sottolinea la perdita degli elementi di una molecola di acqua quando due amminoacidi si uniscono tutti gli amminoacidi sono a-AMMINOACIDI hanno un gruppo carbossilico e uno amminico legati allo stesso atomo di carbonio (a) e differiscono l'uno dall'altro per la CATENA LATERALE o GRUPPO R questa si differenzia per STRUTTURA, DIMENSIONE e CARICA influenzando la solubilità dell'amminoacido nell'acqua COO- + Ca H H3N R a ogni amminoacido è stata assegnata un'abbreviazione a 3 lettere e un simbolo a una lettera: utilizzati per indicare le sequenze e le composizioni in amminoacidi delle proteinein tutti i comuni amminoacidi, eccetto la glicina, il carbonio a è legato a 4 gruppi differenti: GRUPPO CRABOSSILICO, GRUPPI AMMINICO, GRUPPO R, ATOMO H è dunque un CENTRO CHIRALE a causa della disposizione tetraedrica degli orbitali di legame, i 4 gruppi possono disporsi nello spazio in 2 modi diversi: per ogni amminoacido sono possibili 2 STEREOISOMERI le due forme rappresentano due ENANTIOMERI sono tutte molecole OTTICAMENTE ATTIVE COO COO- + H3N Ca H H Ca + NH3 CH3 CH3 per specificare la CONFIGURAZIONE ASSOLUTA dei 4 sostituenti si utilizza il SISTEMA D, L (a) L-Alanina D-Alanina basato sulla configurazione assoluta dello zucchero a 3 atomi di carbonio ossia la gliceraldeide 1CHO CHO HO -2C-H H-C-OH + + H3N-C-H H-C-NH3 CH3 L-Alanina CH3 D-Alanina 3CH 2OH L-Gliceraldeide COO - H3N-C-H + COO - H-C-NH3 + CH 3 L-Alanina CH 3 D-Alanina Fischer sapeva quali erano i gruppi che circondavano il carbonio asimmetrico ma poteva solo supporre la configurazione assoluta: analisi a diffrazione dei raggi S dei composti cristallini hanno poi confermato le previsioni di Fischer per tutti i composti chirali:
- stereoisomeri hanno configurazioni rcorrelate alla L-gliceraldeide sono designati con la lettera L
- stereoisomeri hanno configurazioni rcorrelate alla D-gliceraldeide sono designati con la lettera D
storicamente una nomnclatura simile a D e L era usata per indicare l'attività ottica delle molecole levigire e destrogire NON TUTTI GLI L-AMMINOACIDI SONO LEVOGIRI nella convenzione di Fisher, L e D si riferiscono SOLTANTO la configurazione assoluta dei 4 sostituenti attorno al carbonio chirale e non alle proprietà ottiche della molecola un altro sistema per la configurazione è quello RS, usato nella nomenclatura sistematica della chimica organica + H3N-C-H CH3 H-C-NH3 CH3 (b) L-Alanina D-Alanina COO- COO CH 2OH D-Gliceraldeide (c) COO COOquasi tutti i composti biologici con un centro chitare sono presenti in natura SOLTANTO in UNA FORMA STEREOISOMERICA L o D i residui degli AMMINOACIDI nelle molecole proteiche sono tutti STEREOSIOMERI L gli amminoacidi della serie D sono presenti in pochissimi peptidi, solitamente piccoli, come quelli della parete cellulare di batteri e in qualche protide di antibiotico quando nelle reazioni chimiche ordinarie su formano composti chiari si ottiene sempre una miscela racemica contenente isomeri L e D, sono difficilmente distinguibili e separabili, mentre negli organismi viventi gli isomeri D e L sono DIVERSI la formazione di strutture STABILI e RIPETITIVE come le proteine richiede che gli amminoacidi APPARTENGANO TUTTI ALLA STESSA SERIE STEREOCHIMICA le cellule sono in grado di sintetizzare specificatamente l'isomero L degli amminoacidi in quanto i siti attivi degli enzimi sono ASIMMETRICI e le reazioni che essi catalizzano sono STEREOSPECIFICHE
CLASSIFICA AMMINOACIDI IN BASE AL GRUPPO R
le proprietà chimiche degli amminoacidi sono essenziali per lo studio della biochimica set 20 amminoacidi sono stati selezionati nella storia vivente per disposizione di gruppi chimici adatti per formare la struttura definita delle proteine amminoacidi sono fondamentali per due motivi principalmente
- danno la struttura alle proteine con le loro proprietà
- sono degli intermedi metabolici es METIONINA permette la metilaizione valenza ENERGETICA e BIOSINTETICA possono essere raggruppati in 5 classi principali sulla base delle proprietà dei gruppi R utilizzando la loro POLARITÀ ossia la tendenza a interagire con l'acqua a PH fisiologico intorno a pH 7 i gruppi R hanno una polarità molto variabile da quelli non polari e idrofobici, insolubili in acqua fino a quelli altamente polari e idrofilici, solubili in acqua alcuni amminoacidi come la GLICINA, ISTIDINA, CISTEINA sono difficilmente caratterizzak o non si adattano bene a nessun gruppo; sono stati assegnati a determinati gruppi in base ragionamenti piuttosto che criteri assoluti all'interni di ciascun gruppo si trovano amminoacidi con diverse gradazioni di polarità, grandezza e forma dei gruppi R
GRUPPI R ALIFATICI NON POLARI
i gruppi R di questa classe di amminoacidi sono non polari e quindi IDROFIBICI
- GLICINA ha la struttura più semplice e anche se è collocabile nel gruppo degli amminoacidi non polari, la sua minuscola catena laterale (H) non contribuisce alla formazione di interazioni idrofobiche COO- H3N-C-H H CH 3 1 poco idragobica H2C CH2 degli altri O gruppi Alanina Prolina ramificata Valina pienamente solubile in acqua: utilizzata nei tamponi COO COO COO + H3N-C-H H3N-C-H H3N-C-H CH2 H-C-CH3 CH2 -. ramificati CH CH2 CH3 CH2 CH3 CH3 S La put voiroggibicas CH3 Leucina ibcmarzo dauer + Isoleucina Metionina l'alanina anche è solubile in acqua, ha un minore carattere idrofobico quindi si può ritrovare sia sulla superficie della proteina che nel core idrofobico della proteina ha un gruppo idrofobico ma piccolo quindi vince la polarità degli altri gruppi solo quando la catena laterale diventa grande l'interazione con l'acqua diventa complicata VALINA, LEUCINA E ISOLEUCINA sono RAMIFICATI: sono importanti perchè quando si ripiega questi finiscono nel core idrofobico della catena e avendo catene alifatiche la libertà CONFORMAZIONALE è molto elevata, intorno a ciascun legame ha libera rotazione può trovare una giusta geometria per un impiccamento più stretto
- METIONINA, ha un gruppo tioestere non polare nella sua catena laterale permette di formare legami a idrogeno è un buon legante per ioni metallici: Citocromo C è un trasportatore di elettroni lo ione ferro legato da un residuo di metilnina e istidina: ciò tiene sotto controllo il metallo per agire al citocromo C in maniera corretta come accettore e donatore dal complesso 3 al complesso 4 ha un atomo di S che è più elettronegativa e ha un surplus di carica negativa che permette di fare interazioni con molecole d'acqua quindi non è spiccatamente a polare C H3N-C-H + H2N CH2 CH 6 CH3 CH3 Propilico con catena le catene laterali di ALANINA, VALINA,
- LEUCINA e ISOLEUCINA tendono a raggrupparsi all'interno delle proteine stabilizzando la struttura proteica tramite INTERAZIONI IDROFOBICHE catena laterale nonpolare Glicina Gruppi R alifatici, non polari solo gruppo COO COO libero COO H + + H3N-C-Hi metalli permettono di portare avanti reazioni che gli amminoacidi non possono portare avanti, le proteine devono essere STABILI se reagiscono velocemente potrebbero avere reazioni indesiderate reazione redox fondamentali: i metalli di transizione che possono trovarsi tra diversi stati di ossidazioni sono COFATTORI degli enzimi perché facilitano tali reazioni ma in modo controllato perchè vengono legati con una proteine in un determinato sito attivo dell'enzima i metalli ARRICCHISCONO la CHIMICA DELLE PROTEINE la maggior parte di quelli idrofobico sono ESSENZIALI= non in grado dinsintetizzarli ma vanno introdotti con la dieta
- PROLINA ha una catena laterale alifatica con una caratteristica struttura ciclica il gruppo amminico secondario (imminico) dei residui di prolina è mantenuto in una conformazione rigida che riduce la flessibilità strutturale delle regioni polipeptidiche in cui è presente la prolina catena enterale ciclizzata - no libera rotazione geometria che impone un ripiegamento della catena polipeptidica: ripiegamento dei foglietti ß
GRUPPI R AROMATICI
Gruppi R aromatici COO COO COO + + + H3N-C-H H3N-C-H H3N-C-H CH2 CH2 CH2 C=CH endolo NH gruppo polare OH Fenilalanina Tirosina Triptofano ha proprietà ilariole: Accettare e donatore i tre amminoacidi FENILANINA, TIROSINA E TRIPTOFANO con le loro catene laterali sono NON POLARI ossia idrofobici tutti e 3 possono intervenire nelle interazioni idrofobiche
- il gruppo ossidrilico della tirosina può formare legami a idrogeno ed è un gruppo funzionale importante in alcuni enzimi può avere un carattere idrofobico, polare con il gruppo ossidrile o anionico in condizioni in cui OH è deprotonati la tirosina è il triptofano sono sensibilmente più polari della fenilanina per la presenza del gruppo ossidrilico nella tirosina e dell'atomo di azoto nell'anello idrolico del triptofano