Proteine: struttura e funzione, con focus su eme e mioglobina
Slide dall'Università San Raffaele su Proteine: struttura e funzione. Il Pdf, pensato per studenti universitari di Biologia, esplora gli amminoacidi, la struttura primaria delle proteine, l'eme e il suo ruolo, e la mioglobina con le sue funzioni di serbatoio e trasportatore di ossigeno.
See more39 Pages

Unlock the full PDF for free
Sign up to get full access to the document and start transforming it with AI.
Preview
Università San Raffaele Roma
Docente Sara Baldelli
Lezione Proteine struttura e funzioneU Università San Raffaele Roma Sara Baldelli
Proteine
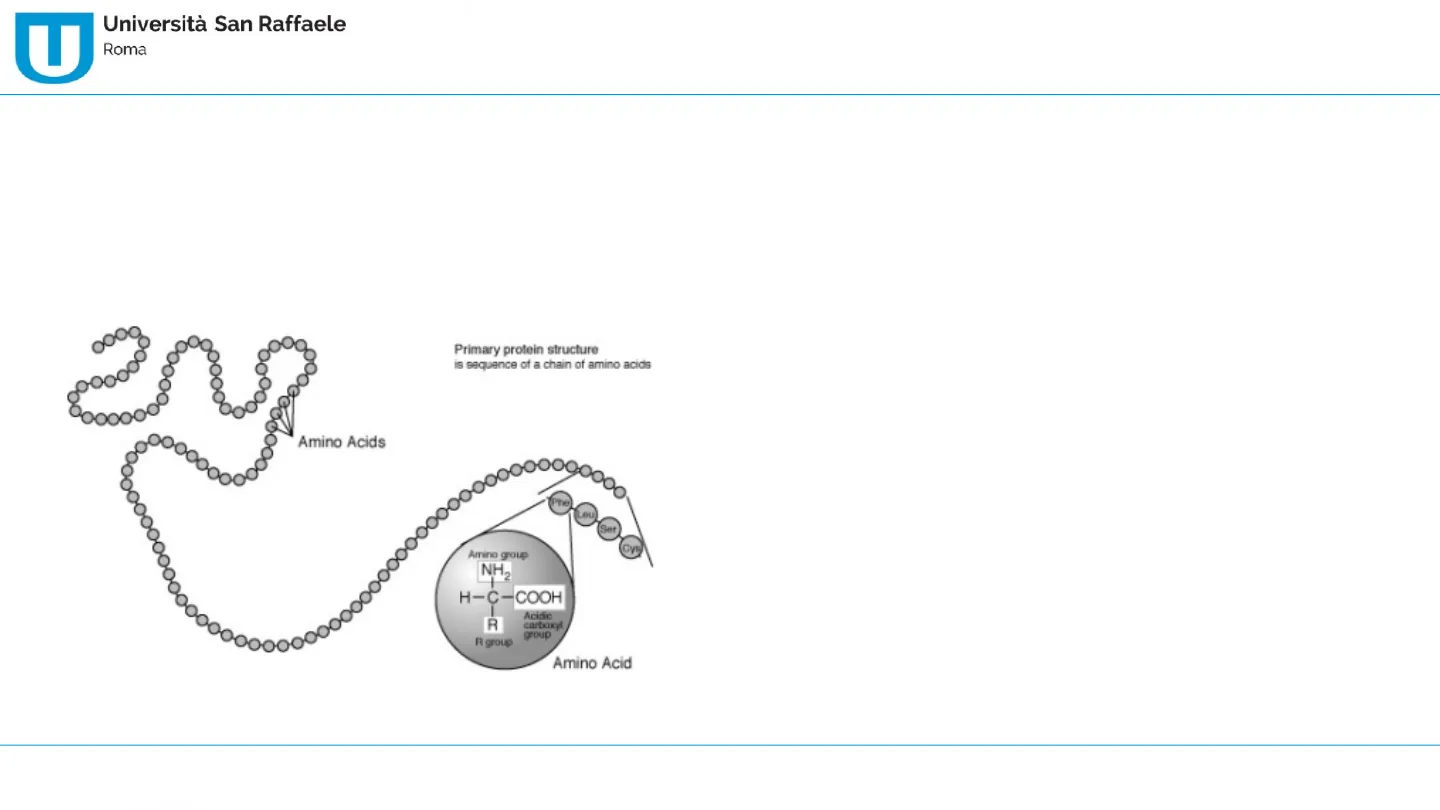
Amino Acids
Primary protein structure is sequence of a chain of amino acids Phe Lou Ser CV Amino group NH2 H-C-COOH Acidic R group R group Amino Acid
LE PROTEINE SONO DEI POLIMERI LE CUI UNITA' RIPETITIVE SONO GLI -AMMINO ACIDI: ogni proteina possiede una propria struttura, da cui dipende la specifica funzione.
Proteine struttura e funzione 2 di 39U Università San Raffaele Roma Sara Baldelli
AA e proteine
- Le proteine rappresentano gli elementi strutturali e funzionali più importanti dei sistemi viventi. Svolgono un'ampia varietà di funzioni. Sono sintetizzate come una sequenza di amminoacidi uniti in una struttura polimerica;
- Esistono ca 300 amminoacidi in natura; solo 20 di essi sono codificati dal DNA e sono incorporati nelle proteine (amminoacidi proteici)
Proteine struttura e funzione 3 di 39U Università San Raffaele Roma Sara Baldelli
AA
Ogni amminoacido possiede un carbonio centrale detto a, al quale sono legati 4 gruppi: - gruppo amminico basico -NH2 (o anche -NH3 +) - gruppo carbossilico acido -COOH (o anche -COO- ) - un atomo di H - una catena laterale R diversa per ciascun amminoacido COO- + H3N-C-H I R
Proteine struttura e funzione 4 di 39U Università San Raffaele Roma Sara Baldelli
Legame peptidico
- Le proteine si formano dall'unione di amminoacidi legati con legame peptidico (legame ammidico);
- Il legame peptidico si realizza mediante condensazione del gruppo carbossilico -COOH del primo amminoacido col gruppo amminico (NH2) del secondo amminoacido con eliminazione di una molecola d'acqua. R1 - H R2 H3N-CH-C-OH + H-N-CH-COO" + = Ö H2O > H2O R1 1 H R2 H3N-CH-C-N -- CH-COO" 0
Proteine struttura e funzione 5 di 39U Università San Raffaele Roma Sara Baldelli
Legame peptidico
R1 R1 H R2 I + H3N-C-COO- + H3N-C-COO- + H3N-C-C-N-C-COO- = I H carbossi- terminale H R2 H H2O 1 I + I ammino- terminale HO legame peptidico Reazione di condensazione con eliminazione di una molecola di H2O
Proteine struttura e funzione 6 di 39U Università San Raffaele Roma Sara Baldelli
Legame peptidico
OH CH3 CH3 CH I CH2OH H H H CH2 H CH3 H CH2 I I I H 0 H O HO HO H Estremità amminoterminale Estremità carbossiterminale
Proteine struttura e funzione 7 di 39 + H3N-C-C-N -- C-C-N -- C-C-N -- C-C-N -- C-COO" 1U Università San Raffaele Roma Sara Baldelli
Funzioni delle proteine
- La composizione in amminoacidi di una proteina influenza le proprietà chimico-fisiche della proteina stessa;
- Amminoacidi non polari (idrofobi) renderanno la proteina poco solubile in H2O. Infatti, nelle proteine di membrana, gli amminoacidi non polari saranno concentrati nei segmenti di proteina che attraversano le membrane;
- In proteine solubili, gli amminoacidi polari saranno presenti sulla superficie mentre gli amminoacidi non polari saranno confinati all'interno della proteina.
Proteine struttura e funzione 8 di 39U Università San Raffaele Roma Sara Baldelli
Struttura Tridimensionale delle proteine
Struttura primaria Struttura quaternaria Pro Ala Asp Lys Thr Struttura secondaria Struttura terziaria Asn Val Lys Ala Ala Trp Gly Lys & Elica Val Residui amminoacidici Catena polipeptidica Subunità associate
Proteine struttura e funzione 9 di 39U Università San Raffaele Roma Sara Baldelli
Struttura primaria
- E' rappresentata dalla sequenza amminoacidica, per es: H2N- Met-Ala-Ala-Gly-Tyr-Trp-GIn-Ala-COOH;
- Tale ordine è determinato dalla sequenza polinucleotidica del DNA del gene corrispondente. Molte malattie genetiche sono dovute alla sintesi di proteine con una sequenza amminoacidica alterata. Sequenza ammino- acidica (proteina) Sequenza del DNA (gene) Gln -Tyr-Pro-Thr-Ile -Trp CAGTATCCTACGATTTGG
Proteine struttura e funzione 10 di 39U Università San Raffaele Roma Sara Baldelli
Struttura Tridimensionale
Necessaria per l'attività biologica La conformazione delle proteine è dovuta alla formazione di legami non covalenti che tengono ripiegate alcune parti di un polipeptide: struttura secondaria e terziaria.
Proteine struttura e funzione 11 di 39U Università San Raffaele Roma Sara Baldelli
Struttura secondaria
- E' rappresentata dalla conformazione assunta da porzioni dello scheletro polipeptidico;
- Può essere: alpha-elica o foglietto-beta;
- Legame stabilizzante: legame a H tra CO e NH dei legami peptidici.
Proteine struttura e funzione 12 di 39U Università San Raffaele Roma Sara Baldelli
Struttura secondaria
- Si riferisce alla conformazione locale della catena polipeptidica.
- E' determinata da interazioni di tipo legame a idrogeno fra l'ossigeno di un gruppo carbonilico del legame peptidico e l'idrogeno del gruppo ammidico di un altro legame peptidico.
- Esistono due tipi di strutture secondarie: l' a-elica ed il foglietto b.
Proteine struttura e funzione 13 di 39U Università San Raffaele Roma Sara Baldelli
Struttura secondaria
alpha-elica
ponte-H ogni 3,6 aminoacidi Il legame H si instaura tra l'H dell'azoto amidico e l'O del gruppo carbonilico residui esterni alla spirale.
beta-foglietto
legami idrogeno fra aminoacidi di catene diverse foglietto piegato R amino acid side chain R nitrogen carbon R R R R R H bond R R L hydrogen oxygen R R R 1 1.39 nm
Proteine struttura e funzione 14 di 39 G R R R peptide bondU Università San Raffaele Roma Sara Baldelli
Struttura terziaria
La struttura terziaria è la conformazione tridimensionale assunta da una proteina. È stabilizzata da legami non covalenti come ponti idrogeno, interazioni idrofobiche tra amminoacidi non polari e legami ionici ma anche da legami covalenti. Ciò è indispensabile per la sua attività biologica CAPITOLO 1 Amminoacidi e proteine Ripiegamento ₿ Foglietto ₿ 00 Regione ad anello a elica
Proteine struttura e funzione 15 di 39U Università San Raffaele Roma Sara Baldelli
Struttura terziaria
- E' la struttura tridimensionale dell'intero polipeptide
- Le interazioni tra i gruppi laterali degli amminoacidi, anche distanti nella sequenza, provocano un ripiegamento della catena polipeptidica
- Legami stabilizzanti: interazioni tra le catene laterali che causano il ripiegamento degli elementi di struttura secondaria presenti nel polipeptide.
Proteine struttura e funzione 16 di 39U Università San Raffaele Roma Sara Baldelli
Struttura terziaria
I gruppi laterali R instaurano interazioni deboli:
- 1. Legami ionici se un gruppo con carica negativa interagisce con un gruppo di carica positiva
- 2. Legami idrogeno
- 3. Interazioni di van der Waals tra i gruppi idrofobici laterali degli amminoacidi apolari; queste interazioni sono molto deboli ma importanti in quanto gli amminoacidi idrofobici si dispongono all'interno della proteina, contribuendo al suo ripiegamento in ambiente acquoso
- Legame disolfuro (detto ponte disolfuro -S-S-) (legame covalente) che si forma per ossidazione dei gruppi -SH di due cisteine che in seguito al ripiegamento della proteina si trovano vicine
Proteine struttura e funzione 17 di 39U Università San Raffaele Roma Sara Baldelli
COO- COO" T T + H3N-C-H T H3N-C-H T CH2 CH2 SH 2H++2e A S T cistina SH I Ş 2H++ 2e- CH2 cisteina H-C-NH3 T COO" CH2 H-C-NH3 COO" + cisteina I legami disolfuro sono solitamente formati dall'ossidazione di gruppi sulfidrilici (-SH), specialmente in contesti biologici
Proteine struttura e funzione 18 di 39U Università San Raffaele Roma Sara Baldelli
Struttura terziaria
1e NH3 CH2 O-H legami ad H CH2 ponti salini e (CH2), NHO CH interazioni CH3 idrofobiche CH3 8 ponti disolfuro $ CH2 CH2 Interazioni con Il solvanta BOH 8 Rappresentazione della struttura terziaria di una proteina (mioglobina) con i vari tipi di interazioni che la stabilizzano
Proteine struttura e funzione 19 di 39U Università San Raffaele Roma Sara Baldelli
Struttura terziaria di una protein chinasi
Dominio proteico: parte di una catena polipeptidica che si può ripiegare indipendentemente in una struttura compatta stabile. 2 domini con funzioni regolatorie 2 domini con funzioni catalitiche dominio SH3 piccolo dominio chinasico N ATP C (A) dominio 8H2 grosso dominio chinasico (B)
Proteine struttura e funzione 20 di 39U Università San Raffaele Roma Sara Baldelli
Struttura quaternaria
- Molte proteine sono costituite da una sola catena polipeptidica (proteine monomeriche).
- Alcune proteine sono costituite da 2 o più catene polipeptidiche (subunità) strutturalmente identiche o diverse (proteine multimeriche).
- L'associazione di queste subunità costituisce la struttura quaternaria.
- Le subunità sono tenute insieme da interazioni non covalenti. SEZIONE Legame idrogeno (interazione non covalente) Subunità II Subunità I Subunità IV Subunità III
Proteine struttura e funzione 21 di 39U Università San Raffaele Roma Sara Baldelli
Struttura quaternaria
- E' presente nelle proteine costituite da più di una catena polipeptidica, ciascuna detta subunità
- Le proteine costuituite da 1, 2, 3 o più subunità sono dette monomeriche, dimeriche, trimeriche, oligomeriche, polimeriche
- Legami: Interazioni tra le subunità
Proteine struttura e funzione 22 di 39U Università San Raffaele Roma Sara Baldelli
Struttura quaternaria
C N Z C C 2. N c Struttura quaternaria di una proteina tetramerica con 4 subunità
Proteine struttura e funzione 23 di 39U Università San Raffaele Roma Sara Baldelli
Emoglobina (Hb)
- L' Hb è una proteina legante l'O2 che si trova esclusivamente nei globuli rossi (GR, o eritrociti)
- La sua funzione principale è di trasportare l'O2 dai polmoni ai tessuti
- Ogni GR contiene ca 300x106 molecole di Hb
- I GR hanno una vita media di 120 giorni
Proteine struttura e funzione 24 di 39U Università San Raffaele Roma Sara Baldelli
Emoglobina (Hb)
N-terminale C-terminale B2 F A H D D A E G E B B E D H A F A F C-terminale N-terminale Mioglobina Emoglobina E' costituita da 4 subunità, 2 di tipo a (141 aa) e 2 di tipo ß (146 aa), molto simili fra di loro e simili anche alla Mb
Proteine struttura e funzione 25 di 39 C G G 4U Università San Raffaele Roma Sara Baldelli
Emoglobina (Hb)
- Ciascuna subunità dell' Hb contiene un gruppo eme legato covalentemente. Ciascun eme con il suo ione Fe2+ può legare una molecola di O2
- L' ossigenazione risulta in un cambiamento di colore da rosso scuro a rosso scarlatto, responsabile della differenza di colore fra sangue venoso e arterioso.
Proteine struttura e funzione 26 di 39