Amminoacidi, proteine e vitamine: struttura e metabolismo
Documento da Università su Lezione 1 Amminoacidi e Proteine. Il Pdf, un insieme di appunti di Biologia, esplora la struttura e il metabolismo delle proteine, degli amminoacidi e delle vitamine, con riferimenti a video utili per approfondire gli argomenti trattati.
Mostra di più18 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Amminoacidi e Proteine
Le proteine sono le molecole più abbondanti e funzionalmente diversificate dei sistemi viventi: qualsiasi processo vitale dipende da questa classe di macromolecole. Pur essendo estremamente diversificate tra loro esse condividono una specifica caratteristica strutturale per la quale sono tutte polimeri di aminoacidi.
Struttura di un amminoacido
Struttura di un amminoacido : ogni amminoacido possiede un atomo di C alpha centrale legato a 4 gruppi:
- gruppo amminico
- gruppo carbossilico
- atomo di idrogeno
- catena laterale ( diversa per ciascun amminoacido, indicata con -R)
H - H2N - C -COOH 1 R
Classificazione degli amminoacidi
Da un punto di vista nutrizionale gli amminoacidi si possono classificare in :
- Essenziali : la specie non è in grado di sintetizzarli autonomamente; devono essere introdotti con la dieta.
- Non essenziali: amminoacidi che una determinata specie può sintetizzare
Dal punto di vista biochimico prossimo invece classificarli in:
- glucogenici: amminoacidi dal cui catabolismo otteniamo acido piruvico o un intermedio del ciclo di Krebs e che quindi possono essere utilizzati per riformare glucosio
- chetogenici: amminoacidi dal cui catabolismo otteniamo acetilCoA o acetoacetilCoA, che quindi non possono essere utilizzati per riformare glucosio
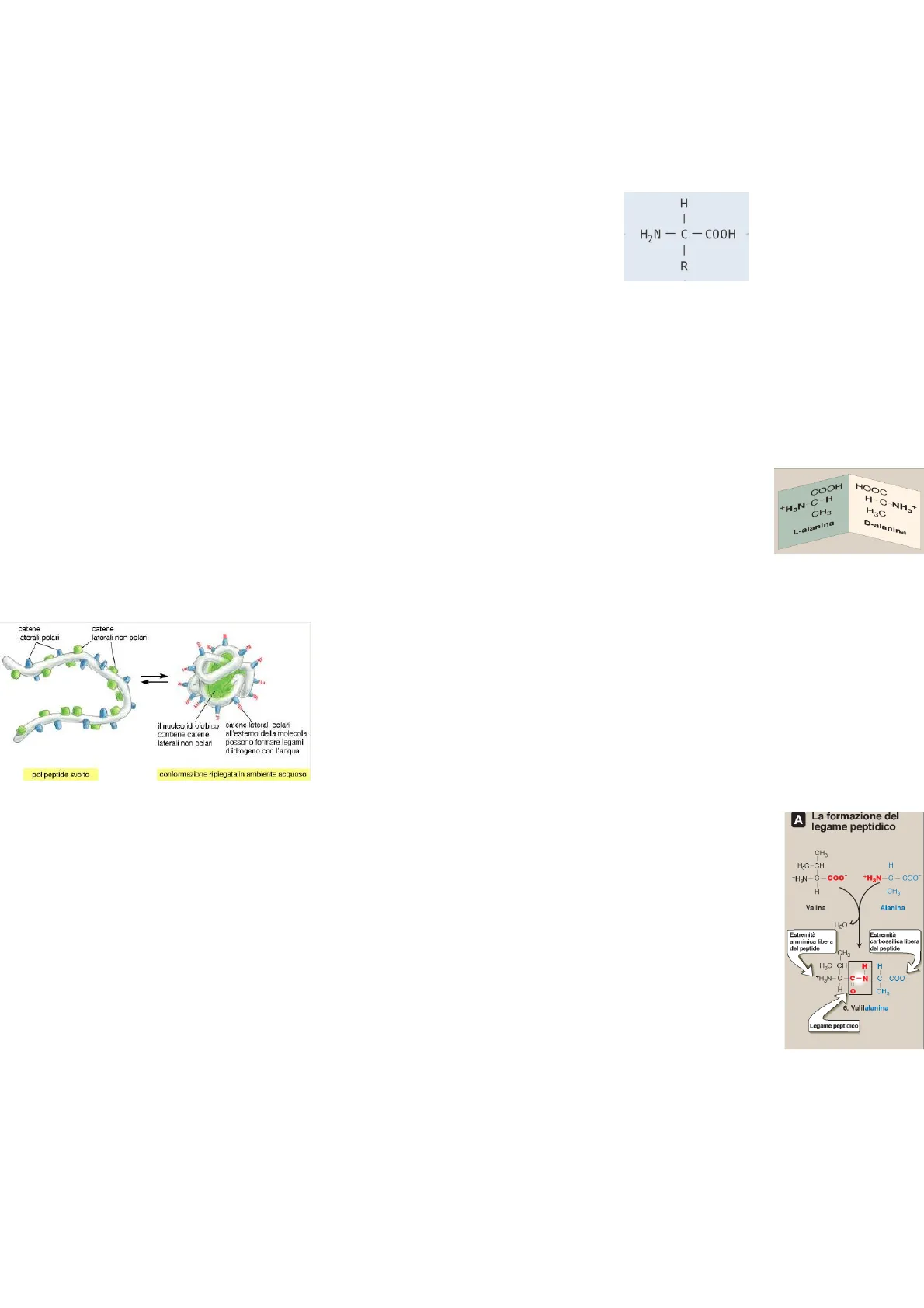
Il carbonio Alfa degli aminoacidi è legato quindi ai 4 gruppi chimici prima visti, ed è definito simmetrico, assumendo il nome di atomo di carbonio chirale o otticamente attivo. Gli aminoacidi possono esistere in natura in due forme speculari indicate con le lettere D e L. le due forme si definiscono stereoisomeri, isomeri ottici o enantiomeri. tutti gli aminoacidi che formano le proteine si trovano obbligatoriamente nella configurazione L.
catene laterali polari catene laterali non polari il nucleo idrofobico catene laterali polari contiene catene laterali non polari all'estero della molecola possono formare legami d'idrogeno con l'acqua polipeptide svolto conformazione ripiegata in ambiente acquoso
Gli aminoacidi possono essere classificati in base alle proprietà delle loro catene laterali (R) e il base (conseguentemente) alla loro polarità o meno e quindi la loro tendenza a interagire con l'acqua. Sono quindi spesso proprio i gruppi funzionali delle catene laterali a determinare la struttura, le funzioni e la carica elettrica delle proteine. Ad esempio, gli aminoacidi con catene laterali cariche, idrofiliche, sono generalmente posti sulla superficie delle proteine mentre quelli con residui idrofobici, non polari, si trovano in genere all'interno delle stessa, protette dall'acqua grazie al resto della struttura.
Sebbene in natura esistano numerosi amminoacidi soltanto 20 sono incorporati nelle proteine dei mammiferi, poiché sono quelli specificati dal codice genetico, (codice utilizzato dalla cellula per tradurre le informazioni contenute nei suoi geni nelle sequenze di aminoacidi che vanno a costituire poi le proteine). Possiamo quindi dare come definizione di proteina, una macromolecola costituita dall'unione di numerose unità elementari: gli L-amminoacidi. Essi sono uniti l'uno all'altro da legami peptidici che si formano tra il gruppo carbossilico di un aminoacido e il gruppo amminico di un altro, determinando anche un estremità libera del peptide amminica e una carbossilica. Tali legami sono definiti come resistenti e non si rompono anche se esposti a condizioni che di per sé denaturano le proteine complessive. La sequenza lineare degli amminoacidi, contiene l'informazione necessaria a generare una molecola proteica con una forma tridimensionale esclusiva, e codifica anche il ruolo specifico che va a ricoprire tra i molteplici possibili. Tra i ruoli principali delle proteine troviamo:
- componenti strutturali ( collagene, t. connettivo, citoscheletro)
- trasportatori
- trasmettitori di messaggi
- catalizzatori di reazioni
- difesa contro i patogeni
- controllo e regolazione dell'espressione genica
- deposito di materiale
A La formazione del legame peptidico CH H3C-CH H +H3N-C -COO" +H3N-C - COO H CH Valina Alanina H2O Estremità amminica libera del peptide Estremità carbossilica libera del peptide CH H3C-CH H I- +H3N-C C-N C-COO 0 CH3 6. Valilalanina Legame peptidico COOH +H3N-C-H CH3 HOOC H-C-NH3+ H&C L-alanina D-alanina
Livelli di organizzazione delle proteine
Per capire nel complesso la struttura delle proteine è opportuno considerare i quattro livelli di organizzazione di queste molecole, che vanno quindi a formare una struttura primaria, secondaria, terziaria e quaternaria.
la struttura primaria è definita dalla sequenza degli aminoacidi che si susseguono e che vanno a formare il polipeptide.
Primary structure Secondary structure Tertiary structure Quaternary structure Lys Lya Gly Val Ala His Amino acid residues a Helix Polypeptide chain Assembled subunits
la struttura secondaria è quella responsabile della conformazione che assume la catena polipeptidica. In questo contesto le eliche Alpha e i foglietti beta rappresentano esempi di strutture secondarie comunemente riscontrabili. Le eliche Alfa consistono in uno scheletro polipeptidico con uno stretto avvitamento dal quale si estendono, verso l'esterno rispetto all'asse centrale, le catene laterali degli amminoacidi; i foglietti beta invece sono un tipo di struttura nel quale troviamo solitamente due o più catene polipeptidiche unite da legami H, con una superficie definita pieghettata dove la catena polipeptidica risulta quasi completamente distesa.
Per quanto riguarda la struttura terziaria, essa origina dal ripiegamento nello spazio della catena polipeptidica, che assume nel complesso una struttura tridimensionale. Essa, che appare d'istinto come un groviglio casuale, è in realtà è predeterminata e dipende dalla struttura primaria.
La quaternaria, non è presente in tutte le proteine, ma la troviamo in casi di associazione di più subunità polipeptidiche tra loro; forma quindi il complesso dell'unione di quelli che singolarmente vengono definiti domini.
È importante ricordare che le proteine sono molecole dinamiche e possono cambiare conformazione quando si legano ad altre molecole. (la cellula è in grado di regolare la propria funzione/ metabolismo modificando la conformazione di proteine già esistenti)
Classificazione delle proteine
Le proteine possono essere classificate secondo vari criteri. Una prima divisione è in :
- semplici : proteine composte solo da amminoacidi, senza l'aggiunta di altri gruppi chimici
- coniugate: la catena amminica che compone la proteina è affiancata anche da gruppi chimici funzionali permanentemente associati. Questa parte della proteina non aminoacido viene definita gruppo prostetico
Conjugated Proteins Class Prosthetic group(s) Example Lipoproteins Lipids Glycoproteins Carbohydrates B1-Lipoprotein of blood Immunoglobulin G Phosphoproteins Phosphate groups Casein of milk
una seconda classificazione può essere invece la divisione in:
- globulari : si presentano solitamente di forma sferica; sono caratterizzate dalla loro solubilità in acqua ed assolvono prevalentemente nell'organismo funzioni biologiche (enzimi, ormoni, proteine di trasporto o di deposito)
- fibrose: si caratterizzano dalla disposizione delle catene polipeptidiche in lunghi fasci o in foglietti. al contrario delle precedenti, a causa della grande quantità di aminoacidi idrofobici che le compongono, sono insolubili in acqua. Le catene polipeptidiche che le compongono si associano proprio per questo in complessi sovra molecolari in modo da nascondere al solvente le superfici idrofobe. svolgono principalmente ruoli strutturali (la cheratina e il collagene).
Le Vitamine
Diete costituite solo da macronutrienti non permettono una crescita uno sviluppo ottimale dell'organismo che, anche se in quantità minori, richiede fattori di crescita accessori, come minerali e vitamine, che nel complesso costituiscono il gruppo dei micronutrienti. Le vitamine sono composti organici essenziali coinvolti nelle funzioni fondamentali dell'organismo, che non possono essere sintetizzati dagli esseri umani in quantità adeguate al fabbisogno e quindi devono essere recuperati attraverso gli alimenti. Ne esistono di diverso tipo e funzionano come unità individuali il cui compito varia dall' essere regolatori di reazioni in ambito di metabolismo energetico (ruolo di coenzimi), ad occupare ruoli di trasferimento di atomi o gruppi, all'essere ormoni o antiossidanti. Per quanto riguarda la classificazione delle vitamine, possono essere divise in 2 principali sottogruppi basati su una differenza di solubilità delle stesse; fattore che influenza come esse vengono assorbite, trasportate e conservate:
- vitamine liposolubili: in questo gruppo rientrano 4 vitamine ( A,D,K,E). Vengono rilasciate assorbite e trasportate insieme ai grassi ingeriti con la dieta. Hanno un tasso di efficienza di assorbimento variabile tra il 40 e il 90%, regolato dalla necessità delle stesse all'interno dell' organismo ( + bisogno = + velocità assorbimento). Queste vitamine non sono escrete rapidamente ma si accumulano in grandi quantità significative nel fegato, che ha il compito di conservarle e indirizzarle successivamente a cellule che ne hanno necessità. essendo appunto vitamine che si accumulano, e non si dissolvono in acqua, è possibile che l'eccessiva assunzione di dosi di queste vitamine porti all'accumulo di quantità tossiche per l'organismo.
- vitamine idrosolubili : gruppo composto da 9 vitamine. essendo queste solubili in ambienti acquosi, tipicamente non vengono conservate ed è importante che la loro dose sia adeguata e giornaliera. per lo stesso motivo la tossicità associata alla supplementazione della dose è estremamente rara, mentre è molto più frequente riscontrare la carenza delle stesse. contrariamente alle vitamine liposolubili (eccetto per la k), quasi tutte le vitamine idrosolubili sono precursori di coenzimi utilizzati poi dagli enzimi in alcune tappe di vie metaboliche.
di seguito ci concentreremo sulle vitamine liposolubili studiandole individualmente e più dettagliatamente.
Vitamina D
Vitamina D : Per quanto riguarda l'introduzione con la dieta, essa si trova nei cibi in 2 forme principali: la maggiore è il colecalciferolo, mentre in piccola quantità si presenta sotto forma di ergocalciferolo. il primo si trova nei tessuti animali come nel pesce o il tuorlo d'uovo; mentre il secondo è di origine vegetale. Chimicamente differiscono solo per la presenza di un doppio legame in più e di un gruppo metilico nell'ergocalciferolo. La vitamina D è una di quelle che il nostro corpo è di per se in grado di sintetizzare e si forma normalmente nella pelle per reazione fotochimica: l'esposizione ai raggi solari converti infatti un composto, il 7-deidrocolesterolo, che si trova nella pelle in colecalciferolo che è rilasciato nel sangue e convertito nel fegato e nei reni nell ormone attivo calcitriolo. In questa forma la vitamina D lavora come un ormone, aumentando l'assorbimento intestinale del calcio, minimizzando la perdita dello stesso da parte del rene mediante un maggiore assorbimento e stimolando il riassorbimento dell'osso nel momento in cui il livello è basso. più semplicemente regola l'equilibrio della presenza di calcio nel nostro corpo. la deficienza di questa può portare a problematiche come il rachitismo nutrizionale soprattutto in età infantile (mineralizzazione incompleta delle ossa) o osteodistrofia renale (insufficienza renale cronica). L' eccesso invece può provocare a lungo andare un ipercalcemia che può condurre la deposizione di calcio in molti organi, in particolare nelle arterie e nei reni.
Vitamina K
vitamina K : è coinvolta nella sintesi epatica delle proteine della coagulazione del sangue, come ad esempio la protrombina e fattori di coagulazione 7, 9 e 10. in particolare, la formazione dei fattori di coagulazione è un processo complesso regolato da una serie di reazioni in successione. all'interno di questo processo la vitamina K è necessaria nelle reazioni di Carbossilazione, svolgendo il ruolo di cofattore dell'enzima carbossilasi. Oltre a trovarsi in cibi prevalentemente di origine vegetale, la maggior parte della vitamina K viene prodotta dal nostro corpo attraverso i batteri intestinali, che riescono di per se a sintetizzarne in quantità soddisfacente per il fabbisogno giornaliero. Per questo motivo, un effettiva vera carenza di questo micronutriente è insolita e in molti casi associata a situazioni di terapia antibiotica, che va ridurre appunto la flora esistente.
Vitamina A
Vitamina A: Il termine vitamina A è spesso usato per indicare collettivamente varie molecole correlate, dotate di attività biologica. il termine retinoidi include le varie forme naturali e sintetiche della vitamina, le quali possono esibire o meno l'attività della vitamina. In particolare, all'interno di questa famiglia di molecole le fondamentali sono: il retinolo, il retinale, l'acido retinoico, il betacarotene. in generale le retinolo retinale principali funzioni sono: azione antiossidante, vista, salute degli epiteli e sintesi glicoproteica funzione visiva sviluppo osseo. Ovviamente i compiti sono più specifici e le diverse forme della vitamina corrispondono a diverse funzioni che vengono svolte; come osservabile nell'immagine adiacente. Come visibile, il retinale interviene in quella che è la funzione visiva svolta dalla vitamina A: esso va a formare (sotto forma di cis-retinale) la rodopsina, ovvero il pigmento visivo dei bastoncelli all'interno delle cellule della retina. Quando la Rodopsina è esposta alla luce avvengono una serie di isomerizzazioni che determinano uno spegnimento del pigmento visivo, che rilascia il trans-retinale dall'opsina. Questo processo innesca un impulso nervoso che il nervo ottico trasmette poi all'encefalo.
Vitamina E
Vitamina e : Tra le vitamine del gruppo E, quella maggiormente attiva è l'alfa tocoferolo. è ampiamente diffusa in natura soprattutto negli oli vegetali, nelle uova e nei prodotti derivati dal grano. la sua principale funzione è quella di essere antiossidante, proteggendo le cellule contro il danno ossidativo prodotto dai radicali liberi. Una deficienza (rara) di questa vitamina può portare alla rottura delle membrane degli eritrociti e ad anemia.
acido retinoico accrescimento dell'osso e degli epiteli