Fisiologia, cellula e lipidi: funzioni e classificazione
Slide sulla fisiologia, definita come la scienza che studia il funzionamento degli organismi e l'applicazione delle leggi fisiche e chimiche. Il Pdf esplora le caratteristiche della cellula, unità fondamentale dei viventi, e la classificazione e le funzioni dei lipidi, inclusi acidi grassi, trigliceridi, fosfolipidi, glicolipidi, steroidi e vitamine liposolubili, per lo studio universitario di Biologia.
Ver más60 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Fisiologia Cellulare
- = scienza che studia il normale funzionamento di un organismo e delle parti che lo compongono
- = applicazione pratica delle leggi della fisica e della chimica per la comprensione del funzionamento degli organismi viventi
chimica, fisica, biologia, e anatomia
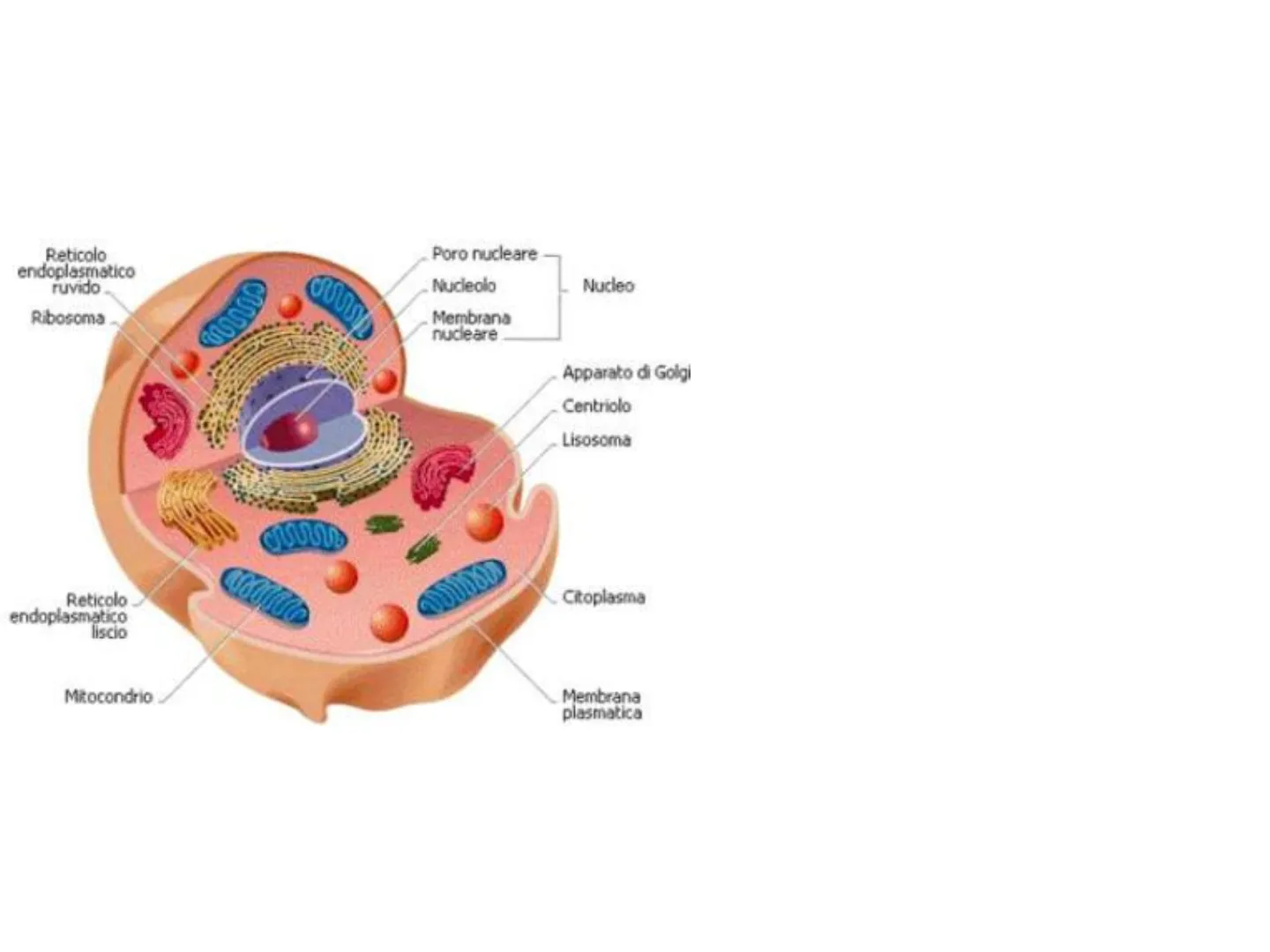
La Cellula: Struttura e Componenti
Poro nucleare Reticolo endoplasmatico ruvido Nucleolo Nucleo Ribosoma Membrana nucleare Apparato di Golgi Centriolo Lisosoma Reticolo endoplasmatico liscio Citoplasma Mitocondrio Membrana plasmatica
unità fondamentale dei viventi forma e dimensioni varie nel corpo si comporta come organismi unicell
La Cellula: Organismo Umano
A B D E C H G L M N
ORGANISMO UMANO
- formato da 100.000 miliardi di cellule
- presenta + di 250 diversi tipi di cellule, diversi per dimensione, forma e funzione specifica
- cellule altamente specializzate
- interazione tra cell -> complessità organismo
La Cellula: Costituenti Cellulari
Composizione di una Cellula Mammifera
Composition of a Mammalian Cell Other etabolites Nucleic Acids Proteins 60% 10% 5% Inorganic Ions 3% Glycans 6% 16% Lipids
?????? costituenti della cell dal punto di vista chimico ??????
La Cellula: Elementi Costitutivi
Contenuto Elementare nel Corpo Umano
Elemento Contenuto (g) Acqua 42000 Idrogeno (non di H20) 2000 Ossigeno (non di H20) 2900 Carbonio 16000 Azoto 1800 Calcio 1200 Fosforo 500 Sodio 100 Potassio 140 Cloro 95 Magnesio 18 Ferro 4
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Ti Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Cn Nh FI Mc Lv Ts Og La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr 0,01
costituenti cellulari 98% del peso del corpo umano è costituito da 6 elementi: ossigeno (O), carbonio (C), idrogeno (H), azoto (N), calcio (Ca) e fosforo (P)
H He Li Be Na Mg Al Si P S CI Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Fluoro 2,6 Zinco 2,3 Rame 0,07 lodio BCNOF Ne
La Cellula: Macromolecole
Elementi Costitutivi e Macromolecole
C, H, O, P, N si combinano a formare gli elementi costitutivi della cell
Elementi costitutivi Macromolecole Aminoacidi Proteine Lipidi Carboidrati (monosaccaridi) Polisaccaridi Nucleotidi Acidi nucleici
La Cellula: Processi di Condensazione e Idrolisi
ricorda che: 1ª molecola 2ª molecola OH H Due molecole si uniscono con eliminazione di una molecola di acqua. 1 1,0
CONDENSAZIONE = formazione di legame tra 2 molecole (o tra 2 parti della stessa molecola) con perdita di una molecola d'H2O
L'inserimento della molecola d'acqua spezza un legame del polimero. H.O
IDROLISI = rottura di un legame per aggiunta di una molecola d'H2O
La molecola d'acqua si dissocia in OH e H, che si attaccano agli atomi del polimero tra cui è avvenuta la rottura del legame. OH H 1ª molecola 2ª molecola
La Cellula: Macromolecole e Polimeri
MACROMOLECOLE: · formate da strutture complesse (polimeri) ottenute per condensazione di molecole semplici (monomeri) · durante digestione vengono scomposte in monomeri e assorbiti come tali per poi ricostruire macromolecole · > parte ha vita breve rispetto la cell (continua demolizione e sostituzione) tranne DNA · partendo dagli stessi monomeri si possono costruire macromolecole diverse in composizione e struttura
+ monomeri polimero LINEARI A PETTINE * A STELLA RETICOLATI
La Cellula: Componenti Fondamentali
Elementi costitutivi Macromolecole Aminoacidi Proteine Lipidi Carboidrati (monosaccaridi) Polisaccaridi Nucleotidi Acidi nucleici
Aminoacidi: Struttura e Classificazione
· unità strutturale delle proteine · sono 20
Carbonio a H 1 HON -C - COOH 1 R Gruppo aminico Gruppo carbossilico Catena laterale V catena laterale / gruppo funzionale / determina caratteristiche chimico-fisiche V influenza la solubilità classifica gli aa in apolari, polari
Stato di Ionizzazione degli Amminoacidi
Lo stato di ionizzazione di un amminoacido dipende dal pH
R OH" HOH 1 R OH" HOH R H H H +H3N COOH THEN COO HON H H+
· a ph neutro: ioni bipolari (COOH->COO -; NH2->NH3+) · tamponi biologici Forma presente a PH neutro o fisiologico · caratterizzati da - gruppo aminico - gruppo carbossilico - gruppo R Gruppo funzionale
Aminoacidi: Esempi e Proprietà
0 HÆN-CHC-OH H HẸN-CHC-OH CH3 0 H_N-CHC-OH CHCH_ CH3 0 HẸN-CHC-OH CH2 CHCH3 CH3 H_N CHC-OH CHCH_ GHZ CH3 Glycine Alanine Valine Leucine Isoleucine HẸN-CHC-OH OH HẸN CHC-OH HẸN-CHC-OH H „N CHC-OH CHZ GHZ OH HN CH_ Methionine Proline Phenylalnine Tryptophan Serine 0 0 H N CHC-OH T4 HẸN-CHC-OH HEN CHC-OH HẸN-CHC-OH HOH GHZ GHZ CHZ II SH C=0 NH2 C-0 NHZ Threonine Asparagine Glutamine Tyrosine Cysteine HẸN-CHC-OH H_N-CHC-OH H_N-CHC-OH HẸN-CHC-OH HẸN-CHC-OH FHz GHZ H. I FHZ CHỊ FHz FHZ CHE OH C=0 -NH NH NH2 C=NH NH2 Lysine Arginine Histidine Aspartic acid Glutamic acid
Apolari V no scambio di e- V no legami Ho ionici idrofobici
Polari · idrofili · legami H con H2O • Sono privi di carica carichi + NH2 COOH CHz FHZ OH HN 0 HẸN-CHC-OH OH
Aminoacidi: Tipi e Essenzialità
Gruppo R Aminoacidi ·glicina ·alanina ·valina ·leucina ·prolina ·metionina ·isoleucina ·fenilalanina ·triptofano
Polare non carico ·serina ·treonina ·asparagina ·glutammina ·tirosina ·cisteina
Polare carico ·lisina ·arginina ·istidina ·acido aspartico ·acido glutammico
PROTEINE 20 aminoacidi 12 non essenziali - T 8 essenziali Non polare
Aminoacidi: Funzioni Biologiche
- sintesi proteica
Aminoacidi Proteine
- produzione di E (aa ramificati)
- precursori di composti di rilevanza biologica:
- aa solforati (met, cys)- glutatione (antiossidante contro radicali liberi)
- triptofano - niacina (vit. PP)
- neurotrasmettitori (serotonina)
- ormoni (melatonina)
wwwsning I
Aminoacidi: Legame Peptidico
AMINOACIDO A AMINOACIDO B H 0 H H H + - H N - C - C 0 H - N - - C-C H 0 R gruppo aminico 2-9 aa = dipeptide 10-100 aa = polipeptide > 100 aa = proteina H C H H 1 LEGAME PEPTIDICO + H N C C - N - C C I H 0 R H R Porzione N-terminale Porzione C-terminale DIPEPTIDE I 1 H R gruppo carbossilico H2O 0 1 - II 0
Proteine: Struttura Primaria
1 5 15 Lys Val Phe Gly Arg Cys Glu Leu Ala Gly (Laut 35 25 20 Glu Phe Lys Ala Ala Cys Val Trp Asn Gly Leu Ser Tyr Gly Arg 45 40 Asn Arg Asn 50 Asn Gin Gly Ser Thr Asp Tyr Gly 65 Asn Cys Trp Trp Arg Ser Asn 70 Arg Thr Gly Pro 80 75 Pro Asn Ile Pro Cys Ser Ala 95 100 Ala Val Ser Ala Asp Ser Val lle Lys 110 Trp 115 105 Val Arg Cys Lys Met Asn Trp Ala 125 Trp Ala Gin Val Asp 129 Cys Arg Leu Aminoacido Sequenza lineare - mai in natura ala - gly - his - lys - gly - leu - val - lys - amminoacidi Cys Asn Ser Leu Leu Ser Leu Cys Asn 85 Gin Asp Ile Gly The Asp Thr Ala 55 60 Tyr Ala Met Lys Arg His Ala 30 Thr 90 Lys Ala Arg Asn 120 yArg lle 10
Proteine: Struttura Secondaria
Alfa-elica
a-elica C C N C C V H N C C N C I legami a idrogeno mantengono l'avvolgimento a elica CHIAVE Atomo di carbonio Atomo di ossigeno Atomo di azoto Atomo di idrogeno Gruppo R - più comune - R verso esterno intracatena - legami HV V paralleli asse V 4° aa - proteine fibrose elastiche - (capelli, lana, pelle, unghie) C N C C N C
Foglietto Beta
foglietto B .... ... I legami a idrogeno tendono insieme le catene vicine nel foglietto B-ripiegato CHIAVE · Atomo di carbonio · Atomo di ossigeno Atomo di azoto · Atomo di idrogeno Gruppo R - 2 0 + catene (max 10) - legami H: intercatena - a zig-zag - R verso esterno
Proteine: Struttura Terziaria
Legame a idrogeno Legame ionico CHE C-NH3 TO C-CH2 CH2 1 CH2 HỌC CH3 S CH HC H / S H3C CH3 CH2 HO-C CH2 Ponte disolfuro Interazione idrofobica lana & Diehardenn - Ripiegamento nello spazio - Interazioni tra aa lontani - Ponti H anche tra R - Ponti S-S - Proteine fibrose (cheratina) o globulari (Ig) a elica foglietto B regioni di connessione interazione tra gruppi R 0=0 O
Classificazione delle Proteine Terziarie
classificate in: FIBROSE - insolubili in H2O - nel ts connettivo - seta, collagene, a-cheratina GLOBULARI - solubili in H2O - Ig
La forma influenza la funzione e può essere modificata da mutazioni ma anche dall'ambiente (denaturazione = perdita di forma - perdita di funzione)
Proteine: Struttura Quaternaria
Catena beta (B-globina) Eme Catena alfa (a-globina) Catena alfa (a-globina) Catena beta (ß-globina) - Interazioni tra più catene - Disposizione spaziale - Proteine multimeriche - Es. Hb
Proteine: Funzioni Biologiche
V Enzimatica: catalizzano reazione specifica v Strutturale: rinforzo e protezione (collagene, elastina) V Deposito: riserva di nutrienti (aa) v Trasporto: proteine trasportatrici, canale, pompe V Regolazione: ormoni (insulina, fattori di crescita); controllano l'espressione di specifici geni v Motilità: movimenti cellulari (actina e miosina) V Protezione: anticorpi Comunicazione: mediano comunicazione tra cell distanti nell'organismo V Recettoriale: permettono a cell di rispondere a stimoli esterni
Proteine: Enzimi e Struttura
coenzima C - S C S apoenzima oloenzima oloenzima apoenzima + coenzima oloenzima parte non proteica proteina coniugata parte proteica - Gruppo prostetico: sempre saldamente legato a porzione proteica - Coenzima: dissociabile, molecola organica (NAD, FAD) - Cofattore: dissociabile, ione (Fe, Cu, Zn)
Sito Attivo Enzimatico
substrato Sito attivo Enzima Complesso Enzima-substrato Sito attivo · o catalitico · nella porzione proteica · responsabile del riconoscimento substrato · simile a piccola fenditura
Proteine: Meccanismo d'Azione Enzimatica
Modello Chiave-Serratura
Substrato O h N h chiave-serratura Sito attivo a b Enzima
Modello di Adattamento Indotto
O h - h N HO H + h h h O Enzima adattamento indotto Substrato + C a b a C b Enzima Substrato + C a b C Complesso ES Complesso ES
Catalisi Enzimatica
Assorbimento di energia, formazione legame attraverso sintesi per disidratazione Prodotto (P) Substrati (S) + H2O Sito attivo Complesso enzima- substrato (E-S) Cambiamenti strutturali complesso E-S Enzima (E) Enzima (E) · catalizzano formazione o scissione di molecole · En : no modificazione - riutilizzabile €
Proteine: Funzione Enzimatica e Reazioni
enzimi e reazioni Ea Reazione non catalizzata Una reazione non catalizzata possiede energia di attivazione maggiore di quella della stessa reazione catalizzata. Energia libera Ea a Una reazione catalizzata possiede energia di attivazione minore. Reagenti AG Non c'è differenza nell'energia libera in gioco tra reazioni catalizzate e non catalizzate. Reazione catalizzata Prodotti Coordinata di reazione
La Cellula: Elementi e Macromolecole
Elementi costitutivi Macromolecole Aminoacidi Proteine Lipidi Carboidrati (monosaccaridi) Polisaccaridi Nucleotidi Acidi nucleici