Nomenclatura e Formule Chimiche: schemi per lo studio della Chimica
Schemi su Nomenclatura e Formule Chimiche. I Riassunti illustrano definizioni, regole di nomenclatura (tradizionale e IUPAC) e formule chimiche per composti inorganici, inclusi ossidi, idruri e acidi, utili per la scuola superiore in Chimica.
Ver más8 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
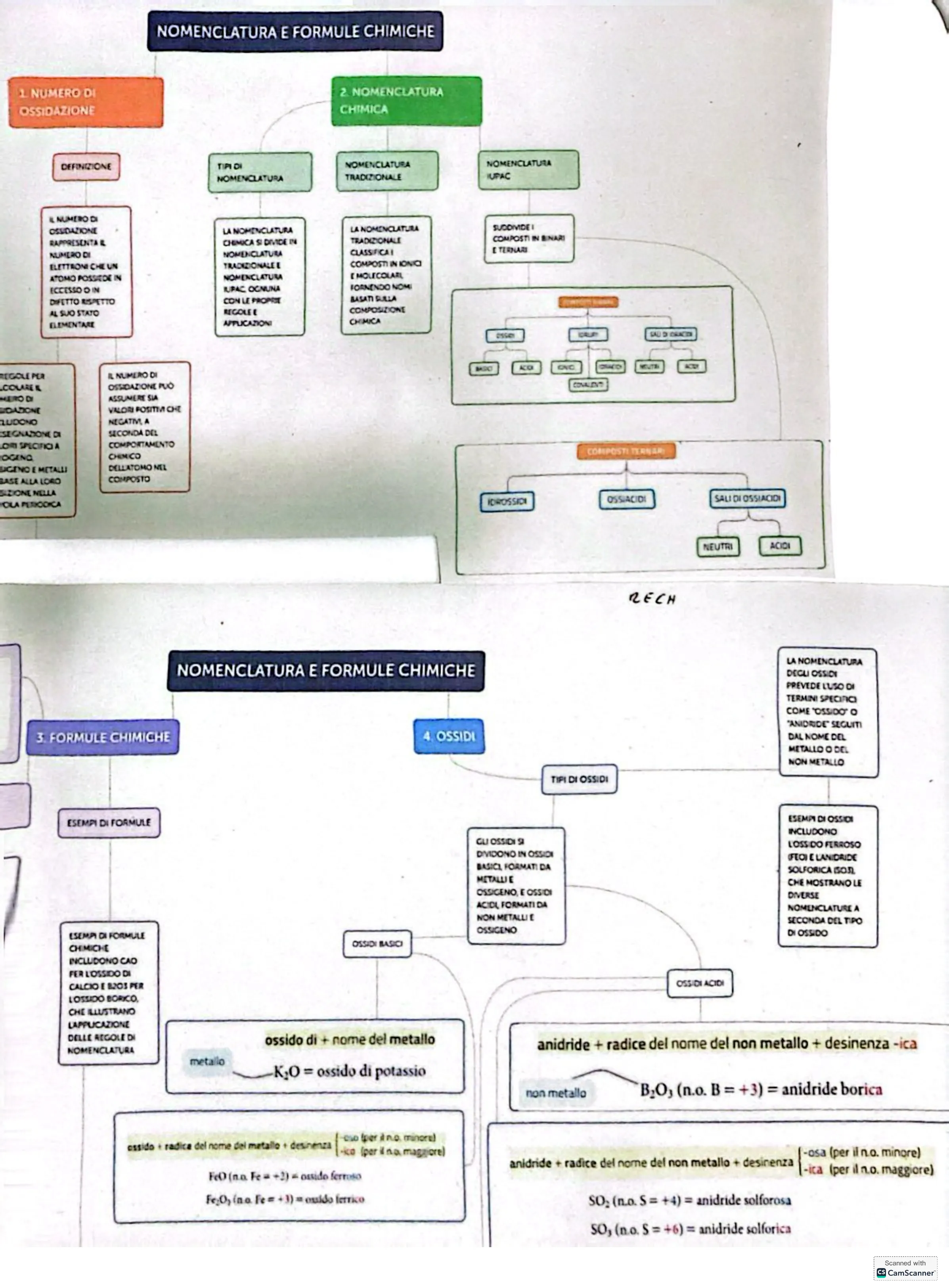
NUMERO DI OSSIDAZIONE E NOMENCLATURA CHIMICA
NUMERO DI OSSIDAZIONE
1 NUMERO DI OSSIDAZIONE
IL NUMERO DI OSSIDAZIONE RAPPRESENTA & NUMERO DI ELETTRONI CHE UN ATOMO POSSIEDE IN ECCESSO O IN DIFETTO RISPETTO AL SUO STATO ELEMENTARE
REGOLE PER COLAREL MERO DI DADONE LUDONO SEGNADONE DI OR SPECIFIC A OGING UCINO E METALLI BASE ALLA LORO SIZIONE NELLA OLA PERIODICA
IL NUMERO DI OSSIDAZIONE PUÒ ASSUMERE SIA VALORI POSITIV CHE NECATI A SECONDA DEL COMPORTAMENTO CHEIN CO DELLATOMO NEL COMPOSTO
NOMENCLATURA CHIMICA
2. NOMENCLATURA CHIMICA
DEFINIZIONE TIPI DI NOMENCLATURA NOMENCLATURA TRADIZIONALE NOMENCLATURA INFAC
LA NOMENCLATURA CHIMICA SI DIVIDE IN NOMENCLATURA TRADIZIONALE E NOMENCLATURA IUPAC OGNUNA CON LE PROPRIE RIGOLE E APPLICAZIONI
LA NOMENCLATURA TRADIZIONALE CLASSIFICA! COMPOSTI IN IONICI [ MOLECOLARI FORNENDO NOMI BASATI SULLA COMPOSIZIONE CHIMICA
SUCOMIDE I COMPOSTI IN BINARI E TERNARI
COMPOSTI TERNANI IDROSSICI OSSIACIDI SALI DI OSSIACIDI NEUTRI ACIDI RECH
FORMULE CHIMICHE E OSSIDI
FORMULE CHIMICHE
NOMENCLATURA E FORMULE CHIMICHE 3. FORMULE CHIMICHE
ESEMPI DI FORMULE ESEMPI DI FORMULE CHIMICHE INCLUDONO CAO FER L'OSSIDO DI CALCIO E B2OS PER LOSSIDO BORICO. CHE ILLUSTRANO LAPPLICAZIONE DELLE REGOLE DI NOMENCLATURA
OSSIDI
4. OSSIDI
"ANIDRIDE" SEGUITI DAL NOME DEL METALLO O DEL NON METALLO
TIPI DI OSSIDI GU OSSIDI 9 DIVIDONO IN OSSIDI BASICI, FORMATI DA METALLI E OSSIGENO, E OSSIDI ACIDI FORMATI DA NON METALLI E OSSIGENO
ESEMPI DI OSSIDI INCLUDONO LOSS DO FERROSO FLOI E L'ANIDRIDE SOLFORICA BOIL CHE MOSTRANO LE DIVERSE NOMENCLATURE A SECONDA DEL TIPO DI OSSIDO
OSSIDI ACIDI
ossido di + nome del metallo anidride + radice del nome del non metallo + desinenza -ica non metallo B2O3 (n.o. B = +3) = anidride borica cssido i radica del nome del matallo + desinenza cio (per il no. minore) -ko (per il na maggiore) FcO (n.o. Fe = +2) = ossido ferroso FezO2 (no. Fe = +3) = ouido fetrico anidride + radice del nome del non metallo + desinenza -osa (per il n.o. minore) -ica (per il n.o. maggiore) SO: (n.o. S = +4) = anidride solforosa SO, (n.o. S = +6) = anidride solforica Scanned with Cs CamScanner
OSSIDI BASICI
metallo KO = ossido di potassio
LA NOMENCLATURA DECLI OSSIDI PREVEDE LUSO DI TERMINI SPECIACI KO CNCRECH
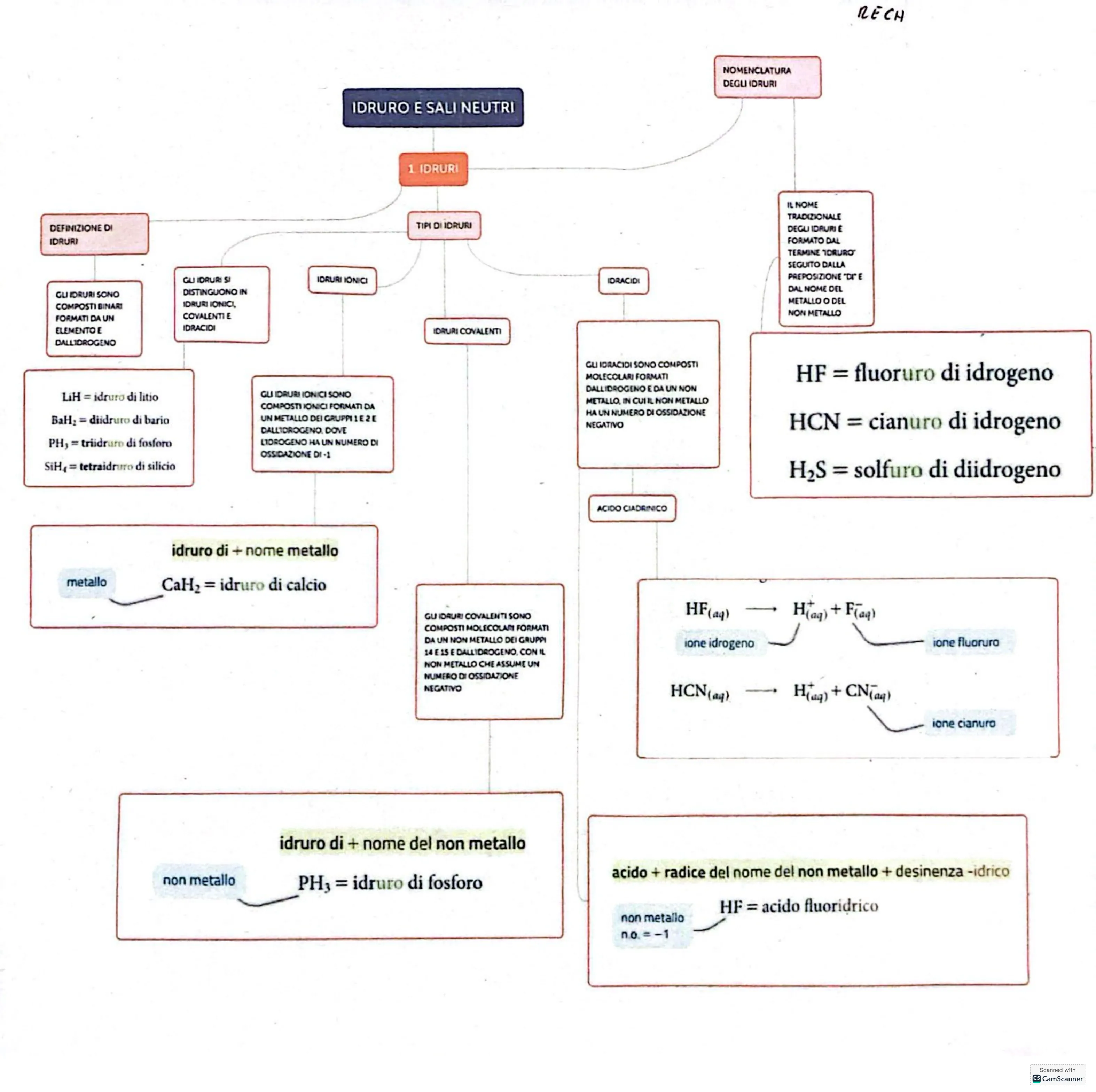
IDRURI E SALI NEUTRI
NOMENCLATURA DEGLI IDRURI
NOMENCLATURA DEGLI IDRURI
1 IDRURI
DEFINIZIONE DI IDRURI
TIPI DI IDRURI IDRURI IONICI IDRACIDI
IL NOME TRADIZIONALE DEGLI IDAURI È FORMATO DAL TERMINE IDRURO SEGUITO DALLA PREPOSIZIONE "DIE DAL NOME DEL METALLO O DEL NON METALLO
GLI IDRURI SONO COMPOSTI BINARI FORMATI DA UN ELEMENTO E DALLIDROGENO
GUIDRURI SI DISTINGUONO IN IDRURI IONICI, COVALENTI E IDRACIDI
IDRURI COVALENTI
LiH = idruro di litio BaH: = diidruro di bario PH, = triidruro di fosforo SiH4 = tetraidruro di silicio
GUIDRURI IONICI SONO COMPOSTI IONICI FORMATI DA UN METALLO DEI GRUPPI 1 E 2 E DALLIDROGENO, DOVE LIDROGENO HA UN NUMERO DI OSSIDAZIONE DI -1
GLI IDRACIDI SONO COMPOSTI MOLECOLARI FORMATI DALLIDROGENO E DA UN NON METALLO, IN CUI IL NON METALLO HA UN NUMERO DI OSSIDAZIONE NEGATIVO
HF = fluoruro di idrogeno HCN = cianuro di idrogeno H2S = solfuro di diidrogeno ACIDO CIADRINICO
idruro di + nome metallo metallo CaH2 = idruro di calcio
GU IDRURI COVALENTI SONO COMPOSTI MOLECOLAN FORMATI DA UN NON METALLO DEI GRUPPI 14 E 15 E DALLIDROGENO, CON IL NON METALLO CHE ASSUME UN NUMERO DI OSSIDAZIONE NEGATIVO
HF(aq) - Haq) + F(aq) ione idrogeno ione fluoruro HCN(aq) - H(g) + CN (aq) ione cianuro
idruro di + nome del non metallo non metallo PH3 = idruro di fosforo
acido + radice del nome del non metallo + desinenza -idrico HF = acido fluoridrico non metallo n.o .=- 1 Scanned with Cs CamScanner
SALI NEUTRI
IDRURO E SALI NEUTRI 2. SALI NEUTRI
DEFINIZIONE DI SALI NEUTRI
NOMENCLATURA DEI SALI NEUTRI
I SALI NEUTRI SONO COMPOSTI IONICI FORMATI DA UN METALLO E DA UN NON METALLO O DALLO IONE CIANURO
SALI NEUTRI CON METALLI A PIÙ STATI DI OSSIDAZIONE
radice del nome del non metallo + desinenza -uro + di + nome del metallo CaF: = fluoruro di calcio metalo non met silo
IL NOME TRADIZIONALE DEI SAU NEUTRI È COSTITUITO DALLA RADICE DEL NON METALLO CON LA DESINENZA -URO, SEGUITA DALLA PREPOSIZIONE 'DI' E DAL NOME DEL METALLO
SE IL METALLO HA DUE NUMERI DI OSSIDAZIONE, SI UTILIZZA LA DESINENZA -OSO PER IL NUMERO MINORE E -ICO PER IL NUMERO MAGGIORE
Pbl2 = diioduro di piombo Al2S3 = trisolfuro di dialuminio CuCI (n.o. Cu = +1) = cloruro rameoso CuCl2 (n.o. Cu = +2) = cloruro rameico CS CamScanner Scanned withRECH
SALI ACIDI
3. SALI ACIDI
DEFINIZIONE DI SALI ACIDI
NOMENCLATURA DEI SALI ACIDI
I SALI ACIDI SONO COMPOSTI ONICI FORMATI DA UN METALLO E DALLO IONE SOLFURO ACIDO O BISOUURO
NEL NOME DEI SALI ACIDI LA PRESENZA DELLATOMO DI IDROGENO E SPECIFICATA DAL TERMINE "ACIDO' O DAL PREFISSO 'BI -* NEL NOME TRADIZIONALE
idrogenosolfuro di sodio solfuro acido di sodio o bisolfuro di sodio nome IUPAC NaHS Ca(HS)2 noma tradizionale idrogenosolfuro di calcio solfuro acido di calcio o bisolfuro di calcio
OSSIACIDI: DEFINIZIONE, NOMENCLATURA E COMPORTAMENTO CHIMICO
DEFINIZIONE DEGLI OSSIACIDI
OSSIDRICI: DEFINIZIONE, NOMENCLATURA E COMPORTAMENTO CHIMICO 1. DEFINIZIONE DEGLI OSSIACIDI
COMPOSIZIONE DEGLI OSSIACIDI
FORMULA GENERALE DEGLI OSSIACIDI
DETERMINAZIONE DELLA FORMULA DEGLI OSSIACIDI
GLI OSSIACIDI SONO COMPOSTI TERNARI FORMATI DA IDROGENO, NON METALLO E OSSIGENO
+1 +5 -2 acido nitrico: H N O. da cui: HNO,
LA FORMULA GENERALE DI UN OSSIACIDO E HNMEO, DOVE N RAPPRESENTA IL NUMERO DI ATOMI DI OSSIGENO E ME IL NON METALLO
LA FORMULA DI UN OSSIACIDO SI DETERMINA ASSEGNANDOI NUMERI DI OSSIDAZIONE DEGLI ATOMI DEL COMPOSTO E CALCOLANDO GLI INDICI IN MODO CHE LA SOMMA DEI NUMERI DI OSSIDAZIONE SIA UGUALE A ZERO
NOMENCLATURA DEGLI OSSIACIDI
2. NOMENCLATURA DEGLI OSSIACIDI
NOME TRADIZIONALE DEGLI OSSIACIDI
PREFISSI PER INDICARE IL NUMERO DI OSSIDAZIONE DEL NON METALLO
PREFISSI IPO- E PER- PER INDICARE NUMERI DI OSSIDAZIONE ESTREMI
IL NOME TRADIZIONALE DEGLI OSSIACIDI SEGUE UNA SPECIFICA STRUTTURA BASATA SUL NUMERO DI OSSIDAZIONE DEL NON METALLO PRESENTE NEL COMPOSTO
I PREFISSI -OSO E . ICO VENGONO UTILIZZATI PER INDICARE RISPETTIVAMENTE IL NUMERO DI OSSIDAZIONE MINORE E MAGGIORE DEL NON METALLO
I PREFISSI IPO- E PER- VENGONO UTILIZZATI PER INDICARE RISPETTIVAMENTE IL NUMERO DI OSSIDAZIONE MINORE E MAGGIORE DEL NON METALLO QUANDO QUESTO PRESENTA TRE O QUATTRO NUMERI DI OSSIDAZIONE POSITM
Il nome tradizionale degli ossiacidi: · se il non metallo ha solo un n.o., è costituito da: acido + radice del nome del non metallo + desinenza -ico · se il non metallo da due n.o. (positivi), è costituito da: acido + radice del nome del non metallo + desinenza [-oso (per il n.o. minore) 1-ico (per il n.o. maggiore) H2SO3 (n.o. S = +4) = acido solforoso H2SO4 (n.a. S = +6) = acido solforico cs CamScanner" Scanned with HnMe0S CamScanner Scanned with
DISSOCIAZIONE DEGLI OSSIACIDI IN SOLUZIONE ACQUOSA
LULA OSSIDRICI DEFINIZIONE. NOMENCLATURA E COMPORTAMENTO CHIMICO 4 DISSOCIAZIONE DEGU OSEACIDLIN SOLUZIONE ACQUOSA
DISSOCIAZIONE DEGLI OSSACIDI MONOMIOTICI
NOME TRADIZIONALE DEGU OSSCAMION
NOME IUPAC DEGLI DIJOAN ONI
GU OSSLACEY MONO WOTICI SI DISSOCIANO IN SOLUZIONE ACQUOLA IN IONI DROGENO E IN OSSOANIOM COSTITUITI DA UN NON METALLO E OSSIGENO
IL NOIME TRADIZIONALE BECALI OSSOANIONI SEGUE UNA SPECIFICA STRUTTURA BASATA SUL NUMERO DI OSSIDAZIONE DEL NON METALLO PRESENTI NEL COMPOSTO
ILNOME NUFAC DEGLI OSSOAN ONI COSTITUITO DA IONE, UN PPERSSO CHE INDICA IL NUMERO DI ATOMI DI OSSIGENO, LA RADICE DEL NOME DEL NON METALLO E & NUMERO DI OSSIDAZIONE DEL NON METALLO .
acido + monosso-(dosso-, tricaso-, tetraosso-) + radice del nome del non metallo + -co + in.c. non metalto) HNO2 (n.o. N = +3) = acido diossinitrice(11) HCIO, (na CI = +7) = acido tetraossoperdorice(VII) 2 atomi & fosforo H. P207
I PERSS HETA, PRO- E ORTO- VENGONO UTILIZZATI PER DISTINGUERE CU OSSIACIEN CON LO STESSO NUMERO DI OSS DAZIONE MA DIVERSA STRUTTURA
LA FORMULA DEGLI OSSIACIÓI CON PRUSSI META, PRO- I CATO- SI DETERMINA ASSEGNANDO I NUMERI DI OSSIDAZIONE E CALCOLANDO GLI INDICI IN MODO DA OTTENERE UNA SOMMA DI ZURQ, CON EVENTUALI AGGIUNTE DI MOU COLI DI · meta si determina assegnando i numeri di ossidazione e calcolando gli indici in modo tale che la somma dei numeri di ossidazione sia uguale a zero. acido metaborico: HBO +1+3 -2 - HBO2 · piro- si determina assegnando i numeri di ossidazione e calcolando gli indici, quindi si moltiplicano gli indici per due e infine si aggiunge una molecola di H2O. -1-5-2 acido pirofosforico: HPO - HPO, X2. HIPO, HO, H,PO; · orto- sì determina assegnando i numeri di ossidazione e calcolando gli indici, infine si aggiunge una molecola di H;O. acido (orto)silicico: H SIO - HASIO, +"0. HISIO,
Il nome tradizionale dell'ossanione è costituito da: ione + radice del nome del non metallo + desinenza |-ito (per il n.o. minore) 1-ato (per il n.o. maggiore) Le reazioni di dissociazione in soluzione acquosa dell'acido nitroso e dell'aci- do nitrico sono rappresentati dalle seguenti equazioni: lone idrogeno HNO (4) Hiag) + NO;tag) ione nitrito HNOJag) Hiag + NOjian azoto n.o. » +5 ione nitrato
Il nome IUPAC dell'ossanione è costituito da: ione + monosso- (diosso-, triosso-, tetraosso-) + radice del nome del non metallo + -ato + (n.o. non metallo) IO" = ione monossoiodato(I) BrO, = ione triossobromato(V)
NOME IUPAC DEGLI OSSIACIDI
S NOME IUPAC DEGLI OSSUACIDI
A NOME KUPAC DAGLI OSSIACIDI I COSTITUITO DA ACIDO, UN MUFISSO CHE INDICA IL NUMERO DI ATOMI DI OSSIGENO, LA RADICE DEL NOME DEL NON METALLO U IL NUMERO DI OSSIDAZIONE DEL NON METALLO
STRUTTURA DIE NOME MIPAC DE GUI OSRACII
LO STESSO NUMERO DI OSHOATIONE H2CO3 desszero - cabanks
IDROSSIDI
DEFINIZIONE E NOMENCLATURA DEGLI IDROSSIDI
-RECH IDRURO E SALI NEUTRI idrossido di + nome metallo 4. IDROSSIDI NaOH = idrossido di sodio sodio n.o. = +1 gruppo idrossido
DEFINIZIONE DI IDROSSIDI
NOMENCLATURA DEGLI IDROSSIDI
GLI IDROSSIDI, NOTI ANCHE COME BASI, SONO COMPOSTI IONICI FORMATI DA UN CATIONE METALLICO E DALLO IONE IDROSSIDO (OH-)
IL NOME TRADIZIONALE DEGLI IDROSSIDI È FORMATO DAL TERMINE "IDROSSIDO" SEGUITO DALLA PREPOSIZIONE "DI" E DAL NOME DEL METALLO, CON VARIAZIONI PER METALLI A PIÙ STATI DI OSSIDAZIONE
idrossido + radice del nome del metallo + desinenza [-oso (per il n.a. minore) -ico (per il n.o. maggiore) 1 Fe(OH)2 (n.o. Fe = +2) = idrossido ferroso € 1 Fe(OH)3 (n.o. Fe = +3) = idrossido ferrico 1
ione sodio H2O(1) NaOH(s) Na(ag) + OH(aq) ione ferrico H2O(1) Fe(OH)3(s) Fe(ag) + 3 OH(aq) ione ammonio H2O(1) NHỊOH(s) NHM(aq) + OH(aq) cs CamScanner Scanned with