Enzimi e catalisi enzimatica: meccanismi e interazioni enzima-substrato
Documento dall'Università su Enzimi e catalisi enzimatica. Il Pdf, adatto per lo studio universitario di Biologia, esplora i meccanismi di catalisi enzimatica, i modelli di interazione enzima-substrato e il ruolo dei metalli, con esempi come le proteasi a serina.
Ver más11 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Enzimi e catalisi enzimatica
martedì 24 ottobre 2023
11:17
SUBSTRATO
SITO ATTIVO ENZIMA
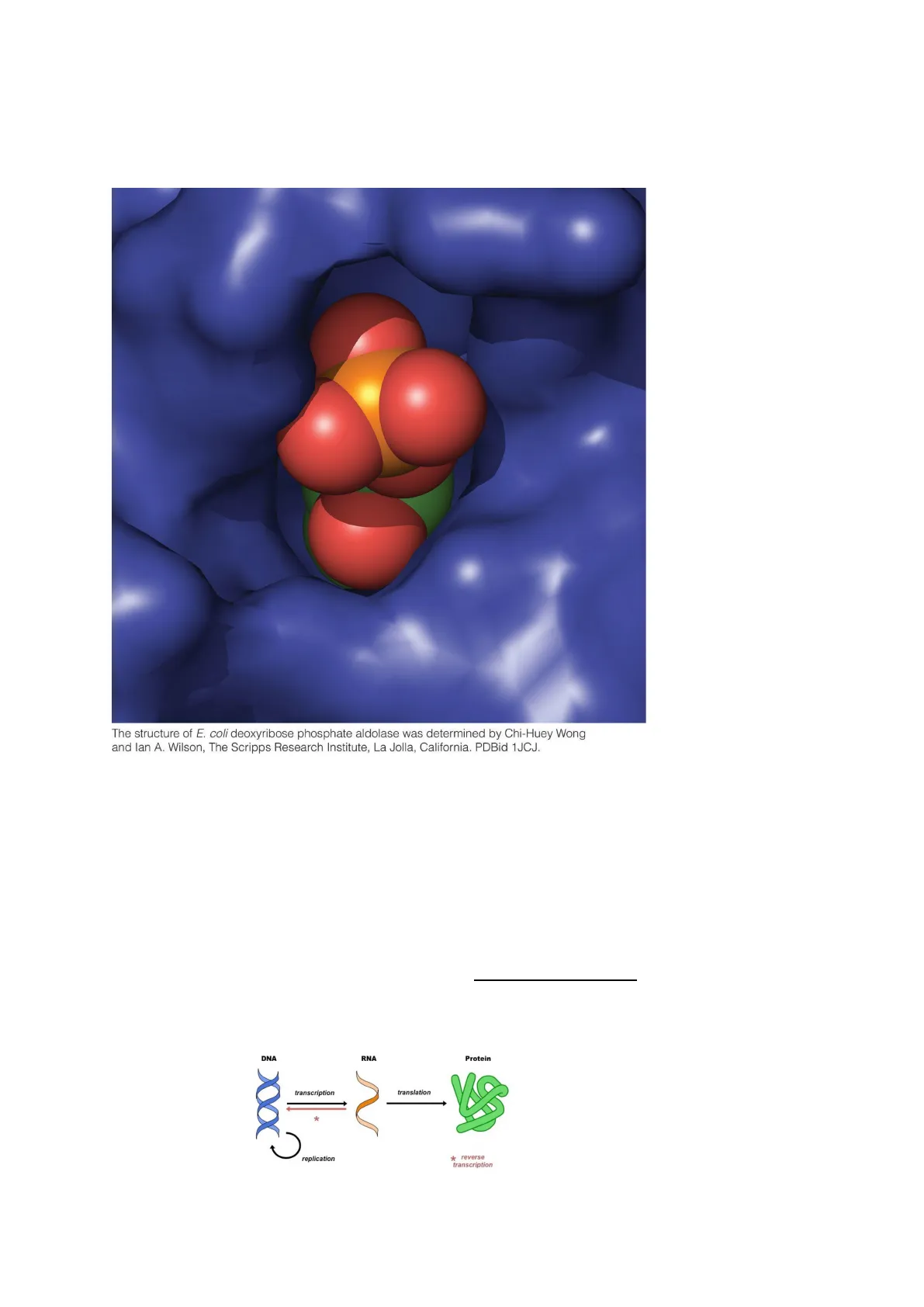
The structure of E. coli deoxyribose phosphate aldolase was determined by Chi-Huey Wong
and lan A. Wilson, The Scripps Research Institute, La Jolla, California. PDBid 1JCJ.
Gli enzimi sono dei catalizzatori molto potenti ed efficaci; accelerano di miliardi di volte le
reazioni chimiche. Agiscono in condizioni fisiologiche e a pH fisiologico, a differenza dei
catalizzatori chimici che necessitano condizioni drastiche .
"EN + ZYME" --- > dal tedesco: "nel lievito"
La prima osservazione (a fine del 1900) di un'enzima è stata fatta nel lievito; la fermentazione è
infatti catalizzata da quello che fu nominato "enzima" (esisteva qualcosa nella cellula che
funzionava nel catalizzare processi metabolici anche al di fuori del contesto cellulare - l'enzima
funziona anche al di fuori della cellula)
La seconda grande osservazione e deduzione fu che l'enzima è una proteina: ciò fu osservato
nella cristallizzazione dell'enzima ureasi di pianta.
Quasi tutti gli enzimi sono proteine
Dogma centrale e ribozimi
DNA
RNA
Protein
transcription
translation
*
replication
* reverse
transcription
Il paradosso viene trovato nel dogma centrale: per sintetizzare proteine si passa da DNA a RNA
e per fare ciò sono necessarie delle proteine (RNA polimerasi, il ribosoma).
TEORIA DEL MONDO A RNA: la parte catalitica e di trasporto è svolta da molecole a RNA
I RIBOZIMI sono quelle molecole a RNA che compiono funzione di catalizzazione
Accelerazione delle reazioni chimiche
Gli enzimi accelerano le reazioni chimiche di molti ordini di grandezza
In presenza di enzima una molecola viene convertita nell'altra molecola in 1 secondo
(aumento del rate) Gli enzimi aumentano di milioni o miliardi di volte gli aumenti dei rate.
Questo avviene grazie alla conformazione specifica dell'enzima: l'enzima lega il substrato
al sito attivo
Residui
amminoacidici
chiave
del sito attivo
Substrato
La proteina è molto più grande rispetto
alla parte cruciale necessaria per la
catalisi.
Specificità degli enzimi
Gli enzimi agiscono su substrati specifici
Substrate
h
N
h
h
h
N
HO
H
+
h
h
h
-O
Enzyme
La tasca di legame accoglie una
molecola specifica in una
specifica direzione.
Ci sono tante regioni di legame e
seppure i legami siano deboli si
ha stabilità. Potrebbero anche
esserci legami covalenti tra
enzima e substrato
Modelli di interazione enzima-substrato
S
+
E
E
1
S
E
E
Distorsione alla
conformazione dello
stato di transizione
1
P
P
+
+
E
E
O
Tasca di legame sito attivo
- Chiave - serratura: l'enzima non cambia la propria conformazione legandosi al substrato
- Adattamento indotto: non è presente all'inizio una regione perfettamente complementare
al substrato ma durante il processo l'enzima modifica un po' la sua struttura per aderire
meglio al substrato. Questo cambio dell'enzima è utile all'attività catalitica poiché reagisce
bene anche con l'intermedio di reazione.
Entrambi i modelli sono validi
Adattamento indotto nell'esochinasi
Cavità
del sito
di legame
Glucosio
legato
(a) Prima del legame con il glucosio
(b) Dopo il legame con il glucosio
Specificità della reazione enzimatica
L'enzima potrebbe essere attivo solo su un particolare stereoisomero.
L'aconitasi fa una reazione di isomerizzazione da citrato a isocitrato. Il citrato non è chirale
(abbiamo due sostituenti uguali) ma prochirale.
L'isocitrato è invece chirale e posso fare 2^n stereoisomeri (ovvero 4); tra questi quattro si
forma tuttavia solo l'isocitrato poiché questa reazione è STEREOSELETTIVA e REVERSIBILE
(molte reazioni enzimatiche lo sono).
L'enzima, in questo caso, reagisce solo sull'isocitrato per dare citrato: la reazione è
STEREOSPECIFICA
COO-
CH2
HO-C-COO
1
I
CH2
1
COO-
Citrate
--- > stereoselettiva
COO-
1
CH2
1
H-C-COO-
aconitase
HO-C-H
1
Stereospecifica <---
COO-
Isocitrate
L'enzima è in grado di riconoscere gruppi uguali in molecole prochirali. Bastano 3 punti di
contatto tra enzima e substrato per permettere all'enzima di capire se la molecola è chiarale o
achirale --- > l'enzima è in grado di riconoscere due gruppi uguali di molecole prochirali -orientati
in modo diverso nello spazio -.
CH,COO
C
HO
CH,COO
coo
1
Enzyme
- L'orientamento dei substrati determina la stereoselettività della reazione: permette
all'enzima di selezionare diversi stereoisomeri rispetto a quelli possibili.
Alcuni enzimi sono più permissivi
O
RC-NHR' + H2O
chymotrypsin
=
0
+ RC-0- + H3NR'
+
-- > reazione principale e
fisiologica
Peptide
RC-NHR' + H2O
RC-0- + H3NR'
fisiologica
Nell'attività principale l'enzima è più efficiente.
Cofattori enzimatici
Alcuni enzimi necessitano di cofattori
Cofattori
Ioni metallici
Coenzimi
Il cofattore è sempre legato (come
nell'emoglobina)
Co-substrati
Gruppi prostetici
ESEMPIO -importante per esame- : Come può funzionare un cofattore
NAD+ e NADH
NAD+
NADH
H
O
H.
H
O
o
NH2
NH2
o=P-O
o=P-O.
N
o Alnello Nicotinammidico
O
O
OH OH
NH2
NH2
N
N
N
o=P-O
N
N
adenina
OH OH
OH OH
Il cofattore NAD:
Nicotinammideadeninadinucleotide
- Anello nicotinammido
- 2 Adenine + zucchero +
fosfato
NAD+= stato ossidato che riceve i
due elettroni dal substrato e si
trasforma in
NADH= stato ridotto
(e viceversa: il NADH si ossida per
diventare NAD+)
Nella forma ridotta abbiamo 3 legami nell'anello nicotinammidico: l'azoto è neutro ed ho un H in
più
Nella forma ossidata abbiamo 4 legami
Ossido-riduzione --- >
Donatore
di idruro
O
H
C.
NH2
-NH2
N
I
R
R
NAPH
NAD+
Accettore
di idruro
O
H
H
II
C.
NO
0
0
ǁ
RC-OR' + H2O
Ester
chymotrypsin
H+
+ RC-0- + HOR'
-- > reazione accessoria
secondaria, possibile su
altri substrati
Peptide
C
OH OH
O=P
O
Da NAPH a NAD+ lo ione idruro viene ceduto ad una molecola che si ossida
Alcol deidrogenasi: sfrutta l'ossido-riduzione di NAD+ e NADPH
L'alcol si riduce in aldeide
Classificazione degli enzimi (EC)
Class
Reaction type
Important subclasses
Esempio
- Ossidoreduttasi
00
ro
+
+
Ared
Box
Aox
Bred
Deidrogenasi
Ossidasi
Reduttasi
Perossidasi
Alcol
deidrogenasi
1.1.1.1 - Transferasi
A-B
C
A
B-C
Glicosiltransferasi
Aminotransferasi
Fosfotransferasi
Aspartato
transaminasi
2.6.1.1 - Idrolasi
A-B
H20
A-H
B-OH
Esterasi
Glicosidasi
Peptidasi
Peptidasi K
3.4.21.64 - Liasi
("sintasi")
A
B
A-B
C-C liasi
C-O liasi
C-N liasi
C-S liasi
Piruvato
decarbossilasi
4.1.1.1 - Isomerasi
Alanina racemasi
5.1.1.1 - Ligasi
("sintetasi")
B
X-A.G.U.C
XDP
C-C ligasi
C-O ligasi
Serina
tRNA-ligasi
6.1.1.7
A
A-B
La prima cifra della serie presenti identificano le classi ed è importante conoscerli (es: 1 per
ossidoreduttasi, 2 per transferasi ecc.)
- Il gruppo in giallo viene trasferito da una molecola all'altra della reazione
- Tutte le volte che l'acqua partecipa ad una reazione e scinde un legame
- Fusione di una molecola senza l'uso di ATP
- Isomerizzazione di un composto (non cambia la formula ma la disposizione degli atomi
nella molecola) i "racemasi" sono gli enzimi che convertono gli enantiomeri --- > da uno
stereoisomero all'altro)
- Gli enzimi hanno tutti un suffisso comune "-asi" e nel nome troviamo il ruolo che compie
l'enzima nelle reazioni.
ES:
COO-
Racemasi EC 5 --- > enantiomeri dell'alanina
H-C-CH3 -+H3C-C-H
ŃHỆ
COO-
-
C=0 + H+
C=0 + 0=C=0
H
1
CH3
Liasi EC 4 --- > piruvato decarbossilasi
CH3
A
Iso-A
Epimerasi
Racemasi
cis-trans isomerasi
+
XTP
C-N ligasi
C-S ligasi
-
NHẸ
COO-
O = Reduction equivalent
COO
C=0 + NADH + H+
HO-C-H + NAD+
Ossidoriduttasi EC 1 --- >
lattato deidrogenasi
CH3
Lattato
COO
H-C-(CH2)2-C
NHỊ
.0
+ ATP + NHỆ
0
-
H-C-(CH2)2-C
NH+
COO-
NH2
O
+ ADP + P;
EC 6 --- > glutammina
sintetasi
Da glutammato a
glutammina
Diagramma dello stato di transizione
x+dagger
AG+
G
A + B
AGreaction
1
P + Q
Reaction coordinate
AG= energia libera di Gibbs
In questo caso dal punto di vista termodinamico sono favoriti i prodotti poiché hanno un livello
energetico più basso
Se il AG dagger è alto la reazione avverrà più lentamente; se è basso avverrà più velocemente
(importante quindi per la cinetica della reazione).
Il catalizzatore abbassa infatti il AG dagger - energia libera di attivazione- rendendo la reazione
più veloce.
X
+
Uncatalyzed
AAG
Gcat
(the reduction
in AG+ by the
catalyst)
AG+
AGB
+
cat
G
Catalyzed
S
P
P + Q
A + B =>P+Q
Coordinata di reazione
Reaction coordinate
L'enzima riduce AG dagger stabilizzando lo stato di transizione. Il complesso enzima substrato
stabilizza lo stato di transizione, abbassa la sua energia. L'enzima viene poi rilasciato.
AAG è la differenza del AG della reazione catalizzata ed il AG della reazione catalizzata: più 44G è
alto più la capacità dell'enzima di velocizzare la reazione è alta.
Calcolo diminuzione energia di attivazione
PROBLEMA
Considerato che l'aumento della velocità della reazione catalizzata è
K
Energia libera, G
non cat
-- ES -EP
A + B
COO
CH3℮44G#cat/RT
= 100 ( aumento di 100 volte)
R (costante dei gas) = 8,3145 J K-1 mol-1
T = temperatura assoluta (K) = 273 + °℃
Calcolare la diminuzione di energia di attivazione necessario per accelerare di 100 volte una
reazione a 25℃ (298K).
- ΔΔG / RT = In (100)
44G= In(100)x 8,314 x298=11.409,64070803889 (11,4 kJ)
-energia di un singolo legame H= 20 kJ
Meccanismi di catalisi enzimatica
- Catalisi acido-base (generale)
- Catalisi covalente (generale)
- Catalisi da metalli (specifico)
- Effetti di vicinanza e orientamento (specifico)
- Legame preferenziale allo stato di transizione (specifico)
Reagenti (legame)
Catalizzatore
La prossimità
e l'orientazione
favoriscono
la formazione
dello stato
di transizione:
--- > effetti di vicinanza e orientamento
Stato di transizione
Forte legame
allo stato
di transizione:
--- > stabilizzazione dello stato di transizione
L'enzima seleziona particolari conformazioni delle molecole così
che sia più facile passare allo stato di transizione (meccanismo
di catalisi generale)
Catalisi acido-base generale
Presente in tanti reazioni enzimatiche; ricorda le reazioni acido-base comuni alla chimica
ma con una differenza: la catalisi chimica è o acida o basica, nella catalisi enzimatica posso
avere invece entrambe contemporaneamente.
Ket
Transition state
Enol
R
R
R
(a)
Ca
C-0-H
CH2
CH
CH
O
RNA
His 12 acts as a
general base and
His 119 as a
general acid to
promote
...- O-A=0
Base
Ħ
H
R
R
R
H
ŃH
(b)
C=0 + H-
C-Of -- Het-A5-
C-O-H + A"
H
0
0
-H
ŇH
0
0
His 12
0-P-O-CH2
0
Base
=O
H
H
0-
-H
R
TA
R
R
HO
HO-CH2_O.
Base
H
(c)
+
C-0-H
0-P=
=0
H
H
H
H
CH2
CH,
His 119
0
0
OH
+
på+
R+
0
L'RNA viene tagliato idrolizzando il legame fosfodiesterico; questa reazione è favorita dall'OH in
2'; se questo ossigeno perde il protone può fare attacco nucleofilo sul fosfato (il DNA è infatti
molto più stabile dell'RNA essendo deossiriboso)
L'His 12 agisce da base; abbiamo un'altra istidina, ovvero l'His 119 che agisce da acido.
È possibile dunque sia catalisi enzimatica basica che acida. Il Pka è dipendente dall'intorno
2',3'-Cyclic nucleotide
OCH
Base
nucleophilic attack
and bond cleavage.
1
H
H
i+
~H2O
CH
CH
H
H-A +OHT
C=0
+
H
H
H
...
-0-P
=0
H
0-P
0-P-
0
H
H
CH
H
Prodotti (rilascio)