Proteínas: definición, estructura y funciones esenciales en biología
Diapositivas de Dra. María Fernanda Alves Rosa sobre Proteínas. El Pdf explora la definición, clasificación y las diversas estructuras proteicas, desde la primaria hasta la cuaternaria. Este material de Biología para Universidad, con ejemplos visuales y explicaciones detalladas, es ideal para el estudio autónomo.
Ver más25 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
PROTEINAS
Medicina Dra. María Fernanda Alves Rosa
Proteínas en Alimentos
Peixe 200 g Cirre 170 g Queijo 110 g 30 g de proteinas animale Marisco 100 g Leite de vaca 860 g Aves 180 g Ovos 285 g
¿Qué son las proteínas?
V Macromoléculas -> Polímeros de aminoácidos. Componentes nitrogenados muy importantes. V Proteínas de la dieta -> formación de nuevos tejidos o para el reemplazo. v Ubicación : carnes rojas, pescado, huevo, leguminosas, lácteos.
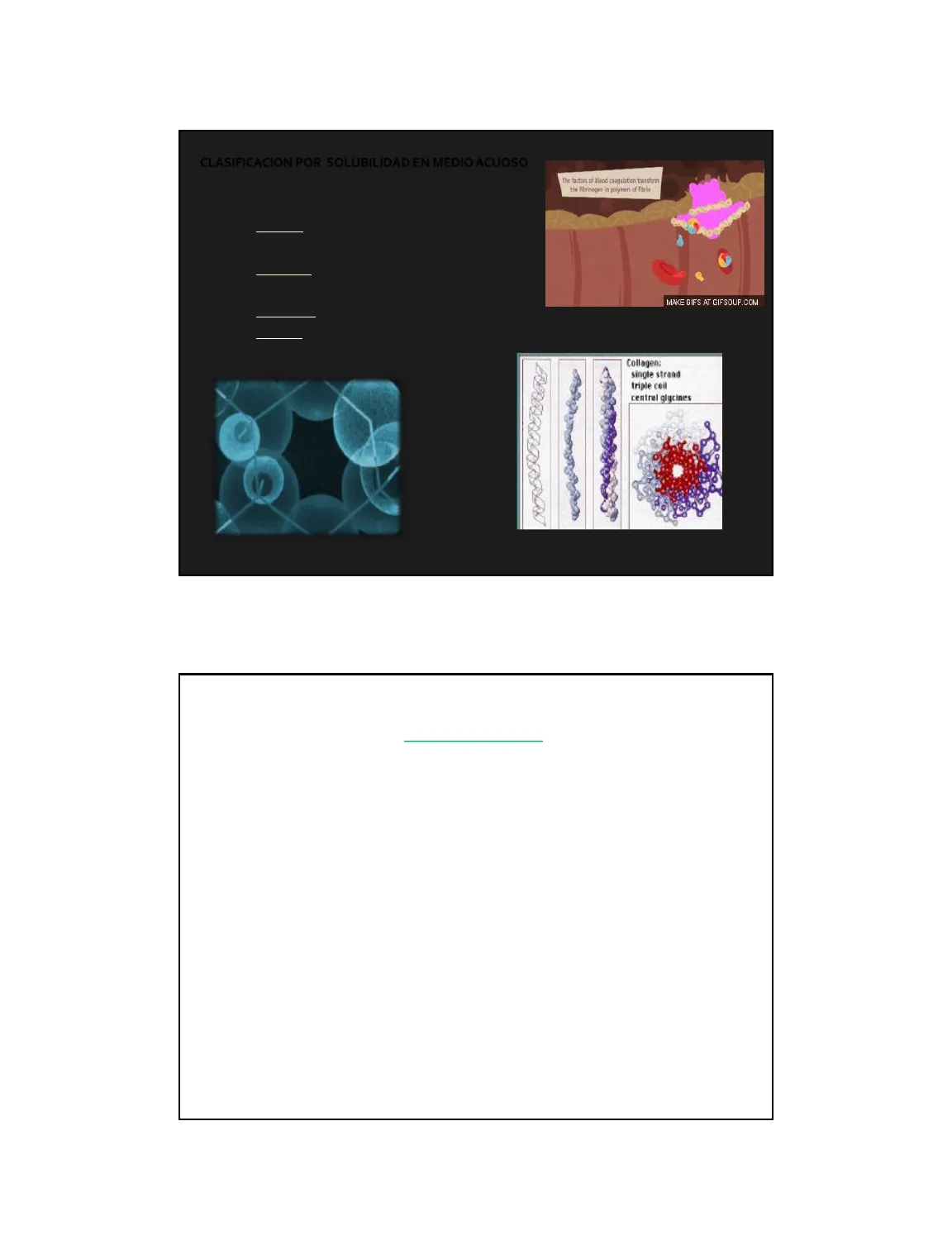
Clasificación de Proteínas por Solubilidad y Forma
Solubilidad en Medio Acuoso
The factors of blood coagulation transform the fibrinogen in polymer of fibrin
- Solubilidad en H2O
- Solubles: Fibrinogeno (precursor de fibrina) + trombina + Ca2+ -> redes
- Insolubles: Fibrina
Forma de las Proteínas
MAKE GIFS AT GIFSOUP.COM
- Globulares (esféricas) -> Insulina y Albúmina.
- Fibrosas (alargadas): Colágeno y Queratina, Fibrinogeno.
Collagen: single strand triple ceil central glycines
Clasificación de Proteínas Según Función
- Catalítica: (enzimas i.e .: Isomerasas, polimerasas, fosfolipasas)
- Transporte: llevar y traer moléculas (Hemoglobina)
- Estructurales: A nivel de membrana celular -> transporte -> i.e: canales de glucosa ie .: SGLUT, GLUT4, GLUT 1, etc. Bombas i.e Na/K, Ca2+
- Protección: sistema inmunológico (anticuerpos o Inmunoglobulinas)
- Reguladoras:
- Parte externa de la membrana plasmática -> sitios de reconocimiento (Receptores de insulina)
- Secretadas -> Insulina.
Tipos de Proteínas y Ejemplos
| Tipos | Ejemplos | Localización o función |
| Enzimas | ADN polimerasa | Cataliza la síntesis de ácidos nucleicos. |
| Reserva | Ovoalbúmina | Clara de huevo. |
| Transportadoras | Hemoglobina/ Albumina | Transporta el oxígeno en la sangre/ proteínas, hormonas, acidos grasos libres |
| Protectoras | Anticuerpos | Bloquean a sustancias extrañas. |
| Hormonas | Insulina | Regula el metabolismo de la glucosa. |
| Estructurales | Colágeno | Tendones, cartílagos, cabello. |
| Contráctiles | Miosina | Constituyente de las fibras musculares |
¿Cómo están compuestas las proteínas?
Los Aminoácidos
► Proteínas-> polímeros de aminoácidos. ► Aminoácidos -> compuestos orgánicos que tienen un grupo carboxílico y un grupo amino. En solución acuosa -> Comportamiento anfótero (pueden ionizarse, dependiendo del pH) -> puede actuar como base o como ácido. En el cuerpo humano existen 20 aminoacidos, siendo 10 esenciales (no pueden ser sintetizados por el organismo. ► Aminoácidos -> incorporacion al organismo a través de los alimentos.
Genérico Amina Carboxilo C~OH H2N. C ? R H HOOC CH3 H-C-CH CH3 NH3+ Valina Val V
Aminoácidos -> unión por enlace peptídico -> OH del grupo carboxílico del aa1 y el H del grupo amino del aa2 -> dipéptido + H2O.
Aminoácidos Esenciales y No Esenciales
| AMINOACIDOS ESENCIALES | AMINOACIDOS NO ESENCIALES |
|---|---|
| Fenilalanina | Glicina |
| Isoleucina | Serina |
| Lisina | Asparagina |
| Metionina | Tirosina |
| Treonina | Cisteína |
| Valina | Acido aspártico |
| Triptófano | Acido glutámico |
| Arginina | Prolina |
| Histidina | Alanina |
| Leucina | Glutamina |
Reacción de Formación del Enlace Peptídico
H O H C O= H-N-C-CFO-H| I + H+N-C-C-O-H HR HR Aminoácido 1 Aminoácido 2 H2O H O 1 H-N-C-+ -C-C-O-H Z-I H R1 I-0-02 0=0 R2 dipéptido
Clasificación de los Enlaces Peptídicos
Oligopéptidos
A. Oligopéptidos: el nº de aminoácidos es menor de 10.
- Dipéptidos: nº de aminoácidos es 2.
- Tripeptidos: nº de aminoácidos es 3.
- Tetrapéptidos: nº de aminoácidos es 4.
Polipéptidos o Cadenas Polipeptídicas
B. Polipéptidos o cadenas polipeptídicas el nº de aminoácidos es mayor de 10.
Clases de Aminoácidos
Aminoácidos No Polares
Alanina O O H2N C- H2N C-OH C H H H C C H H Cisteína No polar Amina || Carboxilo C~OH O O ? R H HẸN C-OH H2N C-OH H H C Básico C O C H C H Acido OH -NH Histidina C Acido Aspartico H+N=C C H Genérico HS H O Polar H2N. C C C H H OH
Metionina O Glicina Aminoácidos no polares H2N GOH GOH C C H O H H H Valina LeucinaO H C H2M C- -OH H2M C OH S H H2N C~OH CH H H3Ć C H3C C H3C ~CH3 H- Triptofano C - H2M C~OH H H H3C CH3 C H Fenilalanina Isoleucina H2M C OH H2M C~OH H Prolina H H3G - NH C-OH H H H2O C H H H3C H H2C-CH2
Aminoácidos Polares
O O Tirosina Treonina H2M C OH H2M C H2M OH C H H. C H - CH3 C OH H H HO GlutaminaO Cisteina O Asparragina H2M C- H2M C OH H2M C OH H H H H C C HS H O=C H O=C H NH2 NH2 O Serina C- ·OH C H- H H C C-H HO C 0-11 H C H C -C C H HON+ C C O G H C C H O H H H C O H C C H Alanina O C H C
Aminoácidos Ácidos
O H2N C- OH CAminoácidos ácidos Ácido aspartico O O H2N C~OH H2M C~OH C H C H C H. C O_C H C H 0=C H Ácido glutámico OH
Aminoácidos Básicos
Histidina O H2M C~OH O Lisina C H H2M C OH C O C C ·OH C H H+N=C H C H H H TH C +H3N C H N H +H2N=C H NH2 H C-H Arginina NH H H2M C C H - -0- C-H H\ H H-C-H C C H H H OH
Niveles de Organización Proteica
Estructura Primaria
Secuencia lineal de aa. en la proteína 5 4 3 2 1
Estructura Secundaria
- Enlaces de H entre los aminoacidos de la estructura primaria -> formación de láminas plegadas ß y hélices a.
Estructura Terciaria
► Plegamiento de las laminas ß y hélices a -> acción de los grupos funcionales R
Estructura Cuaternaria
► Asociación de más de un polipéptido dentro de un complejo proteico influenciado por los grupos funcionales R
Niveles de Organización Proteica: Detalles
La Estructura Primaria
Met-Gly-Ala-Pro-His-Ile-Asp-Glu-Met-Ser-Thr -... · La sustitución de un solo aminoácido altera la función proteica* · Cambios en esta estructura origina una proteína diferente y puede ocasionar enfermedades ( por ejemplo: Anemia falciforme). · Donde se encuentra almacenada la información de la estructura primaria de una proteina S S A Chain Gły Ile Val Glu Gin Cys Cys Ala Ser Val Cys Ser Leu Leu Glu Asn Tyr Cys Asn S 5 I 1 S S Phe Val Asn Gin His Leu Cys Gly Ser Leu Val Glu Ala Leu Tyr Val Cys Glu B Chain Arg Gly Ala Lys Pro Tyr Phe Phe insulina
Rnam- APM Tyr Gin His Leuribosome key signal peptide B-chain peptide dibasic cleavage peptides C peptide A-chain peptide signal sequence chain B N-ter- S Š S -C-ter preproinsulin Š chain A cytosol chain C higgshivealy slyqle 2. folding, oxidation and signal peptide cleavage signal sequence N-ter $ $ S $ proinsulin S Š chain A 3. ER export, Golgi transport, vesicle packaging Golgi chain C 4.protease cleavage liberates C-peptide funghiggshivealylvege; secretory vesicle Š $ $ -C-ter insulin S chain A C-ter N-ter @2004 Beta Cell Biology Consortium http://mol-biol4masters.masters.grkraj.org/html/Co_and_Post_Translational_Events1- Precursor_&_Polyproteins.htm
La Estructura Secundaria
1 no edtayes puntos funcionales El esqueleto peptídico tiene regiones de densidad (8) de carga negativas o positivas La áreas de cargas opuestas pueden interaccionar y formar puentes de H. Formación de puentes de Hidrógeno entre C=O (Carbonilos de un aa.) y el H-N (amino de otro aa). Las estructuras resultantes son: - Láminas plegadas ß - hélices a R H H 0 R - = 1 NH2- CR- C+N- Cx- C++N-Cx- NH2 H R H ! H Atracción por cargas que demuestra un giro. N-ter chain B weaccisigstyalenycn tvnghicgshivealylvege) givenccisicslyglenyen 5. carboxypeptidase E produces mature insulin tynghicgshivealylegge ¿Etnicstygianyen gqvelgggpgagsiqplalegsiqkrgiveqectsicsly malwmrilpilallalwgpdpaa sec61 translocon 1. translation and translocation sakrgiveqceist is6868d666janb chain B ER lumen DC-ter chain C involucrado
Secondary Protein Structure Val His Thr a-helix I-0-₡ \ 1 ß-pleated sheet 2-I ... 0=0 H 1 C 1 R O R O= I- U I -( I - 0=0 I-2 RIC-H I-0-₡ I-Z 1 0 Z I R DEO. .. I-Z Z-I. . . O=U R H I R I I 1 1 I 1 1 I CNCN-C U I I H H R H O Lámina plegada ß O O O O H H H H C N / N N N C C- C C N C N N C N C H H H H O O O O O O O O H C C C C N C C N C N C N C C H O O H O Z-I· · · 0=0 0 R H H -I ... O=0 -I. .. O=0 VEO . .. I-Z I-0-2 1 1 R I H H R 0 . R H -N-C- = 1 I -I H I R Z-I Z-I I-0-2 R Carbo xi terminal de la proteina Z-I. . . 0=0 0= H RICIH C C C C C C C C N C N C N C N C C C H H H H C
La Estructura Secundaria: Lámina Plegada ß
10La estructura secundaria. La lámina plegada ß O O O O H H H H C C N N N C N C C C C C C- C. C C N C N C N C H H H H O O O O O O O H O H C N C N C N C N N C C N C C N C C N C C H H O O H O O O O O H H H H C- N C. N C N N C. C C N C N C H H H H H O involucrada
Estructuras Terciarias y Factores
(Los grupos Funcionales) Hydrophobic interactions (clustering of hydrophobic groups away from water) and van der Waals interactions CH CH2 HĘĆ CH3 Polypeptide backbone O CH3 H CH 0 C-OH -CH2-S-S CH2 Disulfide bridge O -CH2-CH2-CH2-CH2-NH3+ -OC-CH2- Ionic bond Copyright O Pearson Education, Inc., publishing as Benjamin Cummings, (c) Tertiary structure Heme Estructuras terciarias redondeada y compacta -> aspecto globular. He fibrosa y alargada. ₿ polypeptide La conformación espacial de la proteína condiciona su función biológica. hemoglobina > 4 cadena peptidicas 2 & 2B Subunidad La estructura terciaria estan · Forma que adopta en el espacio una proteína -> Plegamiento de las estructuras secundarias (hélices a y láminas plegadas ₿) · Factores que influencian la estructura 3ria .: 1. Interacciones hidrofóbicas / hidrofílicas. 2. Puentes de Hidrógeno (H-H) 3. Puentes disulfuro entre cisteínas (S-S). C C C N C N C O O O C C C C O H C C C HỌC Hydrogen bond CH2 4. Uniones iónicas
C -N N H H
Polypeptide backbone 0 CH2 -CH2-CH2- CH2-CH2-NH3+ 0-C-CH2 lonic bond 0 H Hydrogen bond 0 Il C - NH2 1 CH /1 Dissulfide linkage CH2 H3C H3C CH3 CH3 CH -5 Hydrophobic interactions Bacteriorhodopsin Alpha helix )Camina Plusoda beta GREEN FLUORESCENT PROTEIN (Estructura terciaria) Beta sheet
12 51 cadena Cadena Meptida Estructura terciaria A ribbon diagram of the protein Lsd19, which catalyzes the formation of six- membered rings in lasalocid. (Image by Kinya Hotta) G-3-P Deshidrogenasa de Bacillus stearothermophilus
La Estructura Cuaternaria
► Resultante de la interacción de cadenas de polipéptidos independientes. Factores que influencian la formación de estas estructuras: Interacciones hidrofóbicas / hidrofílicas entre aa .. Formación de puentes de Hidrógeno. La forma y distribución de cargas de los polipéptidos que la componen. Polypeptide chain B Chain Iron a Chain Heme (a) Collagen (b) Hemoglobin Copyright & Pearson Education, Inc., pålisting as Erjuin Cummings
Plegamiento de Proteínas
Protein Folding - LabXchange Pleated sheet Primary protein structure is sequence of a chain of amino acids Amino Acids Tertiary protein structure occurs when certain attractions are present between alpha helices and pleated sheets. - Alpha helix Pleated sheet Alpha helix Secondary protein structure occurs when the sequence of amino acids are linked by hydrogen bonds Quaternary protein structure is a protein consisting of more than one amino acid chain. V EMLA Q A DOL
Niveles de Estructura Proteica
Primary Secondary Tertiary Quaternary todas las Proteinas Con estructura Quaternaria tienen terciario Pero no todas. lassenterciardernar LEVELS OF PROTEIN STRUCTURE Primary Structure HO 0 C H Secondary Structure C-C-N I-Z H 0 H 0 H H c-C- N- C-C N-C N N C C C 0 H CON-C 0 0 U=0 C CN 0 N IN C -N H C N .0 H CON-C CN Ö 0 a-Helix ---- Tertiary Structure Quaternary Structure Lubrizol Life Science C C HO OZO-I-Z IOC H C C C C C-CN H 0 H 0 C ß-Sheet H H. O C C-C-NG O I-Z C-N