Il metabolismo energetico: dal glucosio all'ATP, appunti di Goodnotes
Documento di Goodnotes sul metabolismo energetico, dal glucosio all'ATP. Il Pdf, utile per lo studio universitario di Biologia, descrive le funzioni e le fasi del metabolismo, approfondendo glicolisi e respirazione cellulare con schemi e reazioni chimiche dettagliate.
Mostra di più32 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Il Metabolismo Energetico
IL METABOLISMO ENERGETICO -> dal glucosio all'ATP metabolismo -> insieme delle reazioni chimiche -> che degradano e sintetizzano le biomolecole cellulari -> in modo coordinato e integrato
Funzioni Principali del Metabolismo
- energia -> entra in funzione nella cellula -> attraverso la degradazione di sostanze nutrienti
- conversione di nutrienti -> in molecole utili per la cellula
- sintesi -> di macromolecole e polimeri -> a partire da precursori
Fasi del Metabolismo: Catabolismo e Anabolismo
metabolismo -> costituito da 2 fasi distinte ma interconnesse ->
- catabolismo -> libera energia degradando -> carboidrati acidi grassi O amminoacidi porta alla formazione di prodotti di rifiuto (CO2, H2O, scorie azotate) -> da molecole complesse a semplici -> si libera energia perchè rompe i legami delle molecole
- anabolismo -> assorbe energia per svolgere reazioni di sintesi e condensazione all'interno delle cellule -> da molecole semplici a complesse -> richiede energia per formare i legami tra le molecole
Vie Metaboliche
reazioni del metabolismo -> organizzate in vie metaboliche -> sequenze di reazioni chimiche catalizzate da enzimi -> in cui il prodotto della prima reazione è il reagente della seconda -> il prodotto di questa è il reagente della terza e così via fino al prodotto finale le vie metaboliche sono ->
- convergenti -> vie cataboliche
- divergenti -> vie anaboliche
- cicliche -> vie del metabolismo terminale
Carboidrati Numerose biomolecole Lipidi Acetil-CoA Pochi precursori (amminoacidi, acidi grassi, monosaccaridi, basi azotate, ecc.) Proteine Ciclo di Krebs CO2 Catabolismo 7 Metabolismo terminale Anabolismo 7 convergente ciclico divergente Made with Goodnotes
ATP: Fonte di Energia Cellulare
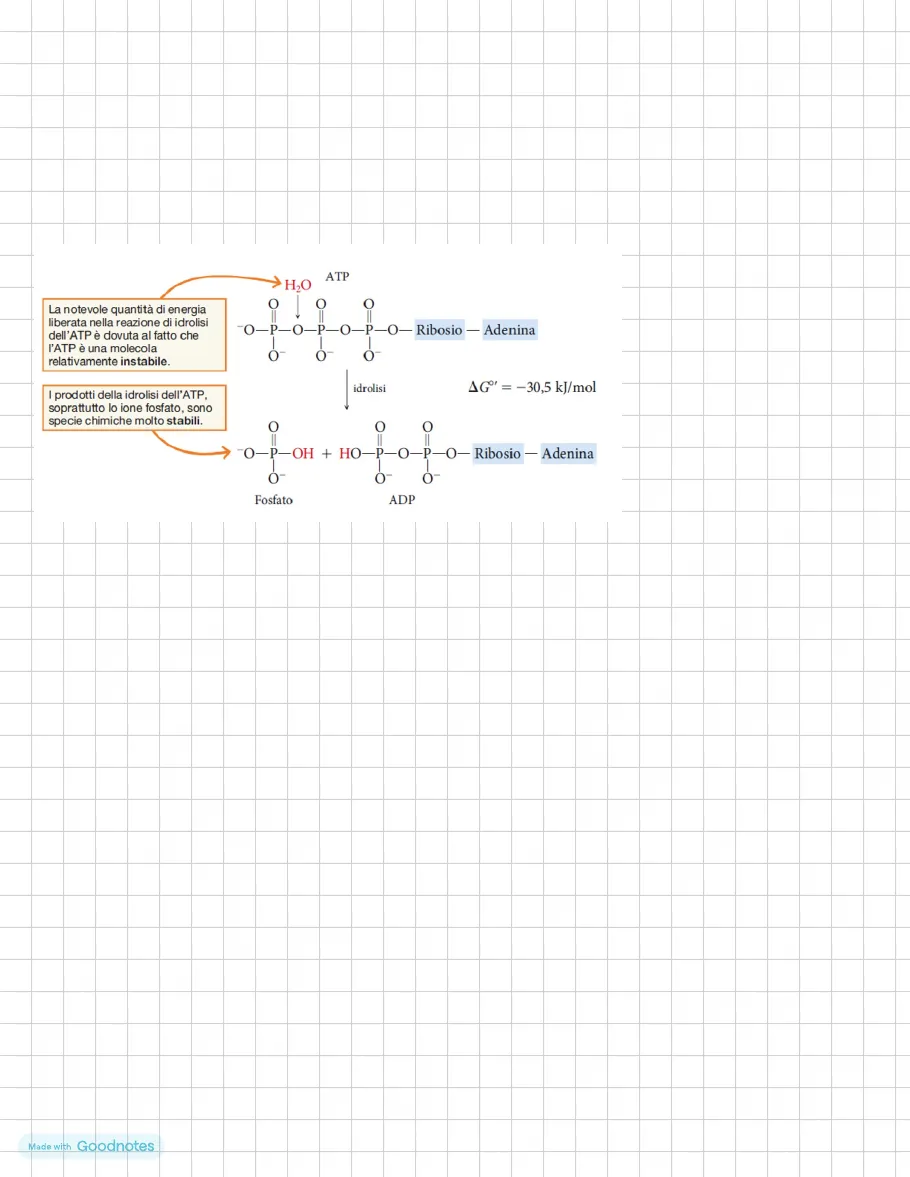
ATP -> principale fonte di energia per le reazioni metaboliche -> è una molecola ad alta energia di idrolisi -> legame tra il secondo e il terzo gruppo fosfato -> legame che racchiude dentro moltissima energia potenziale -> quando viene rotto libera tanta energia -> l'ATP è una molecola energetica.
> H2O ATP O La notevole quantità di energia liberata nella reazione di idrolisi dell'ATP è dovuta al fatto che l'ATP è una molecola relativamente instabile. O O "O-P-O-P-O-P-O- Ribosio - Adenina C I prodotti della idrolisi dell'ATP, soprattutto lo ione fosfato, sono specie chimiche molto stabili. O O idrolisi AGº' = - 30,5 kJ/mol 0 O "O-P-OH + HO-P-O-P-O-Ribosio - Adenina O Fosfato ADP
Energia Libera e Accoppiamento Energetico
deltaG è la quantità energia liberata necessaria per compiere un lavoro -> AG = G stato finale - G stato iniziale molte reazioni cataboliche -> sono reazioni esoergoniche -> possono avvenire spontaneamente -> deltaG < 0 -> liberazione netta di Energia molte reazioni anaboliche -> sono endoergoniche -> assorbimento di E libera dall'ambiente -> deltaG > 0 -> non sono reazioni spontanee e richiedono un apporto di E per avvenire -> queste reazioni possono svolgersi perchè sono accoppiate a reazioni esoergoniche -> ACCOPPIAMENTO ENERGETICO -> processo esoergonico che libera E viene sfruttato per realizzare un altro endoergonico che la richiede. esempio -> C6H12O6 + 6 O2 -> 6 CO2 + 6H2O -> distruzione del glucosio -> libera E e prodotti di scarto -> reazione opposta sarà endoergonica -> per costruire glucosio servirà E. Made with Goodnotes
A In una reazione esoergonica i reagenti si comportano come una pallina che scivola giù da un pendio: i reagenti si trasformano in prodotti a contenuto energetico minore e si sprigiona energia. B Come per spingere una pallina in salita, in una reazione endoergonica è necessario un apporto di energia, perché i reagenti si trasformano in prodotti a maggior contenuto energetico. reagenti energia libera quantità di energia sprigionata AG < 0 prodotti andamento della reazione nel tempo andamento della reazione nel tempo energia libera quantità di energia da fornire AG >0 1 reagenti andamento della reazione nel tempo andamento della reazione nel tempo
Enzimi: Catalizzatori Biologici
enzima -> proteina che agisce come catalizzatore -> acceleratore di velocità di reazioni -> senza essere consumato dalla stessa investimento energetico iniziale affinché una reazione possa innescarsi -> ENERGIA LIBERA DI ATTIVAZIONE (Ea) l'enzima accelera la reazione riducendo l'energia di attivazione, ovvero l'altezza della curva iniziale. energia di attivazione è fornita spesso come E termica -> che aumenta la velocità delle molecole dei reagenti -> aumentando così frequenza e forza di collisioni dunque la probabilità di rottura dei legami. Quando le molecole hanno assorbito sufficiente E perché i legami si spezzino -> i reagenti si trovano in una condizione INSTABILE detta STATO DI TRANSIZIONE (nella curva è l'apice) -> detto COMPLESSO ATTIVATO -> necessario avere molta energia interna alla molecola per dar luogo a una reazione chimica
€ in assenza dell'enzima in presenza dell enzima energia di attivazione in assenza dell'enzima energia energia di attivazione in presenza dell'enzima reagenti energia complessiva rilasciata durante la reazione prodotti coordinate di reazione Made with Goodnotes prodotti
Specificità e Meccanismo d'Azione degli Enzimi
reagente su cui agisce l'enzima -> substrato dell'enzima -> un enzima riconosce il substrato anche tra molecole simili la specificità dell'enzima dipende da ->
- sua forma 3D
- sua porzione che lega il substrato -> detto sito attivo -> si presenta come una tasca o solco
Substrato L'enzima cambia conformazione man mano che il substrato si lega Prodotti Sito attivo 5 Ingresso del substrato nel sito attivo dell'enzima Complesso enzima-substrato Complesso enzima-prodotti Uscita dei prodotti dal sito attivo dell'enzima
Catalisi nel Sito Attivo
catalisi nel sito attivo di un enzima ->
- substrato entra nel sito attivo e induce un cambiamento nella forma dell'enzima
- substrato lega il sito attivo attraverso legami H e ionici
- i gruppi R di amminoacidi del sito attivo catalizzano la trasformazione del substrato in prodotto
- il prodotto lascia il sito attivo
- l'enzima è libero di legare un'altra molecola di substrato sul suo sito attivo -> un enzima può convertire 1 o + molecole di reagenti in 1 o + molecole di prodotto
Meccanismi per Abbassare l'Energia di Attivazione
meccanismo per abbassare l'E di attivazione e aumentare la velocità di reazione ->
- nel sito attivo i substrati sono orientati nel modo più idoneo per far avvenire la reazione
- l'enzima deforma i substrati facendogli raggiungere la forma che avrebbero nello stato di transizione
- valori di pH controllati dal sito attivo localmente
- gli amminoacidi del sito attivo partecipano attivamente alla reazione con formazione di legami transitori tra essi e il substrato Made with Goodnotes
Classi Enzimatiche
6 classi enzimatiche -> a seconda del tipo di reazione che catalizzano ->
- OSSIDOREDUTTASI -> reazioni redox -> es. deidrogenasi, ossidasi
- TRANSFERASI -> reazioni di trasferimento di gruppi funzionali -> es. trans amina si
- IDROLASI -> reazioni di idrolisi -> es. fosfatasi, amilasi
- LIASI -> rottura di doppi legami per addizione di gruppi funzionali o formazione di doppi legami per eliminarli -> es. sintesi, decarbossilasi
- ISOMERASI -> formazione di isomeri -> es. mutasi
- LIGASI -> formazione di legami -> es. sintasi
Fattori che Influenzano l'Attività Enzimatica
l'attività degli enzimi è influenzata da diversi fattori ->
- effetto della temperatura -> la velocità di una reazione enzimatica aumenta all'aumentare della temperatura per il maggior numero di collisioni che si verificano -> tuttavia oltre certi valori si deforma l'enzima e la reazione cessa di esistere -> ogni enzima ha una temperatura ideale di lavoro -> detta optimum di reazione -> enzimi umani -> 37 C -> enzimi batteri termofili -> 77 C
- effetto del pH -> ogni enzima è caratterizzato da un pH al quale presenta la massima attività -> i valori di pH ottimali cadono solitamente tra 6 e 8 -> tuttavia ci sono note eccezioni -> pepsina -> pH = 2 -> (stomaco) -> tripsina -> pH = 8 -> (intestino)
Papain Cholinesterase Kelative activity Trypsin Pepsin Made with Goodnotes 2 4 6 8 10 pH
Concentrazione del Substrato e dell'Enzima
effetto della concentrazione del substrato -> tanto più sono disponibili molecole come substrato tanto più aumenta la probabilità che entrino nel sito attivo degli enzimi -> una maggiore concentrazione di substrato determina un aumento della velocità di reazione Curva tende ad un asintoto -> limite alla velocità massima (Vmax) della reazione che può essere raggiunta aggiungendo un substrato a una quantità fissa di enzima -> si raggiunge un punto in cui la [substrato] è tale da occupare tutti i siti attivi degli enzimi -> SATURAZIONE DEGLI ENZIMI -> la velocità diventa quella in cui l'enzima trasforma il substrato in prodotto prima di liberarsi nuovamente.
Velocità iniziale (Viniz) -> Cinetica di ordine zero (la velocità non dipende dalla concentrazione del substrato) Cinetica di primo ordine (la velocità dipende dalla concentrazione del substrato) Concentrazione del substrato [S] effetto della concentrazione dell'enzima -> quando le molecole enzimatiche sono sature di substrato -> l'unico modo per aumentare la velocità si reazione è aggiungere altro enzima -> andamento direttamente proporzionale -> retta nel grafico
Reaction rate Substrate concentration + Reaction rate -+ Enzyme concentration Made with Goodnotes
Cofattori e Coenzimi
COFATTORI E COENZIMI ->
- cofattori -> molecole inorganiche che aiutano gli enzimi
- coenzimi -> molecole organiche che aiutano gli enzimi
Ruolo dei Coenzimi
coenzimi -> molecole organiche non proteiche -> partecipano all'attività catalitica e possono legarsi al sito attivo dell'enzima in modo permanente o reversibile Alcuni enzimi posseggono cofattori inorganici ->
- METALLI (zinco, ferro, rame)
- altri posseggono cofattori organici detti COENZIMI -> trasportatori temporanei di specie chimiche -> elettroni, atomi, gruppi funzionali -> Esempi -> O vitamina B3 (niacina) -> precursore del coenzima NAD e NADP O vitamina B2 (riboflavina) -> precursore del FAD vitamina B5 (acido pantotenico) -> precursore del CoenzimaA (CoA)
- NAD -> coenzima usato per trasferire gli elettroni da una molecola all'altra nelle reazioni REDOX -> generalmente nelle vie cataboliche come la glicolisi -> esiste nella forma NAD+ OSSIDATA e NADH ridotta.
- FAD -> coenzima delle ossidoreduttasi che accetta fino a due protoni e due elettroni ->> nella forma ridotta FADH2 e nella ossidata FAD il FAD può acquistare anche un solo elettroni riducendosi a FADH.
- Coenzima A -> trasporta gruppi acetile nelle reazioni del Ciclo di Krebs trasformandosi in AcetilCoA
Inibitori Enzimatici
inibitori -> molecole in grado di inibire l'attività degli enzimi in modo reversibile o irreversibile -> nel secondo caso (irreversibile) l'enzima diventa inutilizzabile INIBITORI COMPETITIVI -> hanno la forma simile o uguale al substrato e si legano nel sito attivo dell'enzima che li riconosce erroneamente Made with Goodnotes