Struttura degli atomi multielettronici: energia e riempimento orbitali
Slide sulla struttura degli atomi multielettronici. Il Pdf esplora l'equazione di Schrödinger e le soluzioni approssimate, il riempimento degli orbitali 3d e 4s, e i lantanidi, per il corso di Chimica a livello universitario.
Mostra di più44 pagine
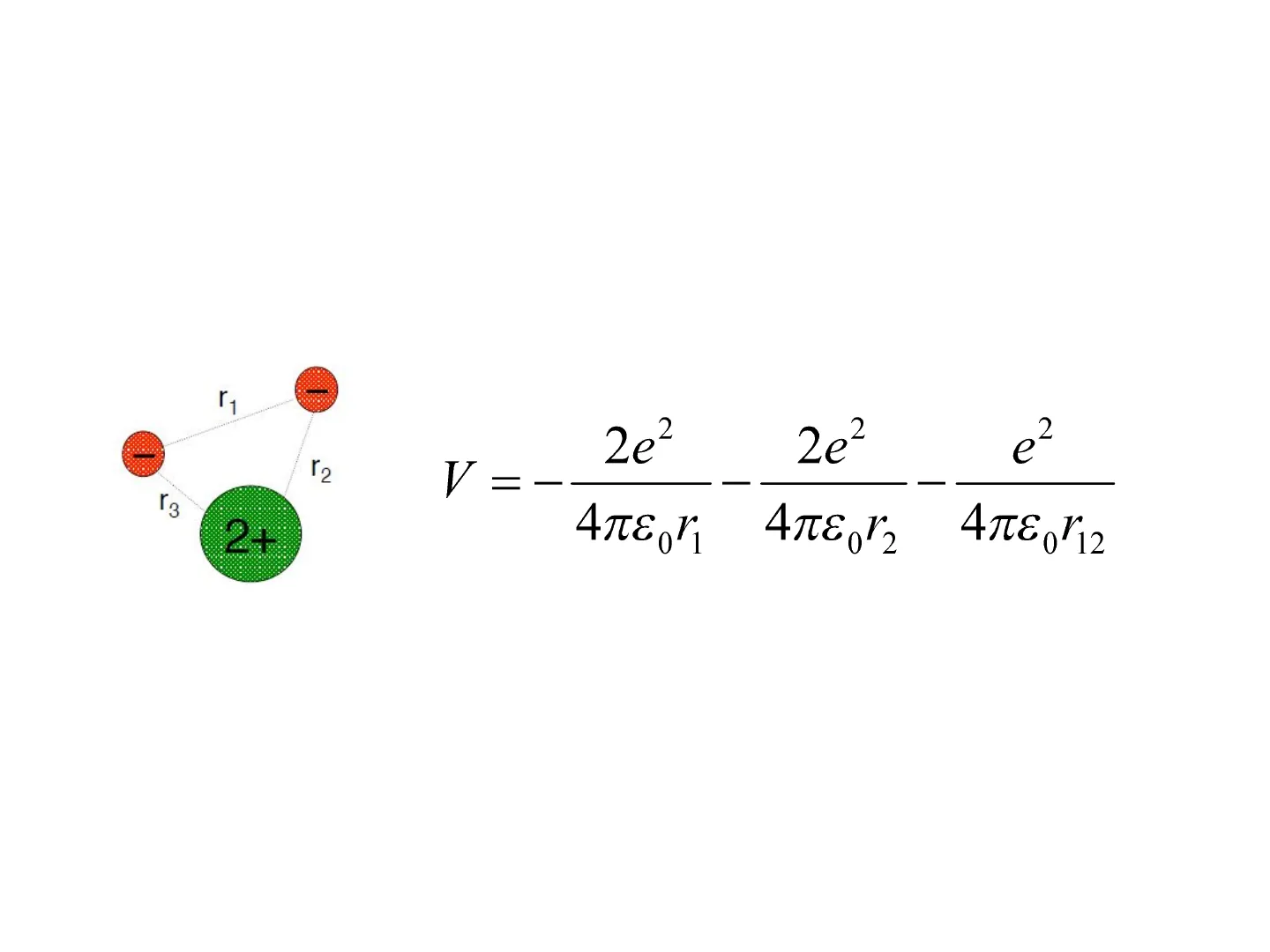
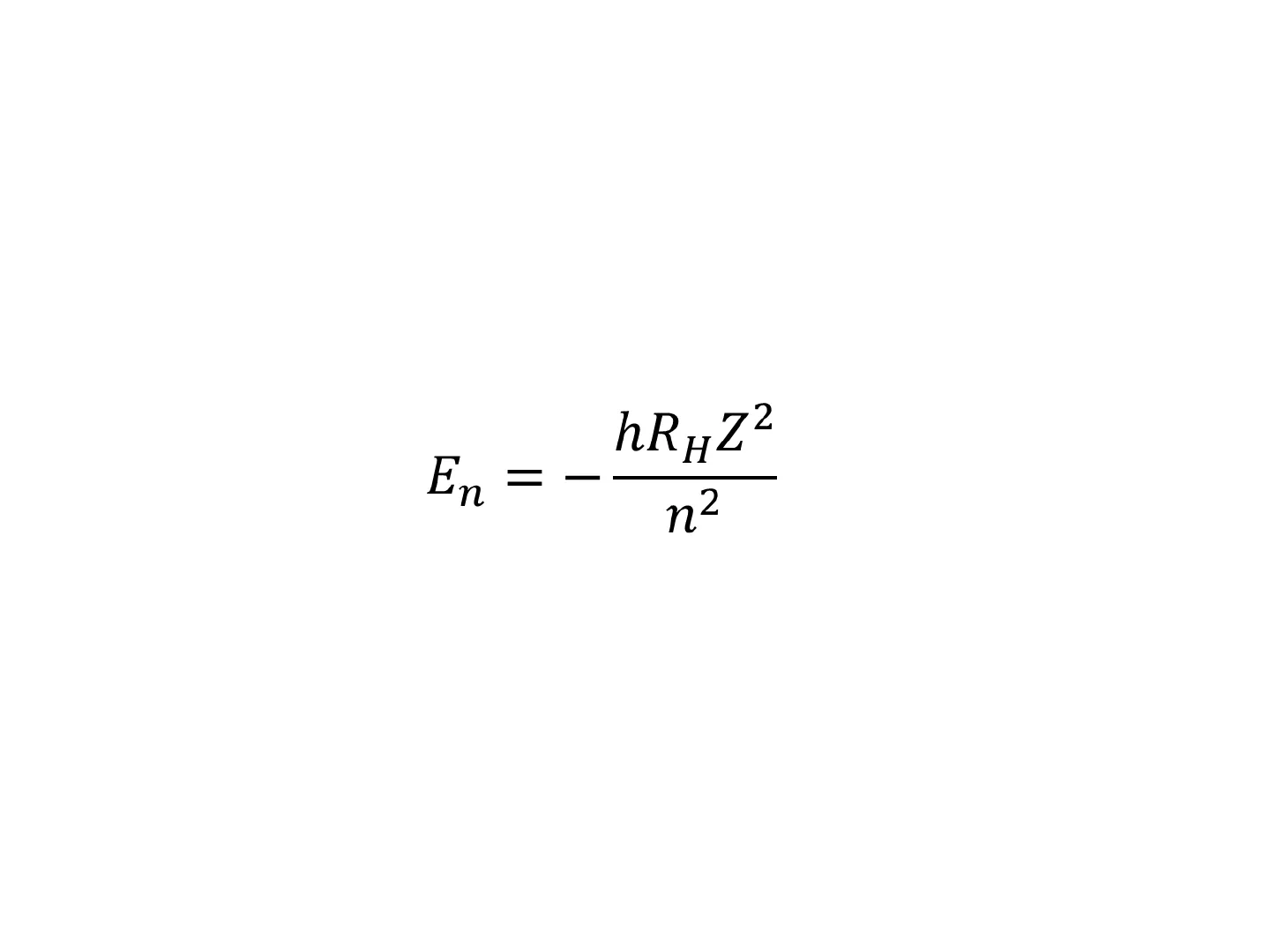
Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Struttura degli atomi multielettronici
Per gli atomi polielettronici non è possibile risolvere con esattezza
l'equazione di Schrodinger, perché ci sono più particelle in
movimento, ognuna delle quali influenza il moto delle altre
r1
2e2
2
2
ľ2
ľ3
2+
V =
2e2
2
Απεγη,
'1
4TE012
Απεργ12
0'12
Nonostante ciò le soluzioni approssimate degli atomi polielettronici
sono simili a quelle degli atomi di idrogeno
Energia degli orbitali
Negli atomi polielettronici la forza di attrazione del nucleo su un
dato elettrone aumenta all'aumentare della carica del nucleo;
l'energia degli orbitali diminuisce all'aumentare di Z.
En =
n
hR
H
Z
n2
2
Gli elettroni però si respingono a vicenda e tale repulsione
antagonizza l'attrazione nucleare e tende ad elevare l'energia degli
orbitali
Carica Nucleare Efficace
In un atomo polielettronico gli elettroni più interni esplicano una
azione di "schermo" per cui un elettrone risente di una carica Z.
(carica nucleare efficace) minore di Z
'eff
0
A
Zeff = Z - S
S = costante di
schermo
Orbitali di tipo diverso (s, p, d, f, ecc.) appartenenti allo stesso
livello n penetrano verso il nucleo in maniera diversa.
La capacità di penetrazione varia nell'ordine:
s> p > d > f
Gusci interni
4 7Tr2R2
3s
3p
3d
1
1
1
1
1
1
1
0
2
3
4
5
6
7
8
r.Å
Z
risulta tanto minore quanto minore è la penetrazione del
relativo orbitale. L'elettrone è energeticamente meno legato al
eff
nucleo quanto minore è Zoff e al relativo orbitale corrisponderà una
energia maggiore
Si ha, quindi,
che:
S(s) < S(p) < S(d) < S(f)
Zeff(s) > Zeff(p) > Zeff(d) > Zeff(f)
E poiché l'energia diminuisce
all'aumentare di :
Z
eff
E(ns) < E(np) < E(nd) <E(nf)
Conseguenza
La sequenza dei livelli energetici dipenderà non solo da n ma anche
da I. Orbitali dello stesso strato (stesso n) ma con forma diversa
(diverso l) non saranno più degeneri.
Diagramma dei livelli energetici
energia
energia
3d
3p
3s
3d
3p
Atomo di idrogeno e
atomi idrogenoidi
3s
Atomi polielettronici
- 6p
5d
- 4f
- 6s
5p
I
4d
- 5s
4p
3d
- 4s
--- 3p
- 3.s
-
- 2p
- 2s
- 1s
· Le energie degli orbitali che
vengono via via occupati dagli
elettroni crescono al crescere
della somma n+l.
· Nel caso di orbitali con uguale
valore n+| viene occupato prima
quello con il numero quantico
principale n più basso
1s<2s<2p<3<3p<4s<3d<4p<5s<4d<5p<6s<4f <5d<6p
n+| 1
2 3
3 4
4
5
5
5
6 6
6
7
7
Energia
Configurazioni elettroniche di atomi multielettronici
La configurazione elettronica di un atomo è l'indicazione di come gli
elettroni sono distribuiti nei vari orbitali
E' indicata dalla successione dei simboli dei sottostrati con un indice
in alto a destra che indica il numero di elettroni presenti nel
sottostrato.
es. per il Boro (Z = 5): 1s2 2s2 2p1
Nella rappresentazione grafica ogni orbitale è indicato da un
cerchio (o da un quadrato). L'occupazione di un orbitale da parte di
un elettrone è indicata da una freccia che punta verso l'alto per m
= +1/2 e verso il basso per m = - 1/2.
Regole da seguire per il riempimento degli orbitali
atomici
1) Principio di "minima energia": Ogni elettrone occupa l'orbitale
disponibile a energia più bassa
1s
25 20
35 30 3er
As 40 40 Af
5s 5p 5d 5f ..
65 66 6d
7$ 7p 7d
Schema mnemonico per determinare l'ordine (approssimato) di
riempimento degli orbitali atomici in atomi polielettronici.
2)
Principio di esclusione di Pauli
In un orbitale non possono trovarsi più di due elettroni. Due
elettroni possono occupare lo stesso orbitale solo se hanno spin
opposti (antiparalleli).
(a)
Valori opposti di mg -> Spin antiparalleli
Valori uguali di mg -> Spin paralleli
(b)
3) "Regola di Hund" della massima molteplicità di spin
Quando esistono orbitali degeneri, gli elettroni tendono
preferibilmente a distribuirsi nel maggior numero possibile di
orbitali, e si dispongono in essi con spin paralleli ovvero con la
massima molteplicità di spin
3 elettroni in 3 orbitali p
DOC
Repulsioni
elettrostatiche maggiori
Il principio di Aufbau
Gli elettroni vengono introdotti uno alla volta negli
orbitali, a partire da quello a più bassa energia osservando
il Principio di Esclusione di Pauli e la regola di Hund
Si realizza in tal modo un sistema di minima energia
chiamato stato fondamentale di un atomo
Per passare da un atomo all'altro si aggiunge un elettrone
Configurazioni elettroniche degli atomi del primo periodo
2p
2s
1
H1 =
1s
1
He =
La freccia indica
lo spin dell'elettrone
Nº di elettroni
1$2
Livello energetico
Tipo di orbitale
2s
1
1 s
N
a) Li 1s22s1, [He]2s1
2s
>
1s
>
b) Be 1s22s2, [He]2s2
2p
‹
-
-
2s
N
1 s
N
c) B 1s22s22p], [He]2s22p1
2 p
-
-
2s
N
1s
d) C 1s22s22p2, [He]2s22p2
Li (Z=3)
Be (Z=4)
B (Z=5)
C (Z=6)
Stati elettronici
Fra tutte le configurazioni elettroniche possibili una corrisponde
allo stato a più bassa energia ed è indicata come stato
fondamentale.
Le altre a energia più alta sono indicate come stati eccitati.
Es. per Li (Z =3)
1s2 2s1 stato fondamentale
1s2 2p1 stato eccitato
1s1 2s2
stato eccitato
Gli stati eccitati sono instabili ed emettono fotoni via via che gli
elettroni ritornano in orbitali atti a riportare l'atomo ad energia
minore.
N (Z=7)
O (Z=8)
F (Z=9)
Ne (Z=10)
2p
11
2s
N
1s
N
a) N 1s22s22sp3, [He]2s22p3
2p
N11
25
N
1s
N
b) Ols-2s22p+, [He]2s22p+
2p
NINT
2s
N
1s
N
c) Fls?2s?2ps, [He]2s22ps
2p
NININ
2s
N
1s
N
d) Ne 1st2s22p6, [He]2s22p6
Terzo periodo
1A
8A
1
H
1s1
2A
3A
4A
5A
6A
7A
2
He
1.52
3
Li
4
Be
252
5
6
7
8
9
B
C
N
251
2s22p1
2822p2
2522p3
0
2322p4
F
2s22p5
10
Ne
2s22p6
13
14
15
16
17
18
Si
P
S
CI
Ar
332
Al
3s23p1
3.523p2
3s23p3
3523p4
3s23p5
35-3p6
11
Na
3.51
12
Mg
Quarto periodo
Z
atomo
configurazione
elettronica
1
19
K
(Ar)
4s
2
20
Ca
(Ar)
45
1
2
21
Sc
(Ar)
3d
45
2
2
22
Ti
(Ar)
3d
45
23
V
(Ar)
3d
4s
5
1
24
Cr
(Ar) 3d
45
25
Mn
(Ar) 3d
45
26
Fe
(Ar) 3d
2
45
27
Co
(Ar) 3d
4s
28
Ni
(Ar) 3d
2
4s
29
Cu
(Ar)
10
3d
1
45
30
En
(Ar)
3d
4s
0
3d
4s
3p
3s
Dopo Z = 20
2s
2p
Energia
1s
10
2
5
2
6
7
2
3
2
- Nel 4º periodo cominciano a riempirsi gli orbitali 4s perché hanno
energia minore. - L'energia degli orbitali 3d diventa minore di quella dei 4s dopo Z
= 20. - A cominciare dallo scandio si scrivono gli orbitali 4s dopo quelli
3d. - All'aumentare di Z gli elettroni vengono successivamente aggiunti
agli orbitali d, però con due eccezioni:
La configurazione del Cr è [Ar]3d54s1 invece di [Ar]3d44s2
La configurazione del Cu è [Ar]d104s1 invece di [Ar]3d9452 - Una volta completati gli orbitali 3d, gli elettroni accedono agli
elettroni 4p (Ga,Ge, As, Se, Kr) .
Quinto periodo
Si prosegue in modo analogo e seguendo lo schema dei livelli
energeti si ha:
5s (Rb, Sr)
4d (Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd) 2º serie di transizione
5p (In, Sn, Sb, Te, I, Xe). Lo xeno (Z=54) chiude il periodo.
Sesto periodo
6s (Cs, Ba)
La (Z = 57) [Xe]6s25d1
Si riempiono, quindi, gli orbitali 4f in 14 elementi detti lantanidi
Ce (Z = 58)[Xe]6s25d14f1
...
...
...
Lu (Z = 71) [Xe]6s25d14f14
Dopo i 4f si completa il riempimento dei 5d nella terza serie di
transizione (La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg). Con il
riempimento dei 6p (TI, Pb, Bi, Po, At, Rn) si completa il sesto
periodo.
Principio organizzativo della tavola periodica
Inizio
H
Blocco-s
Blocco-f
Blocco-d
Blocco-p
He
[He]
2s
2p
Ne
[Ne]
3s
3p
Ar
[Ar]
4.s
3d
4p
Kr
[Kr]
5.s
4d
>
5p
Xe
[Xe]
6.s
5d
4f
6p
Rn
[Rn]
7s
6d
5f
7p
L
- 2
14
10
6
In generale il numero del periodo indica il numero quantico
principale dello strato più esterno occupato:
1º
1s
2º
2s
2p
3º
3s
3p
4º
4s
3d
4p
5°
5s
4d
5p
6°
6s
4f
5d 6p
7º
7s
5f
- Gli elementi appartenenti allo stesso gruppo presentano
proprietà chimiche simili. Perché?
Metalli alcalini - Gruppo 1
Li
[He]2s]
[1s2]2s1
Na
[Ne]3s1
[1s22s22p6]3s1
K
[Ar]4s1
Rb
[Kr]5s1
Cs
[Xe ]6s1
Fr
[Rn]7s1
Hanno tutti un elettrone in più rispetto al gas nobile che li
precede in un orbitale di tipo s (simmetria sferica). Scendendo
lungo il gruppo aumentano le dimensioni e l'energia dell'orbitale s
coinvolto poiché aumenta n (numero quantico principale).
Alogeni - Gruppo 17
F
CI
Br
[Ar]4s23d1º4p'
5
[He]2s22p
5
[Ne]3s23p5
I
[Kr]5s24d1º5p5
[1s2]2s22p
5
[1s22s22p6]3s23p5
- Hanno tutti un elettrone in meno rispetto al gas nobile che li
segue. - Quindi, tutti gli elementi di un gruppo hanno lo stesso
numero di elettroni più esterni ospitati in orbitali di tipo
simile
Nella configurazione elettronica di un elemento distinguiamo gli
elettroni contenuti nei livelli interni (di core) e quelli contenuti
nel livello più esterno (di valenza). Sono solo quelli di valenza (a
energia più alta) che contribuiscono alle proprietà chimiche
dell'elemento.
F
[He ] 2s22p
5
CI
[Ne]s23p
5
Br
[Ar]4s23d104p
5
I
[Kr]5s24d105p
Nel caso del bromo gli elettroni 3d sono contenuti in un livello più
interno (di core) e non contribuiscono alle proprietà chimiche.
Il carattere periodico delle proprietà
atomiche
7
Ar
Cl
6
Ne
S
5
P
O
Si
4
N
Al
Mg
C
3
Na
B
2
Be
He
Li
1
1
3
5
7
9
11
13
15
17
Numero atomico, Z
Variazione della carica nucleare effettiva per l'elettrone di valenza più
esterno al variare del numero atomico.
Essa aumenta da sinistra a destra e diminuisce bruscamente passando ad un
periodo successivo
Carica nucleare effettiva, Zeff
F
Il raggio
atomico
La distribuzione radiale degli orbitali è una curva che va a zero
solo a distanza infinita. E' difficile, quindi, fissare un limite per
l'atomo.
2p
A
3p
0
0,5
1,0
1,5
" (nm)
Tuttavia quando gli atomi si impacchettano nei solidi e si legano a
costituire le molecole, i loro centri si trovano a distanza definita
l'uno dall'altro ed il raggio atomico si definisce come metà della
distanza tra i nuclei di atomi contigui.
Diverse definizioni per il "raggio atomico"
Il raggio atomico si definisce come metà della distanza tra i nuclei di atomi
contigui.
Se l'atomo è un metallo -> raggio metallico
Se l'atomo è un non metallo -> raggio covalente
Se l'atomo è un gas nobile solido -> raggio di Van der Waals
2r
Na +
· Na
INa
Raggio metallico
CI ---. CI
raggio covalente
raggio di van der Waals
Variazione periodica del raggio atomico
1
2
13/III
14/IV
15/V
16/VI
17/VII 18/VIII
2
Li
152
Be
113
B
88
C
77
N
75
O
66
F
58
Ne
3
Na
154
Mg
160
Al
143
Si
117
P
110
S
104
Cl
99
Ar
K
4
227
Ca
197
Ga
122
Ge
122
As
121
Se
117
Br
114
Kr
5
Rb
248
Sr
215
In
163
Sn
141
Sb
141
Te
137
I
133
Xe
6
Ba
217
T1
170
Pb
175
Bi
155
Po
167
At
Rn
Cs
265
Diminuiscono da sinistra a destra lungo un periodo (con l'aumento
della carica nucleare Zeff).
Aumentano scendendo lungo un gruppo perchè con l'aumento del
numero quantico principale vengono occupati nuovi strati.