Lezione 1: Fondamenti di biologia, classificazione e ciclo cellulare
Documento di Università su Lezione 1: Fondamenti di biologia, classificazione e ciclo cellulare. Il Pdf esplora la biologia, coprendo la classificazione degli organismi viventi, le cellule eucariotiche e procariotiche, e il ciclo cellulare, ideale per studenti universitari di Biologia.
Mostra di più17 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Fondamenti di Biologia
Esame a risposta multipla (16 domande) Biologia= studia la vita e le diverse forme viventi-> parliamo di un qualcosa di univoco, di dinamico, un qualcosa che si adatta all'ambiente esterno. Ritmi circadiani > sballare questi ritmi può produrre tantissime malattie Cellula > unità strutturale e funzionale di cui sono costituiti i viventi Capacità di un organismo vivente > la complessità di accrescersi, la capacità di auto-riprodursi, reagire agli stimoli esterni e la congruità con l'ambiente.
Classificazione Organismi Viventi
CLASSIFICAZIONE ORGANISMI VIVENTI-> 6 regni Specie > unità di base per la classificazione degli organismi viventi
Tassonomia e Gerarchia
TASSONOMIA > scienza che si occupa di ordinare e classificare tutti gli organismi viventi secondo una gerarchia. Questa organizzazione permette di comprendere meglio le relazioni evolutive tra le specie. Abbiamo:
Domini
- Archea: organismi unicellulari procarioti, spesso presenti in ambienti estremi (es. sorgenti termali, laghi salati).
- Batteri: organismi procarioti, la maggior parte dei quali vive in condizioni non estreme. Comprende i comuni batteri.
- Eukarya: organismi eucarioti, i cui nuclei cellulari contengono materiale genetico racchiuso in una membrana (es. animali, piante, funghi, protisti).
Regni
All'interno di ciascun dominio, gli organismi sono suddivisi in regni:
- Animali: organismi multicellulari eucarioti, eterotrofi, comprendono invertebrati e vertebrati.
- Piante: organismi eucarioti, autotrofi (capaci di fotosintesi), come alberi, fiori e piante acquatiche.
- Funghi: organismi eucarioti eterotrofi, tra cui lieviti, muffe e funghi macroscopici.
- Protisti: organismi principalmente unicellulari eucarioti, con caratteristiche eterogenee (es. alghe, protozoi).
- Archea e Batteri: organismi unicellulari procarioti.
Categorie Tassonomiche
Ogni regno è suddiviso in categorie sempre più specifiche:
- Phylum (o Divisione, per le piante)
- Classe
- Ordine
- Famiglia
- Genere
- Specie
Cellule e Macromolecole
Macromolecole che si associano-> formano le celluleLe cellule sono di grandezze differenti
Differenze Cellula Eucariote e Procariote
DIFFERENZE TRA LA CELLULA EUCARIOTE E PROCARIOTE:
| Caratteristica | Procariotica | Eucariotica |
|---|---|---|
| Dimensioni | Piccole (0,1 - 5 um) | Grandi (10 - 100 um) |
| Nucleo | Assente, con nucleoide | Presente |
| Organelli | Assenti (tranne ribosomi) | Presenti |
| Microtubuli | Assenti | Presenti |
| DNA | Circolare, senza istoni | Lineare, con istoni |
| Parete cellulare | Presente in molte specie | Presente solo in piante e funghi |
| Ribosomi | Piccoli 70S | Grandi 80S |
| Riproduzione | Fissione binaria | Mitosi e meiosi |
| Flagelli | Semplici, fatti di flagellina | Complessi, fatti di microtubuli |
| Organismi | Bacteria e Archaea | Eukarya (animali, piante, funghi) |
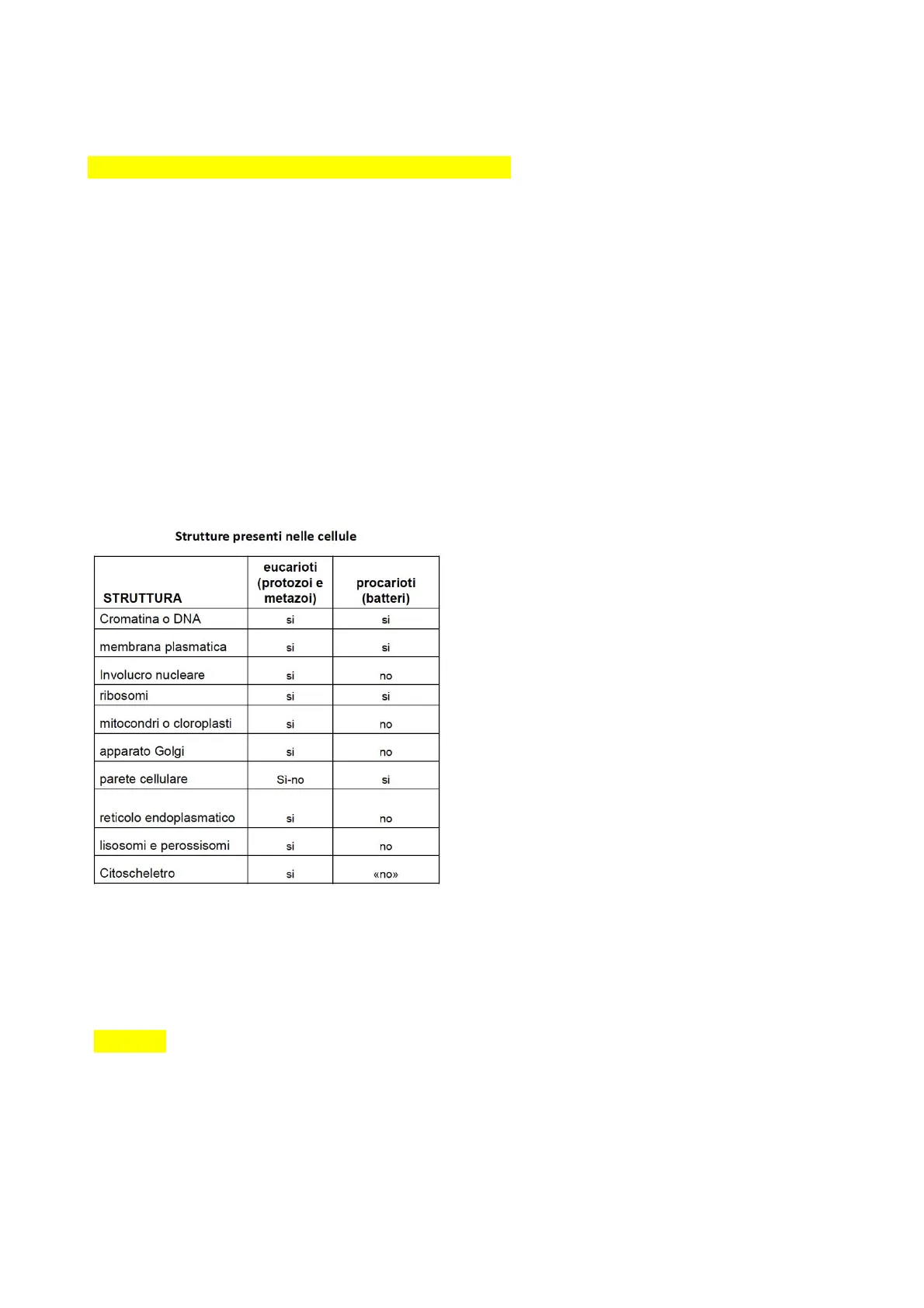
Strutture Cellulari
Strutture presenti nelle cellule
| STRUTTURA | eucarioti (protozoi e metazoi) | procarioti (batteri) |
|---|---|---|
| Cromatina o DNA | si | si |
| membrana plasmatica | si | si |
| Involucro nucleare | si | no |
| ribosomi | si | si |
| mitocondri o cloroplasti | si | no |
| apparato Golgi | si | no |
| parete cellulare | Sì-no | si |
| reticolo endoplasmatico | si | no |
| lisosomi e perossisomi | si | no |
| Citoscheletro | si | «no» |
NELLE CELLULE EUCARIOTE >l'informazione genetica fluisce dal DNA al RNA, MRNA alle PROTEINE
Basi Chimiche
Composizione del Corpo Umano
BASI CHIMICHE DA SAPERE Corpo umano > formato da: idrogeno, ossigeno, carbonio e azoto (i principali) Corpo umano-> formato principalmente da ACQUA-> idrogeno e ossigeno (H, O, C, N) > ELEMENTI PRINCIPALI > formano le macromolecole più complesse che formano i lipidi, carboidrati ecc .. C-> carbonio-> si trova in mezzo e può andare sia a destra che a sinistra (DA ENERGIA) H-> idrogeno 0-> ossigeno N-> azotoAlle MACROMOLECOLE >mancano GLI OLIGOELEMENTI (necessari solo in alcuni organismi) che nel nostro caso sono: Fe, Ca, Mg > indispensabili per tutte le forme di vita (funzioni biologiche)
Struttura dell'Atomo
STRUTTURA DELL'ATOMO Atomo > piccola unita di materia che conserva le proprietà di un elemento
| Particella | Carica | Posizione | Massa (in unità di massa atomica) |
|---|---|---|---|
| Protone | +1 | Nucleo | ~1 u |
| Neutrone | 0 | Nucleo | ~1 u |
| Elettrone | -1 | Orbitali attorno al nucleo | ~1/1836 u |
Legami Chimici
LEGAMI CHIMICI -> forze che tengono unite due o più atomi in una molecola o in una struttura solida. Se due molecole hanno la stessa forza-> condividono elettroni Se due molecole hanno forze diverse > cedono elettroni I legami chimici sono:
| Tipo di Legame | Come si Forma | Esempio | Caratteristiche |
|---|---|---|---|
| Covalente | Condivisione di elettroni | H2O, CO2 | Forte, crea molecole |
| Ionico | Trasferimento di elettroni | NaCl | Forte, forma cristalli ionici |
| Metallico | Elettroni delocalizzati | Cu, Fe | Duttile, conduttivo |
| Legame a Idrogeno | Attrazione tra H e atomi elettronegativi | H2O, DNA | Interazione debole ma importante |
| Forze di Van der Waals | Forze deboli tra molecole | CH4 | Debole, presente in tutte le molecole |
I principali:
- LEGAME COVALENTE= condividono elettroni (e-) Es: acqua c'è il legame covalente
- LEGAME IONICO= legame debole Es: Sale > si scioglie nell'acqua perché troverà l'ossigeno
Proprietà dell'Acqua
Proprietà dell'acqua MOLECOLE IDROFILICHE > ATTRATTE DALLE MOLECOLE POLARI DELL'ACQUA MOLECOLE IDROFOBICHE > ATTRATTE DALLE MOLECOLE POLARI IN ASSENZA DI ACQUA
Acidi e Basi
Sulla definizione di acidi e basi si sono sviluppate 3 teorie:
| Teoria | Definizione di Acido | Definizione di Base | Ambito di Applicazione | Esempi principali |
|---|---|---|---|---|
| Arrhenius | Rilascia H+ in soluzione acquosa | Rilascia OH- in soluzione acquosa | Soluzioni acquose | HCl (acido), NaOH (base) |
| Brønsted- Lowry | Donatore di protoni (H+) | Accettore di protoni (H+) | Reazioni acido-base in vari solventi | HCl (acido), NH3 (base) |
| Lewis | Accettore di coppie di elettroni | Donatore di coppie di elettroni | Qualsiasi reazione di accettazione/donazione di elettroni | BF3 (acido), NH3 (base) |
IN SINTESI Acidi->eccessiva presenza di H+ basici >eccessiva presenza di OH-
Scala del pH
PH -> scala numerica che misura l'acidità o la basicità di una soluzione acquosa > cambiandolo molti enzimi non funzionano. La scala del pH va da 0 a 14:
- pH = 7 indica una soluzione neutra (ad esempio, l'acqua pura).
- pH < 7 indica una soluzione acida (ad esempio, il succo di limone o l'acido cloridrico).
- pH > 7 indica una soluzione basica o alcalina (ad esempio, il bicarbonato di sodio o l'idrossido di sodio).
Un pH basso (ad esempio, 2) corrisponde a una concentrazione elevata di ioni H+ e a una soluzione fortemente acida. Un pH alto (ad esempio, 12) indica una concentrazione bassa di ioni H+ e una soluzione fortemente basica.
Fasi dell'Acqua
FASI DELL'ACQUA >Solido, Liquido, Gassoso Quando L'ACQUA si congela > aumenta l'ENTROPIA > energia libera di Ghibs
Composti Organici del Carbonio
Carboidrati e Zuccheri
COMPOSTI ORGANICI DEL CARBONIO CARBOIDRATI/ZUCCHERI > entra ed esce ACQUA, abbondanti nei tessuti animali e nella crosta terrestre. Si dividono in:
- MONOSACCARIDI da 3 a 7 atomi di carbonio, solubili in acqua PRINCIPALE è IL GLUCOSIO (NELLA FORMA D) LEGAME alfa 1,4 -> 6 ATOMI DI CARBONIO > C6H1206.
- OLIGOSACCARIDI 2-10 unità di monosaccaridi uniti da legami glicosidici PRINCIPALE è IL SACCAROSIO > GLUCOSIO E FRUTTOSIO
- POLISACCARIDI (ACIDI IALURONICO E CELLULOSA) -> LEGAME beta 1,4 > non possiamo digerirlo) e possono essere: RISERVA o SOSTEGNO Decine o centinaia di unità monosaccaride unite tra loro da legami glicosidici PRINCIPALE è IL GLICOGENO
Abbiamo:-
- Polisaccaridi di sostegno: poco solubili in acqua, che svolgono la funzione di sostenere o irrigidire strutture extracellulari.
- Polisaccaridi di riserva: immagazzinano grosse quantità di monosaccaridi.
Lipidi
LIPIDI > possono essere solubili e insolubili in ACQUA o in solventi apolari. Diversi tipi:
- LIPIDI DI DEPOSITO > fungono da deposito di scheletri carboniosi e di energia per le cellule
- LIPIDI STRUTTURALI > entrano nelle membrane biologiche. Possono essere: > semplici, complessi steroidi In quelli SEMPLICI troviamo -> TRIGLICERIDI, GLICEROLO. Costituiti da acidi grassi combinati sotto forma i esteri con alcol In quelli COMPLESSI troviamo -> GLICEROFOSFATIDI/FOSFOGLICERIDI e SFINGOLIPIDI. Costituiti oltre che da acidi grassi ed alcol, anche da componenti con caratteristiche polari che danno alle molecole proprietà anfipatiche. Negli STEROIDI > importante per la fluidità della membrana. Troviamo > COLESTEROLO Composti i cui lo scheletro carbonioso è rappresentato da una catena formata da 4 anelli condensati saturi.
- LIPIDI REGOLATORI > sono per esempio gli ormoni sessuali. Possono anche essere: SATURI/INSATURI-> si riferiscono al tipo di legami chimici presenti nelle molecole Saturi-> legami semplici (es: GRASSI) Insaturi >legami doppi e tripli (fanno bene) (es: OLI)
Tutto quello che è disordinato fa bene. (STRUTTURA)
Proteine
PROTEINE > le più importanti-> coinvolte nella maggior parte delle attività cellulari Costituite da 22 AMMINOACIDI. Ogni AMMINOACIDO ha:
- Amminico
- Carbossilico
- Atomo di idrogeno
- R, REGIONE VARIABILE che determina le proprietà specifiche di ciascuno dei 22 diversi amminoacidi.
Gli amminoacidi possono essere:
- Amminoacidi POLARI -> C'è L'OSSIGENO (interagisce con acqua)
- Amminoacidi APOLARI -> NO C'è MAI L'OSSIGENO (non interagisce con acqua)
- Amminoacidi IONIZZABILI -> possono essere ACIDI E BASICI ACIDI-> gruppo CARBOSSILICO ( -COOH) BASICI > gruppo AMMINICO (-NH2)
LEGAME PEPTIDICO -> TRA AMMINOACIDI
Strutture delle Proteine
STRUTTURE PROTEINE > fa fare PROTEINE FIBROSE -> ES (cheratina, collagene ecc .. )Possono essere:
- PRIMARIA
- SECONDARIA
- TERZIARIA
- QUATERNARIA
| Livello di struttura | Caratteristiche principali | Legami principali | esempio |
|---|---|---|---|
| primaria | Sequenza lineare di amminoacidi. Determina la funzione e la forma della proteina. | Legami peptidici | Insulina, emoglobina |
| secondaria | Strutture locali ripiegate (alfa- elica, beta-foglietto). | Legami a idrogeno tra amminoacidi vicini. | Collagene (tripla elica), cheratina |
| terziaria | Conformazione tridimensionale complessiva. Funzionale per l'attività biologica della proteina. | Legami idrogeno, ionici, idrofobici, ponti disolfuro | Emoglobina, enzimi (es. amilasi) |
| quaternaria | Struttura complessiva di più subunità polipeptidiche che lavorano insieme. | Interazioni idrofobiche, a idrogeno, ioniche | Emoglobina, DNA polimerasi, ribosoma |
Acidi Nucleici
ACIDI NUCLEICI > polinucleotidi Due tipi:
- Acido ribonucleico (RNA) >Permette l'espressione dell'informazione genetica
- Acido desossiribonucleico (DNA)-> Permette il deposito dell'informazione genetica
I nucleotidi sono formati da 3 elementi:
- ZUCCHERO -> A 5 ATOMI DI CARBONIO
- BASE AZOTATA -> e sono PURINE (2 anelli, 9 atomi) e PIRIMIDINE (singolo anello, 6 atomi)
- Residuo di ACIDO FOSFORICO (GRUPPO FOSFATO)
I nucleotidi si possono unire tramite un LEGAME FOSFODIESTERICO > che si forma tra un fosfato di un nucleotide e lo zucchero del nucleotide seguente Polarità del filamento 5' (P) > 3' (OH) I nucleosidi sono formati da 2 elementi:
- ZUCCHERO
- BASE AZOTATA
Il DNA è un filamento formato da 2 polinucleotidi avvolti uno sull'altro in senso destrorso, dando una doppia elica. È presente il DEOSSIRIBOSIO ed è presente la TIMINA. Le basi rivolte verso l'interno si appaiano in modo specifico mediante legami H. LEGAME tra una Purina (A o G) e una Pirimidina ( T o C) . Nel DNA si rovano i GENI > piccoli tratti con tante istruzioni per la sintesi di un polipeptide.