Equilibrio acido-base e compensazione renale: appunti di biologia
Documento di Rebecca Marsiletti sull'equilibrio acido-base e la compensazione renale, che esplora i meccanismi di regolazione del pH ematico. Il Pdf, utile per lo studio universitario di Biologia, analizza i fattori che influenzano l'equilibrio, i sistemi tampone del sangue e i processi di compensazione respiratoria e renale.
Mostra di più10 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Fisiologia dell'Equilibrio Acido-Base
Rebecca Marsiletti
Lezione 10\04\2024
Prof. Pierpaolo Greco
Abbiamo visto in che modo viene controllata l'omeostasi dal punto di vista della pressione e com'è in grado il rene di controllare le concentrazioni ioniche (quindi anche il rilascio dell'acqua, le condizioni dei liquidi corporei in termini di volume) ma, ovviamente, non è soltanto questo che è fondamentale per il mantenimento della vita: anche la condizione di concentrazione di ione idrogeno (pH del sangue) è un requisito importante da mantenere.
Argomenti della lezione
- Fattori che condizionano l'equilibrio acido-base dell'organismo e apporti di acidi: in che modo l'organismo riesce a bilanciare gli apporti (prevalentemente) di acidi che arrivano attraverso la dieta.
- Principali eventi scatenanti acidosi e alcalosi
- Meccanismi di compensazione:
- Azione dei tamponi del sangue
- Compensazione respiratoria
- Compensazione renale
- Quantitativi di acidi e risposta in caso di alcalosi metabolica
- Domande e risposte
Importanza del pH ematico
Il pH ematico, quindi il pH del plasma, è fondamentale ed è contenuto in un intervallo ristretto di valori:
- Il pH del sangue arterioso è regolato dall'attività dei reni e dei polmoni.
7,38 < pH < 7,42 valori normali
- pH < 7.35 -> acidosi
pH > 7,45 - alcalosi
Il pH deve essere compreso tra 7,38 e 7,42 in condizioni fisiologiche.
Un pH sanguigno inferiore a 7,35 è caratteristico di una condizione chiamata acidosi, che può essere sostenuta dall'organismo solo per un periodo limitato di tempo.
Un pH superiore a 7,45 è caratteristico di una condizione chiamata alcalosi.
Il pH sanguigno è molto importante perché, oltre ad essere correlato alla pressione parziale dell'anidride carbonica nel sangue (si lega all'attività metabolica dell'organismo), influenza notevolmente l'attività enzimatica.
Tutti i meccanismi cellulari che si basano sugli enzimi sono molto influenzati dal pH e, un valore diverso da quello fisiologico, potrebbe determinare un malfunzionamento enzimatico.
In alcuni complessi in cui è necessaria una sincronia di tutte le attività, come nel caso della contrazione muscolare, se un enzima lavora ad una velocità diversa dall'ordinario, ovviamente tutte le reazioni a cascata possono essere interrotte con gravi conseguenze.
Effetti dell'acidosi
Effetti generali della condizione di acidosi:
- Il pH influisce sull'attività di proteine ed enzimi (cambi di conformazione)
- L'acidosi riduce l'eccitabilità dei neuroni del SNC, l'alcalosi l'aumenta
- Squilibri bilancio potassio (acidosi - iperkaliemia, alcalosi - ipokaliemia)
- Anormale attività delle catecolamine - aritmie cardiache in acidosi
Acidosi - trattiene il potassio - si verifica il caso di iperkaliemia
Alcalosi - tendenza a perdere il potassio - ipokaliemia
Il potassio è coinvolto nell'attività della membrana cellulare quindi in caso di iperkaliemia avremo un'eccitabilità maggiore dei neuroni nel sistema nervoso centrale ma anche nel sistema nervoso autonomo (tessuto cardiaco, probabilità maggiore che si verifichino aritmie cardiache - disregolazione del bilancio del potassio).
In caso di alcalosi, ipokaliemia, invece, avremo degli effetti sull'eccitabilità del sistema nervoso centrale e quindi anche in questo caso sull'attività cardiaca.
Vi è anche un'anormale attività delle catecolammine, i neurotrasmettitori, e anche qui notiamo un effetto sull'attività cardiaca (aritmie di diverse classi).
Eccitabilità neuronale in acidosi
Domanda posta in aula: perché in caso di acidosi varia l'eccitabilità dei neuroni?
In caso di acidosi viene ridotta l'eccitabilità dei neuroni del SNC perché abbiamo una maggiore concentrazione di K+ all'esterno della cellula, questo comporta un diverso potenziale, un diverso gradiente di concentrazione, tra interno-esterno. In sostanza, si è visto che ne riduce l'eccitabilità; viceversa, un'ipokaliemia, tenderebbe ad aumentare l'eccitabilità proprio perché aumenta il gradiente. Dal punto di vista del tessuto cardiaco, iperkaliemia ed ipokaliemia danno lo stesso effetto; aritmia cardiaca. Questo perché si va a guardare la frequenza di scarica che risulta non regolare sia in caso di ipereccitabilità, sia in caso di riduzione della stessa.
Fattori che condizionano l'equilibrio
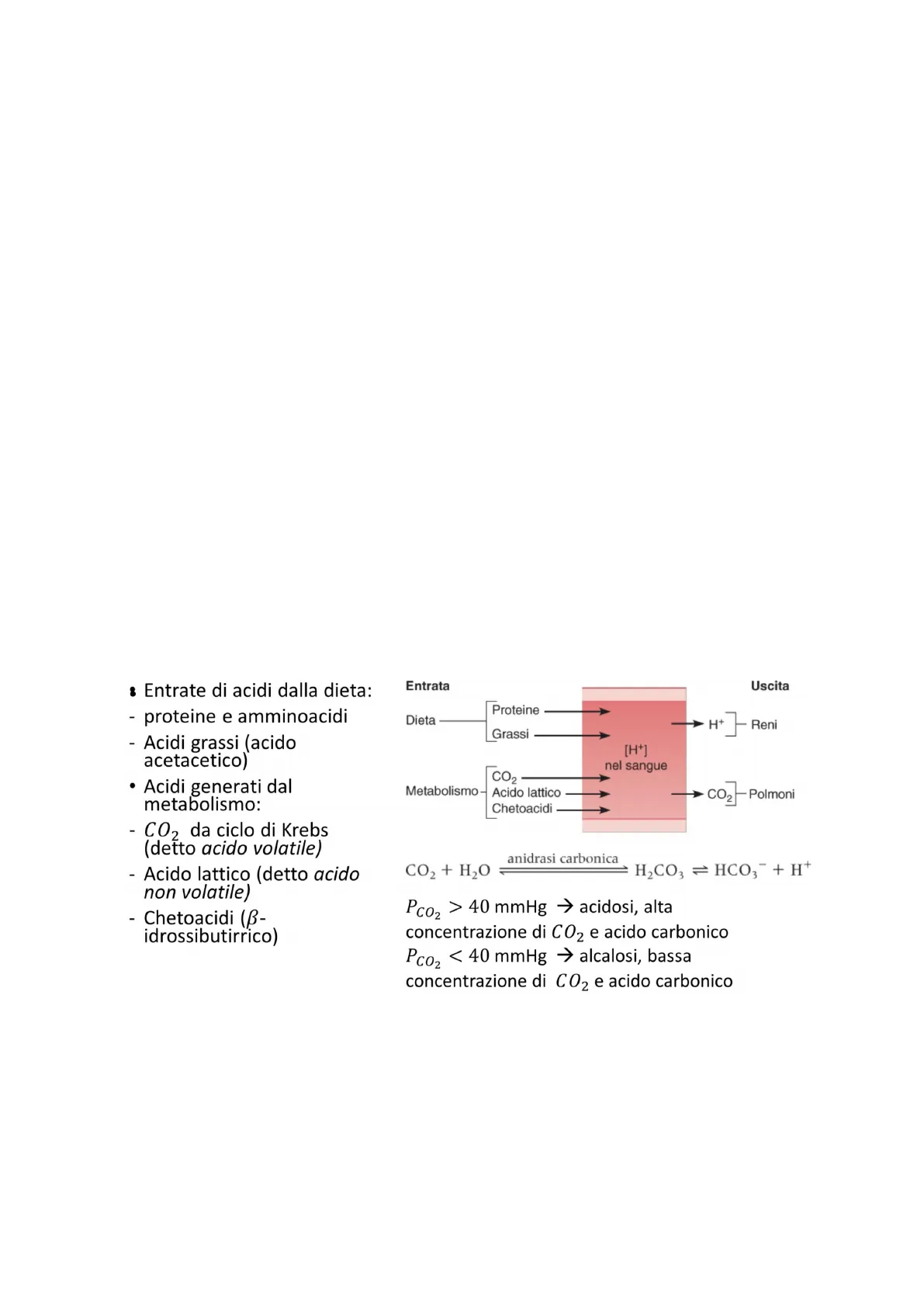
- Entrate di acidi dalla dieta:
- proteine e amminoacidi
- Acidi grassi (acido acetacetico)
- Acidi generati dal metabolismo:
- CO2 da ciclo di Krebs (detto acido volatile)
- Acido lattico (detto acido non volatile)
- Chetoacidi (3-idrossibutirrico)
Entrata
Uscita
Proteine
Dieta
H+
Reni
Grassi
[H+]
nel sangue
Metabolismo-
CO2
Acido lattico
Chetoacidi
> CO2 -Polmoni
anidrasi carbonica
CO2 + H2O
H2CO3 = HCO3+ H+
Pco2 > 40 mmHg > acidosi, alta
concentrazione di CO2 e acido carbonico
Pco2 < 40 mmHg > alcalosi, bassa
concentrazione di CO2 e acido carbonico
Ipotizzando un bilancio, descrivendo le entrate e le uscite di ioni H+ (principale mezzo per descrivere il pH nel sangue), in entrata abbiamo essenzialmente ioni H+ prodotti dalla digestione (proteine, e grassi). Le proteine tendono a generare acido solforico che aumenta l'acidità del sangue e la concentrazione di ioni H+ e lo stesso vale per i grassi. Abbiamo poi un'acidità prodotta dal metabolismo perché l'anidride carbonica è in stretta correlazione, mediante un'equazione di bilancio, con l'acido carbonico e ioni H+ ad esso associati.
Un maggiore metabolismo induce una maggiore produzione di anidride carbonica e questa necessariamente può costituire una fonte di H+ in aggiunta come entrata.Il metabolismo può produrre anche acido lattico in particolari condizioni quando non vi è sufficiente ossigeno per completare l'ossidazione.
La presenza di chetoacidi rappresenta un'ulteriore entrata nel bilancio quando vi è un ambiente che permette la formazione di queste sostanze.
In uscita, invece, gli ioni H+ possono essere secreti dai reni nei tubuli e la CO2 è scambiata negli alveoli polmonari (uscita di acidi volatili).
Sotto lo schema di bilancio è riportata l'equazione di correlazione tra CO2 contenuta nel sangue, il bicarbonato e lo ione H+. La CO2 con l'acqua viene metabolizzata a formare acido carbonico, direttamente in relazione (reazione che può essere spostata o verso i reagenti o verso i prodotti e dipende dal pH) con gli altri due elementi (idrogeno e bicarbonato).
Se la reazione è spostata verso i prodotti avremo maggiore concentrazione della forma dissociata, se invece è spostata verso i reagenti avremo la forma associata come acido carbonico. Com'è correlata alla CO2 in termini di gas? Ritrovando una pressione parziale maggiore di 40 mmHg, siamo in acidosi (alta concentrazione di acido carbonico); al contrario, inferiormente, siamo nello spettro dell'alcalosi (bassa concentrazione di anidride carbonica e acido carbonico).
Acidosi e Alcalosi
Origini di acidosi e alcalosi
Quali possono essere le origini di questi stati di acidosi?
C'è una tendenza sostanziale ad introdurre più acidi che basi nell'organismo mediante la dieta, ma c'è anche il complesso renale che secerne ioni H+ che mantiene il pH dentro il range fisiologico.
Ci sono, però, delle condizioni che inducono lo spostamento del pH verso i due estremi:
- Dieta ad alto contenuto proteico - il catabolismo proteico determina la produzione di acido fosforico e solforico in eccesso. Abbassamento del pH e potenziale acidosi.
- Dieta ad alto contenuto di grassi - il catabolismo produce acidi grassi in eccesso; rischio di acidosi.
- Attività fisica intensa - il fabbisogno di ossigeno non è completamente soddisfatto, e avviene la produzione di acido lattico in eccesso; è un meccanismo metabolico. In questo caso, si incombe in acidosi.
- Vomito eccessivo - alcalosi, a causa di perdita di ioni idrogeno normalmente riassorbiti dall'intestino.
- Diarrea grave -> acidosi, a causa della perdita di bicarbonato.
- Alterazione funzionale renale - differente produzione e riassorbimento ioni idrogeno e bicarbonato. Prevalentemente legate al riassorbimento di bicarbonato e ioni idrogeno.
Meccanismi di Compensazione
Abbiamo visto quali sono le possibili "cause scatenanti", ma ci sonoanche tre tipi di meccanismi di compensazione che il nostro organismo mette in atto per rimediare;
- Azione di tamponi presenti nel sangue per compensare in parte gli squilibri acido-base
- Compensazione respiratoria, che regola la velocità con cui l'anidride carbonica viene rimossa dal sangue.
- Compensazione renale, che regola la velocità con cui gli ioni H+vengono secreti e gli ioni bicarbonato vengono riassorbiti.
Azione dei tamponi nel sangue
- Sistemi tampone:
Nel sangue è presente
HCO3 + H+ H2CO3 bicarbonato
proteina" + H+ ~ proteinaH proteine
HP02- + H+ & H2PO4 fosfato
anidride
carbonica
dovuta alla respirazione
ed è correlata con
l'acido carbonico: esso
può esistere in forma
dissociata. Questo è un
sistema tampone che
può essere favorito da
una parte o dall'altra
proprio in funzione del pH. È una reazione che permette la costanza del pH se il sistema viene perturbato aggiungendo o togliendo acidi. Tuttavia, questo funziona entro un certo intervallo (l'acido aggiunto o tolto non dev'essere esagerato); poi, il quantitavo di bicarbonato è presente nel sangue in misura finita; quindi, se non si risolve la causa, il meccanismo tampone si esaurisce non essendo in grado di sostenere il problema nel lungo periodo. Il sistema reagisce immediatamente al variare del pH.
- Compensazione veloce
- Capacità di intervento limitata poiché la disponibilità delle forme dissociate degli acidi deboli è finita. E' necessaria la rimozione della sorgente di acidi, altrimenti la variazione di pH può essere molto ampia dopo l'esaurimento del tampone
H+ aggiunto
quantitavo di bicarbonato è
presente nel sangue in misura
HAH+ + A"
Soluzione tampone
finita; quindi, se non si risolve la
PH
causa, il meccanismo tampone si
H+ rimosso
Acqua distillata
1
HAH+ + A"
esaurisce non essendo in grado di
sostenere il problema nel lungo
periodo. Il sistema reagisce
immediatamente al variare del pH.
Abbiamo anche il tampone fosfato; è una compensazione veloce ma con capacità limitata. È necessario fornire altro tampone al sangue per sostenere l'azione, altrimenti un incremento di ioni idrogeno determina un brusco cambiamento del pH.
Quantità di acido aggiunto alla soluzione
Ci sono altri meccanismi di compensazione che sono meno veloci rispetto all'azione del tampone, ma che possono essere più sostenibili nel tempo e contrastare l'azione di acidosi nel lungo periodo: la compensazione respiratoria (variando la frequenza di respirazione possiamo immettere o ridurre la pressione parziale di anidride carbonica, correlata al pH). In caso di acidosi, una maggiore ventilazione permette la rimozione di CO2 dal sangue (riduce sotto ai 40 mmHg la pressione parziale di CO2). Il terzo metodo è la compensazione renale che, invece, agisce sulla velocità di secrezione di ioni idrogeno; impatta anche sulla velocità di riassorbimento del bicarbonato al fine di riciclarlo. L'ultimo metodo richiede ore/giorni, ma è un meccanismo che è sostenibile nel tempo.