La tavola periodica, i gruppi e i modelli atomici di Rutherford e Bohr
Schemi sulla tavola periodica. Il Riassunti, di Chimica per la Scuola superiore, esplora la tavola periodica, i gruppi, la massa atomica e i modelli atomici di Rutherford, Bohr e Schrödinger, includendo le particelle subatomiche.
Mostra di più10 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
La Tavola Periodica e i suoi Elementi
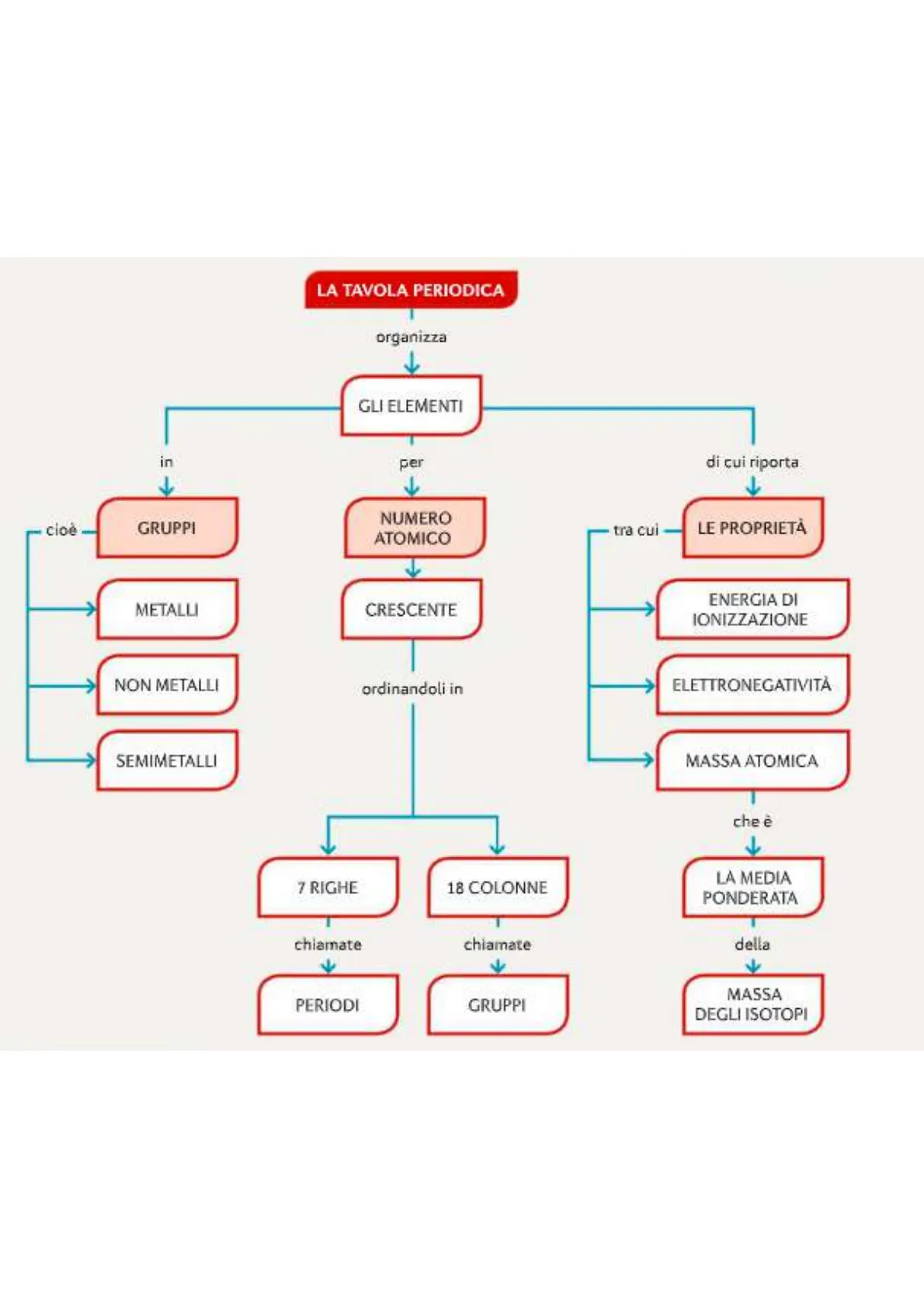
LA TAVOLA PERIODICA organizza GLI ELEMENTI in per di cui riporta cioè - GRUPPI NUMERO ATOMICO tra cui LE PROPRIETÀ METALLI CRESCENTE ENERGIA DI IONIZZAZIONE NON METALLI ordinandoli in ELETTRONEGATIVITÀ SEMIMETALLI MASSA ATOMICA che è 7 RIGHE 18 COLONNE LA MEDIA PONDERATA chiamate chiamate della > PERIODI GRUPPI MASSA DEGLI ISOTOPI
I Gruppi nella Tavola Periodica
I gruppi Gli elementi che appartengono allo stesso gruppo hanno configurazioni elettroniche simili: per esem- pio, quelli del gruppo più a destra (elio, neon, argo ecc.) hanno tutti i livelli energetici completati con il numero massimo di elettroni che possono ospitare. Poiché la configurazione elettronica di un elemento ne determina le proprietà chimiche, possiamo affer- mare che tutti gli elementi che appartengono allo stesso gruppo hanno proprietà chimiche simili Per esempio, il sodio e il potassio appartengono allo stes so gruppo e hanno proprietà simili: sono entrambi metalli teneri, si ossidano rapidamente a contatto con l'aria e sono altamente reattivi con l'acqua.
La Massa Atomica degli Elementi
La massa atomica In ciascuna cella della tavola periodica sono con- tenute informazioni sull'elemento: in particolare il suo nome, simbolo, numero atomico e valore della massa atomica.
La massa atomica di un elemento è la massa di un atomo nel suo stato fondamentale.
Un atomo è talmente piccolo che per esprimere la massa bisognerebbe scrivere un numero enorme di zeri dopo la virgola. Per facilitare il confronto tra le masse degli atomi si è deciso di esprimerle in riferi- mento all'atomo di carbonio-12, a cui è stato asse gnato arbitrariamente il valore di 12 unità di massa atomica: l'unità di massa atomica (u) è la dodice sima parte della massa dell'atomo di carbonio 12.
Poiché ogni elemento può avere molti isotopi, cia scuno dei quali ha massa diversa, la massa atomica riportata nella tavola periodica è un valore medio ponderato che dipende dall'abbondanza in natu- ra degli isotopi dell'elemento e dalle loro masse.
Organizzazione per Numero Atomico
L'organizzazione per numero atomico Nella tavola periodica di Mendeleev, ideata prima della scoperta dei protoni, gli elementi erano ordi- nati per massa atomica crescente Nella tavola periodica moderna, gli elementi sono ordinati in base al numero atomico crescente, cioè per numero crescente di protoni ed elettroni: il nu- mero atomico è indicato in ogni casella insieme al simbolo chimico.
Nella tavola periodica, le righe vengono chiamate periodi e le colonne gruppi.
Gli elementi che appartengono alla stessa colonna (cioè allo stesso gruppo) hanno proprietà simili Oggi sono noti 118 elementi, dei quali circa 90 pre- senti in natura e gli altri sintetizzati in laboratorio.
La tavola periodica è aggiornata quando viene iden- tificato un nuovo elemento. Tutti gli elementi sono organizzati in 7 periodi (righe) e 18 gruppi (colonne).
I Periodi della Tavola Periodica
I periodi Il numero di elementi per periodo cresce dall'al- to verso il basso. Questo accade perché i periodi indicano anche il numero di livelli energetici che caratterizzano gli atomi degli elementi. Il primo periodo ospita gli elementi che hanno elettroni in un solo livello energetico. Come sai, il primo livello energetico può essere occupato solo da 1 o 2 elet troni, quindi a esso corrispondono solo l'idrogeno (1 protone, 1 elettrone) e l'elio (2 protoni, 2 elettro- ni). Nel secondo periodo sono disposti gli elementi che hanno gli elettroni esterni nel secondo livello energetico: ovvero che hanno un numero di elet- troni compreso tra 3 e 10 (due elettroni situati nel primo livello, gli altri nel secondo livello in cui tro- vano posto fino a 8 elettroni).
Sviluppo Storico della Tavola Periodica
Fino al 1750 erano noti solo 17 elementi chimici, principalamente metalli. Negli anni successivi furo no scoperti molti nuovi elementi e ci fu la necessità di suddividerli in modo razionale.
Nel 1868 il chimico russo Dmitrij I. Mendeleev (1834-1907) mise a punto un metodo utile per clas sificare tutti gli elementi Mendeleev prese spunto dal gioco del solitario per organizzare gli elementi chimici, trattandoli come se fossero delle carte da gioco; su ciascuna segnò il nome di un elemento, la sua massa atomica e le sue proprietà (reattività, densità, temperatura di fusione ecc.). Lo scienziato allineo le carte in ordi- ne di massa atomica crescente, disponendo poi gli elementi in colonne allineate in modo che quelli con proprietà simili si trovassero nella stessa riga: per esempio, gli elementi della riga del litio (Li) re- agiscono tutti violentemente con l'acqua.
Ottenne cosi una sorta di mappa degli elementi. con la massa atomica che cresceva spostandosi verso il basso e verso destra.
Aveva ideato la prima tavola periodica degli ele menti chimici. In seguito, la perfezionò e inverti le colonne con le righe
Proprietà Atomiche Fondamentali
Il Numero Atomico Z
Il numero atomico Gli atomi di un elemento hanno sempre lo stesso numero di protoni, mentre gli atomi di elementi diversi hanno un numero diverso di protoni; per descrivere questa proprietà si utilizza come unità di misura il numero atomico
Il numero atomico Z di un elemento è uguale al numero dei protoni contenuti in un atomo di quell'elemento.
Il numero atomico, quindi, può essere usato per in- dicare in modo univoco gli elementi: per esempio, al numero atomico 1 corrisponde sempre e solo l'idrogeno, che ha un solo protone nel nucleo; il carbonio ha 6 protoni, quindi ha numero atomico 6.
Dato che gli atomi sono complessivamente neutri, si può dedurre che a ogni carica positiva corrispon- da una carica negativa: quindi, il numero atomico di un elemento indica anche il numero di elettroni posseduti dall'atomo. L'idrogeno, per esempio, ha un solo elettrone
Il Numero di Massa A
Il numero di massa La massa dell'atomo è concentrata nel nucleo, do- ve troviamo protoni e neutroni. Questa proprietà è descritta dal numero di massa.
Il numero di massa A di un atomo è la somma del numero di protoni e di neutroni contenuti nel suo nucleo.
Per calcolare il numero di neutroni si può applicare la seguente formula:
numero di neutroni = = numero di massa - numero atomico
Gli Isotopi degli Elementi
Gli isotopi Tutti gli atomi di un elemento hanno lo stesso nu- mero di protoni e di elettroni, ma non tutti hanno lo stesso numero di neutroni.
Gli isotopi di un elemento hanno lo stesso numero atomico ma un diverso numero di massa, poiché hanno un diverso numero di neutroni.
Il carbonio, per esempio, ha tre isotopi:
- il carbonio-12;
- il carbonio-13;
- il carbonio-14.
Tutti e tre gli isotopi hanno sei protoni, ma si di- stinguono per il numero di massa (rispettivamen te 12, 13 e 14) da cui si può dedurre il numero di neutroni (ovvero 6, 7 e 8).
Evoluzione dei Modelli Atomici
Modelli Atomici: Rutherford, Bohr, Schrödinger
Rutherford (1871-1937) 5 ) Bohr [1885-1962) Schrödinger (1887-1961) 1911 1916 1928 Rutherford scopri che la massa dell'atomo doveva essere concentrata in un punto molto piccolo al suo interno dotato di carica positiva. In base alle sue scoperte si comprese che la massa non dipende dagli elettroni: il suo modello atomico è costituito da un nucleo positivo intorno al quale circolano gli elettroni negativi. Rutherford misuro anche il raggio del nucleo (10-15 m) e il raggio medio dell'atomo [10-10), da cui dedusse che l'atomo ha un volume circa 1000 volte maggiore rispetto al suo nucleo: dato che lo spazio tra il nucleo atomico e le particelle intorno a esso è relativamente grande, ne consegue che la maggior parte della materia è, in realtà, formata da vuoto.
Bohr perfeziono il modello di Rutherford, Immaginando sempre che gli elettroni ruotino intorno al nucleo, ma che possano farlo solo a precise distanze da esso [orbite). Le orbite dipendono dall'energia degli elettroni, che può assumere solo determinati valori livelli energetici). livelli energetici 0 nucleo
Schrödinger dimostrò che gli elettroni si trovano con più probabilità in dati spazi intorno al nucleo, chiamati orbitali atomici, che possiamo immaginare come nuvolette. Ogni orbitale può orbitali ospitare al massimo due elettroni. Se in un atomo sono presenti 10 elettroni, questi saranno distribuiti in 5 diversi orbitali (10 : 2 = 5). Al primo livello energetico (il più basso] corrisponde un solo orbitale, mentre al secondo livello energetico . ne corrispondono 4 (quindi 4 . 2 = 8 elettroni), Negli primo livello energetico atomi, gli elettroni occupano prima i livelli energetici più bassi e poi + terzo livello energetico secondo livello quelli più alti. energetico
Proust, Dalton e Thomson
1 ) Proust [1754-1826) 2 ) Dalton (1766-1844) 3 Thomson [1856-1940) 1799 1803 1904 Proust scopri che il rapporto tra le masse degli elementi che costituiscono uno stesso composto è sempre In stesso, anche se cambia la dimensione del campione analizzato. Proust effettuo diversi esperimenti, pesando i reagenti e i prodotti e scoprendo che, nel formare I composti, gli elementi si combinavano sempre secondo proporzioni definite. Sulla base di questi dati, formulo la legge (nota come legge di Proust) in base alla quale gli elementi che costituiscono un composto sono presenti con un rapporto in massa definito e costante.
Dalton realizzò alcuni esperimenti i cui esiti potevano essere spiegati soltanto immaginando la materia costituita da atomi indivisibili. Realizzò un modello atomico in cui gli atomi erano sfere solide. Dalton scopri anche che tutti gli atomi dello stesso elemento hanno la stessa massa e gli atomi di elementi diversi hanno masse diverse; studiando I composti scoprì poi che se due elementi possono reagire tra loro secondo rapporti di combinazione diversi, formano compounds diversi (legge delle proporzioni multiple).
Thomson scopri che negli atomi ci sono delle particelle piccolissime con carica negativa, gli elettroni. Immaginò che l'atomo fosse formato da elettroni (con carica negativa) che ruotavano all'interno di una sfera di carica positiva, Quindi, determinõ con i suoi esperimenti che l'atomo non è, in realtà indivisibile, ma formato da particelle più piccole, cioè particelle subatomiche, Il modello di Thomson è noto come 'modello a panettone".
Le Particelle Subatomiche
Protoni, Elettroni e Neutroni
Le particelle subatomiche Gli studi compiuti da Rutherford dimostrarono che la quantità di carica positiva contenuta in ciascun atomo è diversa tra i materiali.
Per spiegare questa caratteristica, Rutherford ipo- tizzò che il nucleo fosse composto da un numero variabile di particelle cariche positivamente, defi- nite protoni
Un protone è una particella subatomica carica po- sitivamente che si trova nel nucleo di un atomo. A ciascun protone è assegnata una carica pari a +1.
Le particelle che Thomson aveva individuato ven gono invece chiamate elettroni.
Un elettrone è una particella subatomica carica negativamente che si trova nello spazio attorno al nucleo. Ciascun elettrone ha carica pari a -1.
Gli esperimenti suggerivano che la massa dell'ato- mo fosse maggiore di quella che avrebbe dovuto essere rispetto alla sua carica positiva. Rutherford ipotizzò, quindi, l'esistenza di una terza particella subatomica: il neutrone,
Un neutrone è una particella subatomica che si trova nel nucleo dell'atomo. Ha una carica pari a 0 e massa quasi uguale a quella del protone.
Riassumendo, il modello atomico di Rutherford prevede un nucleo formato da un numero variabile di protoni e neutroni attorno al quale si trovano gli elettroni. Attenzione! Tutto ciò che gli scienziati co- noscono del nucleo e delle particelle subatomiche si basa sull'osservazione del comportamento del- le particelle, cioè su una prova indiretta della loro esistenza; non esiste, infatti, ancora nessuno stru- mento in grado di visualizzare l'interno dell'atomo.