Gli esteri: nomenclatura, trigliceridi e fosfolipidi in chimica organica
Slide dall'Università San Raffaele su Gli Esteri. Il Pdf approfondisce la nomenclatura e le reazioni di formazione degli esteri, i trigliceridi e i fosfolipidi, evidenziandone la struttura e l'importanza biologica per la Chimica a livello universitario.
Mostra di più18 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Università San Raffaele
Roma
Professore
Gilda Aiello
Argomento
Gli esteriT Università San Raffaele Roma Gilda Aiello
Gli Esteri
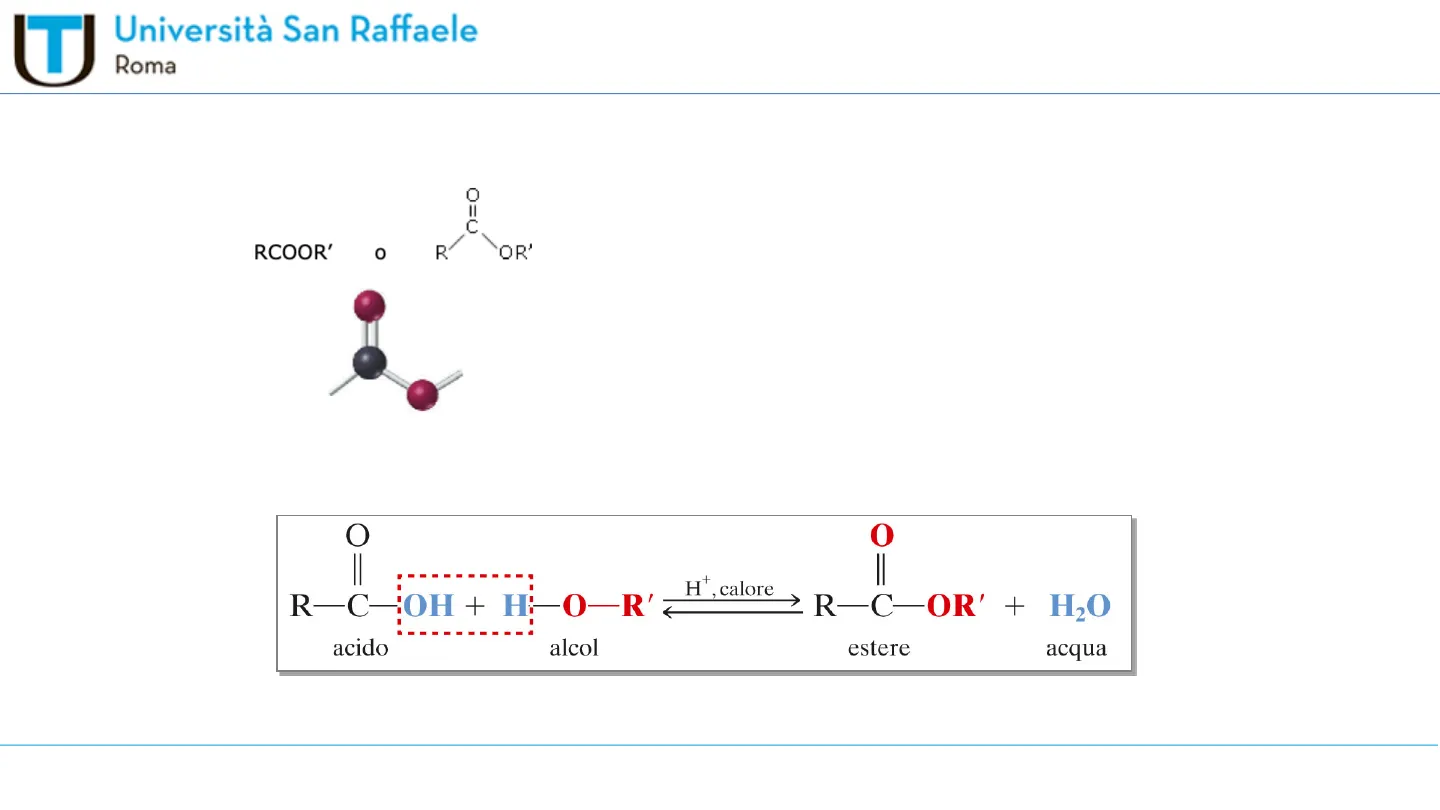
0=0 RCOOR' £ 0 R OR' prendono il nome dall'acido, cambiando il suffisso da - oico ad -ato, seguito dal nome del radicale alchilico R' presente nel gruppo -OR' Gli esteri si ottengono per reazione fra un acido carbossilico e alcol ad alta temperatura. O Il H+, calore R-C-OH + H-O-R' R-C-OR' + H20 acido alcol estere 0 II acqua
Gli esteri
2 di 18T
Esteri presenti in natura
Università San Raffaele Roma Gilda Aiello Gli esteri presenti in natura Esteri naturali ad alto peso molecolare sono le cere, i grassi e gli oli. Le cere sono esteri di un acido carbossilico e di un alcol entrambi a lunga catena. CH3(CH2)14-COO-(CH2)29CH3 palmitato di miricile (nella cera d'api) Molti esteri sono presenti in natura come aromatizzanti
Esteri e loro aromi
| Struttura | Nome | Aroma |
|---|---|---|
| HCO2CH2CH3 | formiato di etile | rum |
| CH3 CO2CH2CH2CH(CH3)2 | acetato di isopentile | banana |
| CH3 CO2CH2(CH2)6CH3 | acetato di ottile | arancia |
| CH3(CH2)2CO2CH3 | butanoato di metile | mela |
| CH3(CH2)2CO2CH2CH3 | butanoato di etile | ananas |
| CO2CH3 NH2 | 2-amminobenzoato di metile | uva |
Gli esteri
3 di 18T
Nomenclatura degli esteri
Università San Raffaele Roma Gilda Aiello Nomenclatura 0 HCOOCH3 C Metanoato di metile (Formiato di metile) H OCH3 0 CH3COOCH 3 C H3C' OCH3 0 CH3CH2COOC6H5 C CH3 CH2 0 0 C6H5COOCH 2CH3 C Benzoato di etile OCH2 CH3 0 CH3COSCH3 C Etantioato di metile H3C SCH3 Etanoato di metile (Acetato di metile) Propanoato di fenile
Gli esteri
4 di 18T
I trigliceridi come esteri
Università San Raffaele Roma Gilda Aiello I trigliceridi come esteri Al gruppo degli esteri appartengono due categorie di sostanze, molto importanti dal punto di vista biologico, trigliceridi e fosfolipidi. I trigliceridi sono esteri di acidi grassi a lunga catena, che come abbiamo già detto (E7-Acidi carbossilici) possono essere ottenuti per condensazione tra i gruppi - OH di un alcol trivalente (con 3 gruppi - OH), come il glicerolo, e i gruppi carbossilici - COOH degli acidi grassi. Nel processo di condensazione (esterificazione) vengono liberate 3 molecole d'acqua, una per ogni legame estere formato. I grassi animali e vegetali che li contengono devono ai trigliceridi le proprie caratteristiche chimiche e fisiche. R parte che deriva dall'acido R-COOH CH2-0++C=0 parte che deriva dal glicerolo R' parte che deriva dall'acido R'-COOH CH2-0++C=0 R" parte che deriva dall'acido R"-COOH CH2-O++C=0
Gli esteri
5 di 18T
I fosfolipidi
Università San Raffaele Roma Gilda Aiello I fosfolipidi I fosfolipidi hanno una struttura molto vicina a quella dei trigliceridi, essendo formati da glicerolo, due molecole di acidi grassi e una molecola di acido fo- sforico H3PO4, legata al terzo atomo di carbonio. I fosfolipidi rivestono un ruo- lo biologico molto importante perché, assieme alle proteine, formano le mem- brane cellulari. 0 II CH2-0-C 0 1 CH -0-C 0 II CH2-0-P-0-X I 0 Struttura di un fosfolipide, in cui è stato rappresentato in viola il glicerolo, in arancione le due molecole di acidi grassi, che formano le code idrofobe (impermeabili all'acqua) e in azzurro il gruppo fosfato, che costituisce la parte idrofila della molecola.
Gli esteri
6 di 18T
Metodi di sintesi degli esteri
Università San Raffaele Roma Gilda Aiello Metodi di sintesi degli esteri
- Esterificazione di Fisher
- Sostituzione nucleofila dei cloruri acilci
- Transesterificazione
Gli esteri
7 di 18T
a. Esterificazione di Fisher
Università San Raffaele Roma Gilda Aiello a. Esterificazione di Fisher In presenza di un catalizzatore acido o basico gli acidi carbossilici (e le anidridi) reagiscono con gli alcoli per dare esteri ed acqua RCOOH Acido carbossilico + R'OH -> RCOOR' Alcol Estere + H2O Acqua RCOOCOR Anidride + R'OH -> RCOOR' Alcol Estere + RCOOH Acido carbossilico 0 0 II R-C + HO-R' R-C-O-R' + H2O OH l'atomo di ossigeno presente nella molecola di acqua è quello presente nel gruppo OH della funzione carbossilica. Si tratta di una reazione di condensazione chiamata più specificamente reazione di esterificazione perché porta alla formazione di esteri, composti caratterizzati dalla presenza di un nuovo gruppo funzionale.
Gli esteri
8 di 18T
b. Sostituzione nucleofila dei cloruri acilci
Università San Raffaele Roma Gilda Aiello b. Sostituzione nucleofila dei cloruri acilci In presenza di una base debole, tipicamente la piridina, i cloruri acilici reagiscono con gli alcoli per dare esteri e cloruro di piridinio. RCOCI Cloruro acilico + R'OH + C5H5N Alcol Piridina - RCOOR' + Estere C5H5NH+CI" Cloruro di piridinio O N + CI HO CI C 0 + Z-I La reazione risente dell'impedimento sterico sull'alcol: reattività: alcoli 1ri > 2ri > 3ri
Gli esteri
9 di 18T
Meccanismo della sostituzione nucleofila
Università San Raffaele Roma Gilda Aiello Meccanismo O- - + CH3OH - R-C-CI RACI I OCH3 B H" + Basi terziarie N. N Piridina Trietilammina O R-C-CI + CI R OCH3 OCH3 N.B .: lo ione cloruro è una base più debole dello ione alcossido
Gli esteri
10 di 18T
c. Transesterificazione
Università San Raffaele Roma Gilda Aiello c. Transesterificazione Una transesterificazione è una reazione in cui un alcol sposta un altro alcol da un estere. RCOOR' + R"OH -> RCOOR" + R'OH Estere Alcol Estere Alcol La transesterificazione è catalizzata sia dagli acidi che dalle basi. Il meccanismo della reazione è quello già visto per l'esterificazione. Si tratta di una reazione di equilibrio e per spostare l'equilibrio verso i prodotti è necessario lavorare in presenza di un eccesso dell'alcol di cui si vuole ottenere l'estere oppure allontanare uno dei prodotti di reazione.
Gli esteri
11 di 18T
Transesterificazione: catalisi acida e basica
Università San Raffaele Roma Gilda Aiello O + O OH + CH3OH - permette di passare da un estere a un altro senza passare per l'acido - la reazione è catalizzata sia da acidi che da basi - è una reazione di equilibrio: si sposta l'equilibrio lavorando con l'alcol in eccesso
Catalisi acida
+ OH H+ -C-O - -C-0+ O-CH3 OH O OCH3 OCH3 -H+ - 0-CH3 + 1 OH
Catalisi basica
O R-C- O + R O R OCH3 O OCH3 CH30 OH OH + OH I + + + Hĺ CH3OH
Gli esteri
12 di 18T
Reattività degli Esteri
Università San Raffaele Roma Gilda Aiello Reattività degli Esteri Gli esteri sono meno reattivi dei cloruri acilici e delle anidridi nei confronti della sostituzione nuceofila acilica. In pratica possono essere convertiti in ammidi ed idrolizzati. 0 IL .C. R NH2 Ammide NH3 [H] O II O C R `OH H2O R"MgX R `OH Acido R OR' Estere O H H II C R H R OH Aldeide Alcol 1° R" R" / .C. C Alcol 3°
Gli esteri
13 di 18
Idrolisi degli Esteri
CT Università San Raffaele Roma Gilda Aiello Idrolisi degli Esteri L'idrolisi degli esteri è una delle reazioni più studiate e rappresenta uno dei meccanismo di sostituzione nucleofila acilica meglio compresi. Gli esteri sono relativamente stabili in soluzione acquosa neutra, ma subiscono idrolisi in presenza di acidi o basi forti.
Idrolisi acido-catalizzata
L'idrolisi di un estere in una soluzione acquosa acida diluita è la razione opposta dell'esterificazione di Fischer. I meccanismo di reazione, esattamente speculare rispetto all'esterificazione acido-catalizzata procede, come ogni altra sostituzione nucleofila acilica, in due stadi, ciascuno composto da tre passaggi. Nel primo stadio si forma l'intermedio tetraedrico, che si spezza nel secondo stadio.
Gli esteri
14 di 18T
Meccanismo dell'idrolisi acido-catalizzata
Università San Raffaele Roma Gilda Aiello 1º passaggio - Il catalizzatore protona l'ossigeno carbonilico dell'estere rendendo il carbonio carbonilico più elettrofilo e maggiormente sensibile ad un attacco nucleofilo. Il catione che si genera è stabilizzato per risonanza. :0: - H H + RC + H -- 0: RC + :0: + OR' H ÖR' H Estere Ione idronio Estere protonato 2º passaggio - Addizione nucleofila di una molecola d'acqua al carbonio carbonilico con formazione dell'internedio tetraedrico protonato H + I :O: + RC = R-C-OR' I H ÖR' O+ H H
Gli esteri
15 di 18
Passaggi successivi dell'idrolisi acido-catalizzata
:OHT Università San Raffaele Roma Gilda Aiello 3º passaggio - Deprotonazione dell'intermedio tetraedrico per ridare il catalizzatore e l'intermedio tetraedrico neutro .. :OH H R-C-OR' + :0: = R-C-OR' + H-6: H H HE I :OH :OH H H R' H R-C-OR' + HÒ H H H 5° passaggio - Dissociazione dell'intermedio in un alcol e in un acido carbossilico protonato : OH R' +ÖH R' R-C-O: 1. RC + :0: 1 :OH H OH H I R-C-0: + :0: I H 4º passaggio - Protonazione dell'ossigeno alcossidico dell'intermedio tetraedrico :OH :OH I :OH :OH
Gli esteri
16 di 18T
Idrolisi basica-catalizzata (SAPONIFICAZIONE)
Università San Raffaele Roma Gilda Aiello Idrolisi basica-catalizzata (SAPONIFICAZIONE) A differenza dell'idrolisi acido-catalizzata, l'idrolisi degli esteri catalizzata da una base è irreversibile, poiché in ambiente basico l'acido carbossilico viene trasformato nell'anione carbossilato, incapace di dare una sostituzione nucleofila acilica con l'alcol. OH -: saponificazione D O NaOH + H20 A O + Na + CH3-OH O Per ottenere l'acido carbossilico mediante un'idrolisi base-catalizzata è necessario acidificare i prodotti di reazione. L'acidificazione converte il carbossilato nell'acido carbossilico
Gli esteri
17 di 18T
Reazione con ammoniaca ed ammine
Università San Raffaele Roma Gilda Aiello Reazione con ammoniaca ed ammine Con ammoniaca o ammine (primarie e secondarie) a dare ammidi + NH3 4 + OH NH2 - le ammine sino più nucleofile degli alcoli (ricorda sintesi del paracetamolo) - la catalisi non è necessaria ma bisogna scaldare - importanza secondaria perche l'alcossido è comunque un cattivo gruppo uscente.
Meccanismo
O R-C-O R O + NHCH3 H R-C- O 1 R NHCH3 CH3NH2 H + HO- NHCH3