Patologie del sangue e sistema ematopoietico, Appunti di Patologia Ii e Fisiopatologia
Documento da Patologia Ii e Fisiopatologia su Patologie del Sangue e Sistema Ematopoietico. Il Pdf esplora la composizione del sangue, l'ematopoiesi e la sua regolazione, con schemi e immagini utili per lo studio universitario di Biologia.
Mostra di più14 pagine
Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Patologie del sangue e sistema ematopoietico
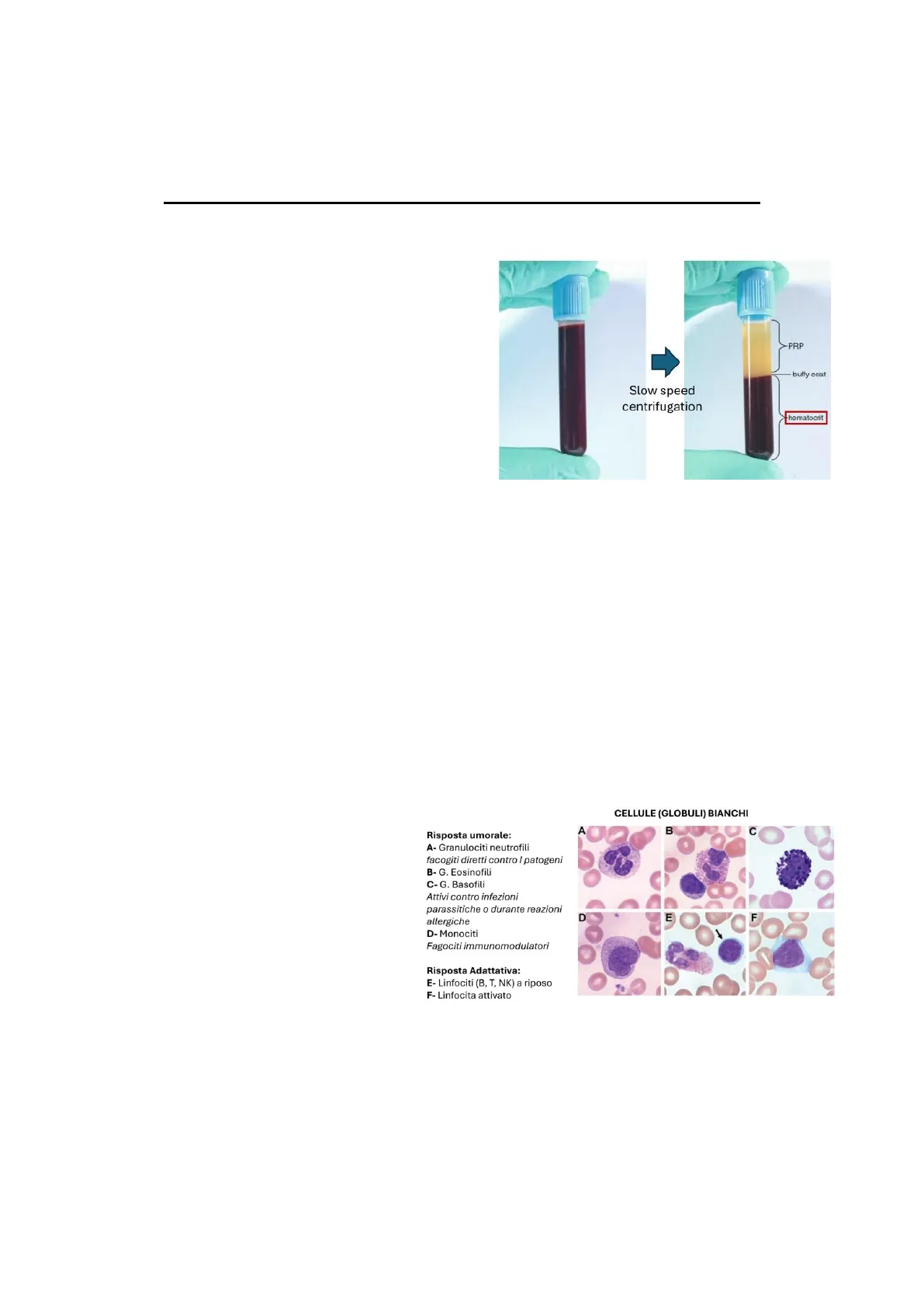
Patologia II e fisiopatologia, Lezione 2, 02/10/2024 Prof. Massimo Bonora PATOLOGIE DEL SANGUE E SISTEMA EMATOPOIETICO Il sangue è un tessuto completo, nonostante sia in forma liquida, ed è possibile osservarlo isolando un campione per poi "stratificarlo" attraverso centrifugazione. I centrifugati più semplici permettono di mettere in evidenza tre elementi che sono:
- il plasma che contiene ioni, ormoni, proteine e molecole solubili;
- Una grossa fetta rossa sul fondo, rappresentante i globuli rossi che compongono l'ematocrito;
- buffy coat, un anello bianco che separa le altre due fasi.
L'ematocrito contiene i globuli rossi, ossia gli eritrociti, che sono il più abbondante tipo di cellule all'interno del sangue. Queste cellule si sono evolute per massimizzare il trasporto di ossigeno, esprimendo altissimi livelli di emoglobina e acquisendo una forma particolare che è quella del " dischetto schiacciato", la quale massimizza la diffusione di gas all'interno della membrana plasmatica. Altre evoluzioni sono state la perdita del nucleo, in modo da deformarsi facilmente ed entrare anche nei vasi più stretti, e la rimozione di quasi tutti gli organelli intracellulari, in particolar modo i mitocondri, che altrimenti consumerebbero l'ossigeno trasportato.
Componenti del Buffy Coat
Nel buffy coat normalmente troviamo:
- granulociti neutrofili, principalmente coinvolti nella risposta umorale contro i patogeni;
. granulociti eosinofili e basofili, che si arricchiscono in condizioni particolari come la risposta contro certi parassiti o le reazioni allergiche;
Risposta Umorale e Adattativa
Risposta umorale: A- Granulociti neutrofili facogiti diretti contro I patogeni B- G. Eosinofili C- G. Basofili Attivi contro infezioni parassitiche o durante reazioni allergiche D- Monociti Fagociti immunomodulatori Risposta Adattativa: E- Linfociti (B, T, NK) a riposo F- Linfocita attivato CELLULE (GLOBULI) BIANCHI A B c C D E F
- monociti, che sono dei fagociti principalmente con attività immunomodulatoria;
- globuli bianchi della linea linfocitaria, che eseguono la risposta immunitaria adattativa, come linfociti T, linfociti B, linfociti NK. Questi normalmente sono presenti nella grande maggioranza dei casi in forma inattiva, apparendo con un grande nucleo e un cerchietto di citoplasma attorno (figura E) e raramente, se il soggetto è sano, si trovano anche in forma attiva con un citoplasma più espanso (figura F); 1
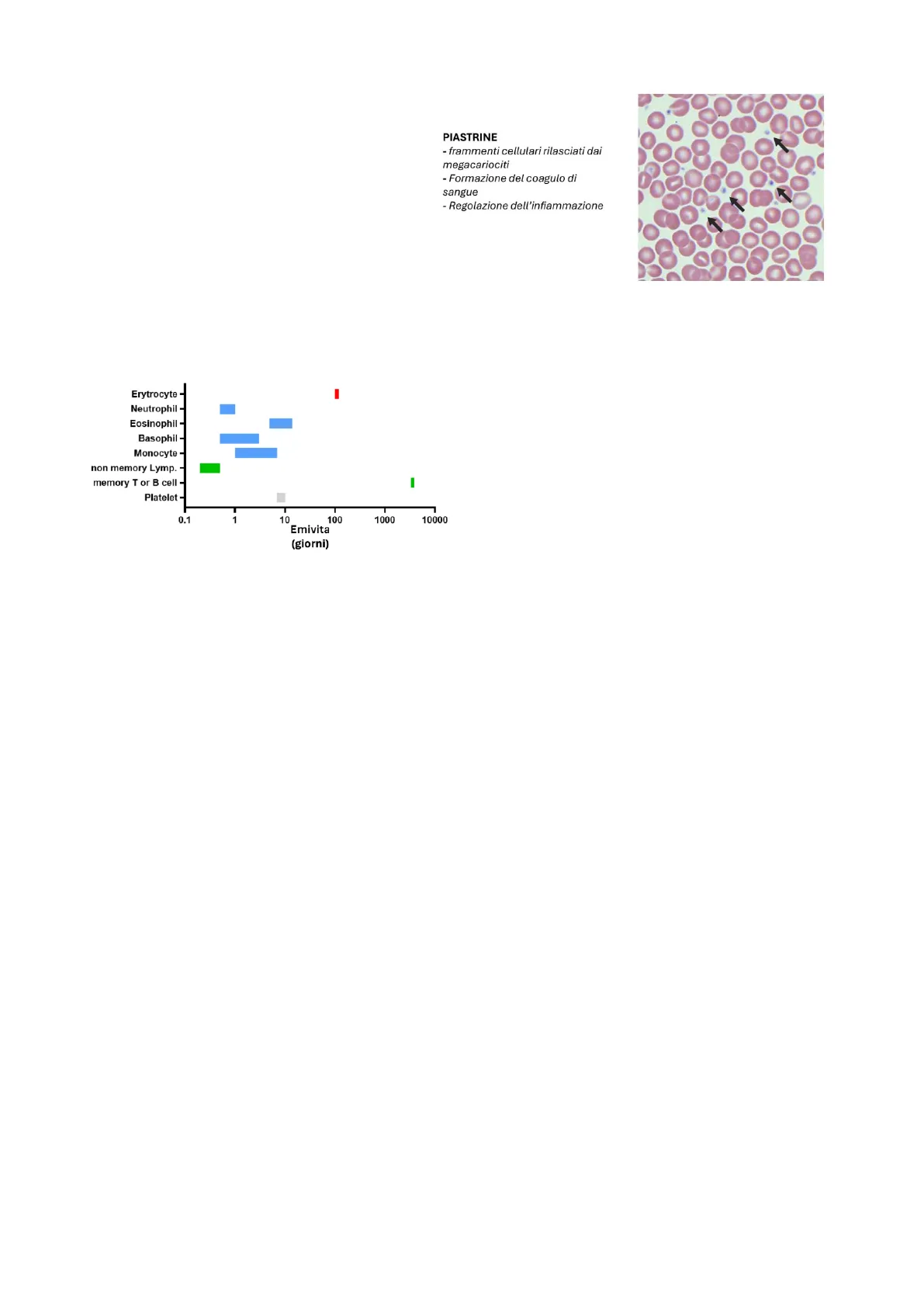
>PRP buffy coat Slow speed centrifugation hematocrit· le piastrine, che non sono vere e proprie cellule, ma frammenti di cellule rilasciati dai megacariociti. Le piastrine contengono molti organelli cellulari (ad esclusione del nucleo), i quali permettono loro di svolgere l'attività di coagulazione e di regolazione del processo infiammatorio.
Funzioni delle Piastrine
PIASTRINE - frammenti cellulari rilasciati dai megacariociti - Formazione del coagulo di sangue - Regolazione dell'infiammazione
Emivita delle cellule del sangue
Ematopoiesi Erytrocyte - Neutrophil - Eosinophil - Basophil - Monocyte - non memory Lymp. - memory T or B cell - Platelet - 0.1 10 100 1000 10000 Emivita (giorni) Tutta la componente cellulare del sangue, oltre ad avere una straordinaria variabilità di forma e funzione, ha anche un'elevata variabilità dell'emivita. Ci sono cellule del sangue estremamente vitali, come gli eritrociti, che durano 120 giorni. Altre cellule della componente linfocitaria, per esempio le cellule della memoria, possono durare invece diversi anni. Infine, ci sono cellule con un'emivita di diversi ordini di grandezza minore come i neutrofili o certi linfociti. Fondamentalmente, queste ultime sono tutte cellule del sistema immunitario che se stiamo bene non servono. L'organismo le produce in continuazione in modo da averne al bisogno, ma se non c'è un agente infettivo vengono degradate velocemente. Quindi c'è uno spettro molto grande di emivita delle cellule del sangue: da cellule che durano poche ore a cellule che durano anche fino a 10 anni. La maggior parte ha un'emivita relativamente breve (in media alcuni giorni o qualche settimana) e per effetto di questo si stima che, in ogni individuo adulto sano, circa 300/400 miliardi di cellule del sangue vengono degradate ogni giorno. Ciò significa che ci servono altrettante cellule nuove quotidianamente. Purtroppo però la maggior parte delle cellule del sangue sono cellule altamente differenziate, che quindi hanno una scarsa o nessuna capacità proliferativa (come i linfociti). Questo significa che se vogliamo rigenerare 400 miliardi di cellule ogni giorno non possiamo farlo partendo da quelle che abbiamo già nel sangue, ma avremo bisogno di due elementi in particolare: una cellula "sorgente" proliferante che in gergo viene detta cellula staminale o progenitrice ematopoietica e di un insieme di programmi differenziativi che possano trasformare questa cellula progenitrice in una cellula differenziata con una funzione ben precisa. L'insieme di questi elementi porta a quella che viene chiamata ematopoiesi che deriva dal greco e significa "fare sangue". 2
Ematopoiesi durante lo sviluppo
Ematopoiesi durante lo sviluppo L'ematopoiesi si evolve significativamente durante lo sviluppo fino al raggiungimento della maturità dell'individuo e comincia già nell'embrione a livello di alcune regioni del sacco vitellino chiamate isole ematologiche o sanguinarie. In queste regioni esistono delle cellule che si chiamano emangioblasti le quali sono le progenitrici che differenziano continuamente per produrre alcune forme cellulari mature del sangue. Questa forma di ematopoiesi viene detta "primitiva" ed è una forma di ematopoiesi incompleta, poiché questi emangioblasti non sono in grado di produrre tutti i tipi di cellule normalmente presenti nel sangue di un individuo. Bone marrow Fetal liver AGM Human Yolk sac Weeks 2 3 4 5 6 10 20 Primitive Pro-definitive Definitive Progenitors EMP LMP Pre-HSC EHT HSC Hemogenic angioblast Hemogenic endothelium Hemogenic endothelium p-Ery Gr B cell p-MK p-Mẹ Mcp MK T cell Producono principalmente eritrociti, megacariociti e quindi piastrine, e monociti. La maggior parte di queste cellule prodotte rimane confinata alla vita fetale. Alcuni di questi monociti, però, migrano in quelle zone del feto che diventeranno il cervello e daranno vita alla microglia; altre invece migrano in quelle zone che diventeranno il fegato e la milza, dando vita alle cellule di Kupffer.
Evoluzione dell'Ematopoiesi Prenatale e Postnatale
HEMATOPOIESIS. Arrivati alla terza settimana di sviluppo, 100%- Prenatal Postnatal l'ematopoiesi primitiva continua a . Yolk sac ·Bone marrow 80% ·Vertebral and pelvis funzionare, ma inizia ad emergerne una ·Liver .Tibial 60%- nuova. In particolare, in una regione del ·Sternum 40% feto che si chiama aorta-gonade- .Ribs Cellularity (%) 20%- .Lymph nodes ·Spleen mesonefro (AGM) compaiono delle · Femur 0% 5 nuove cellule dall'endotelio dell'AGM 0 12 3 4 7 8 9 : 20 10 40 30 50 60 70 6 fetal months birth age in years che hanno anch'esse la capacità di originare ematopoiesi. Rispetto a quelle del sacco vitellino hanno la capacità di generare tutte le componenti mature del sangue, quindi non solo piastrine, monociti ed eritroblasti, ma anche granulociti e linfociti. L'unica cosa che cambia è che queste sono cellule transitorie, quindi esistono in questa regione del feto AGM e rimangono in quello stato. A meno a mano che lo sviluppo del feto prosegue, a partire dalla sesta settimana, nei vasi che emergono dall'AGM compaiono dei nuovi tipi cellulari, ossia le cellule staminali ematopoietiche (HSC) che sono in grado di generare i progenitori importanti per l'ematopoiesi. Dalla sesta settimana in poi, la maggior parte dell'ematopoiesi del feto avviene nel fegato, dove le HSC trovano un ambiente ideale. Questa però non è una condizione stabile, poiché, a partire dal quinto mese, parte di esse migrerà dal fegato verso il midollo osseo. 3
Siti di Ematopoiesi nell'Adulto
A questo punto, quindi, le cellule staminali ematopoietiche cominciano a produrre una quota sempre maggiore di cellule, mentre il fegato ridurrà progressivamente il proprio contributo ematopoietico fino al momento della nascita, dove tutta l'ematopoiesi comincia ad avvenire solo nel midollo osseo. Si è misurato che inizialmente l'ematopoiesi avviene nel midollo osseo delle ossa lunghe, delle costole e del bacino. Progressivamente però le ossa lunghe perdono questa capacità, e a mano a mano che proseguiamo verso l'età adulta rimangono solo le vertebre e il bacino come siti responsabili dell'ematopoiesi.
Processo ematopoietico
L'ematopoiesi parte sempre da una cellula staminale ematopoietica che nell'adulto si trova all'interno del midollo osseo. Da qui partono dei percorsi differenziativi che vanno esclusivamente verso cellule che sono ad un grado di differenziamento più alto. Tra tutti i tipi di cellule, la cellula staminale ematopoietica è l'unica in grado di fare qualunque altra cellula del sangue o del midollo osseo, incluse le altre cellule staminali ematopoietiche. Questa cellula normalmente risiede nel midollo osseo ed è quiescente, cioè non è all'interno del ciclo cellulare o in attiva replicazione, ma può andare incontro a replicazione se richiesto. In condizioni fisiologiche si è stimato che in un individuo adulto una cellula staminale ematopoietica si divide una volta al mese. Quando la cellula staminale si divide, produce una cellula progenitrice multipotente, che non è più una cellula staminale, ma ha comunque la capacità di differenziarsi in tutte le linee mature. Questa cellula staminale multipotente è critica perché può proliferare (al contrario di una cellula staminale ematopoietica), quindi può duplicarsi e contribuire ad una espansione del numero di cellule che effettivamente differenzieranno. Le cellule staminali multipotenti vanno incontro ad un ulteriore passaggio: l'orientamento mieloide o linfoide. Significa che si producono dei progenitori, che vengono detti progenitore comune mieloide e progenitore comune linfoide, che hanno una capacità differenziativa ristretta: i progenitori mieloidi potranno fare solo cellule della linea mieloide come eritrociti o granulociti, mentre i progenitori linfoidi potranno diventare solo dei linfociti. Infine questi progenitori possono evolvere in quelle che vengono dette cellule precursori. Le cellule precursori sono cellule che hanno una sola possibilità di differenziare, andando incontro ad un unico percorso differenziativo, fino a quando non avranno la capacità di esercitare la funzione della cellula adulta. Questo schema di sviluppo dell'ematopoiesi è molto comune poiché l'ematopoiesi è il meccanismo di sviluppo di un tessuto che siamo riusciti a comprendere meglio e che spesso funziona come riferimento per capire i meccanismi di sviluppo di altri tipi di tessuti. Ricapitolando, si parte da una cellula staminale multipotente che va incontro a una serie di step di differenziamento caratterizzati da progenitori, fino a quando non si arriva a precursori che avranno un'unica linea differenziativa, ed infine alla cellula matura terminalmente differenziata. 4