Aminoácidos y Péptidos: Estructura y Comportamiento Ácido-Base en la Universidad de Sevilla
Diapositivas de la Universidad de Sevilla sobre Aminoácidos y Péptidos. El Pdf explora la estructura y el comportamiento ácido-base de estas moléculas, incluyendo la ecuación de Henderson-Hasselbach, ideal para estudiantes universitarios de Química.
Ver más43 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Aminoácidos y Péptidos
S u SEVILLA TEMA 3 .- AMINOÁCIDOS Y PÉPTIDOS Escuela Universitaria de Osuna
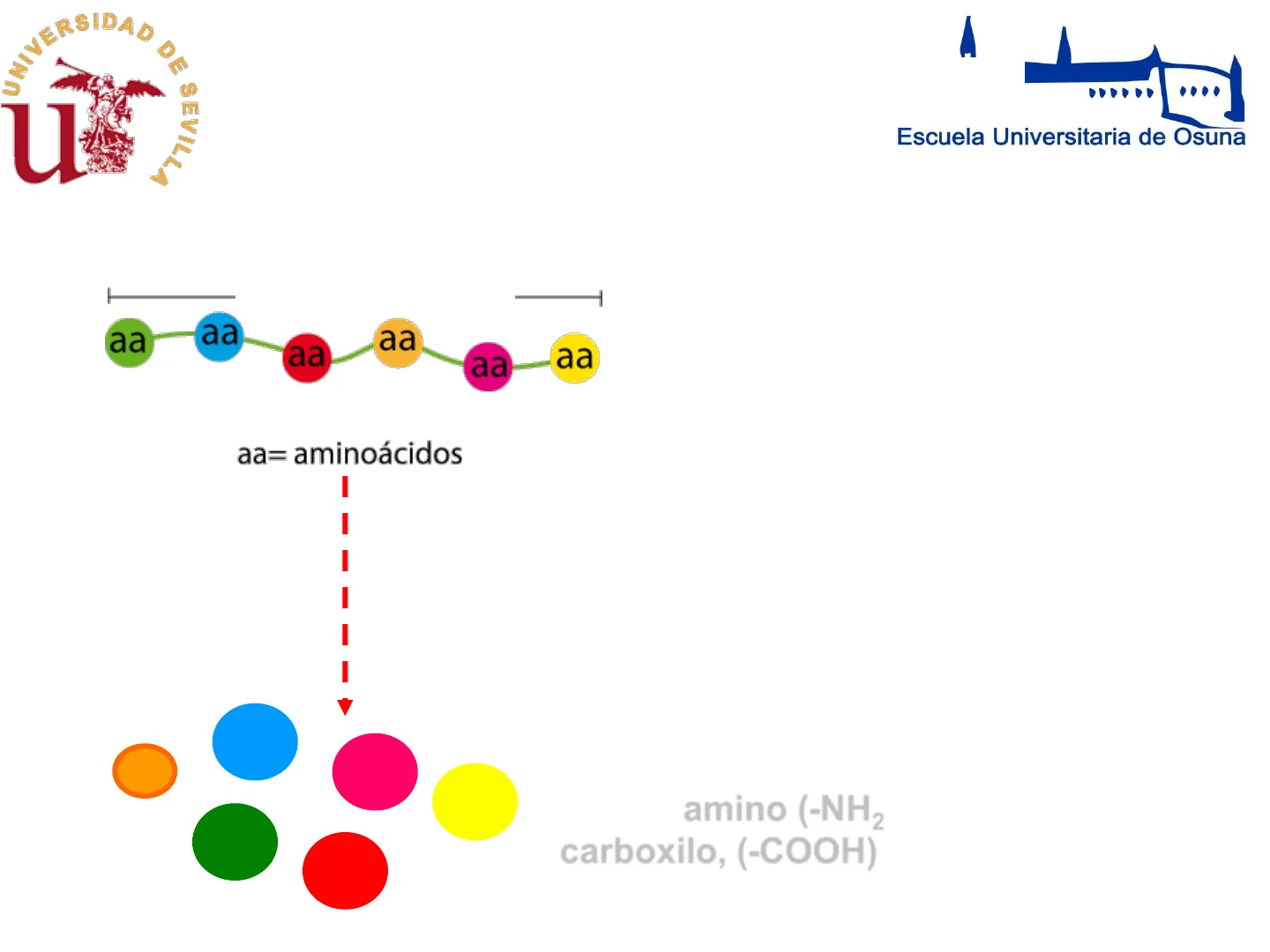
Proteína aa aa aa aa aa aa aa= aminoácidos I I Hidrólisis (HCI 6N, 110℃, 20 h) aa aa aa aa aa aa En el hidrolizado aparecen aminoácidos (AAs), compuestos que contienen una función amino (-NH2 )y una función carboxilo, (-COOH)Aminoácidos
Los aminoácidos son los precursores moleculares de las proteínas
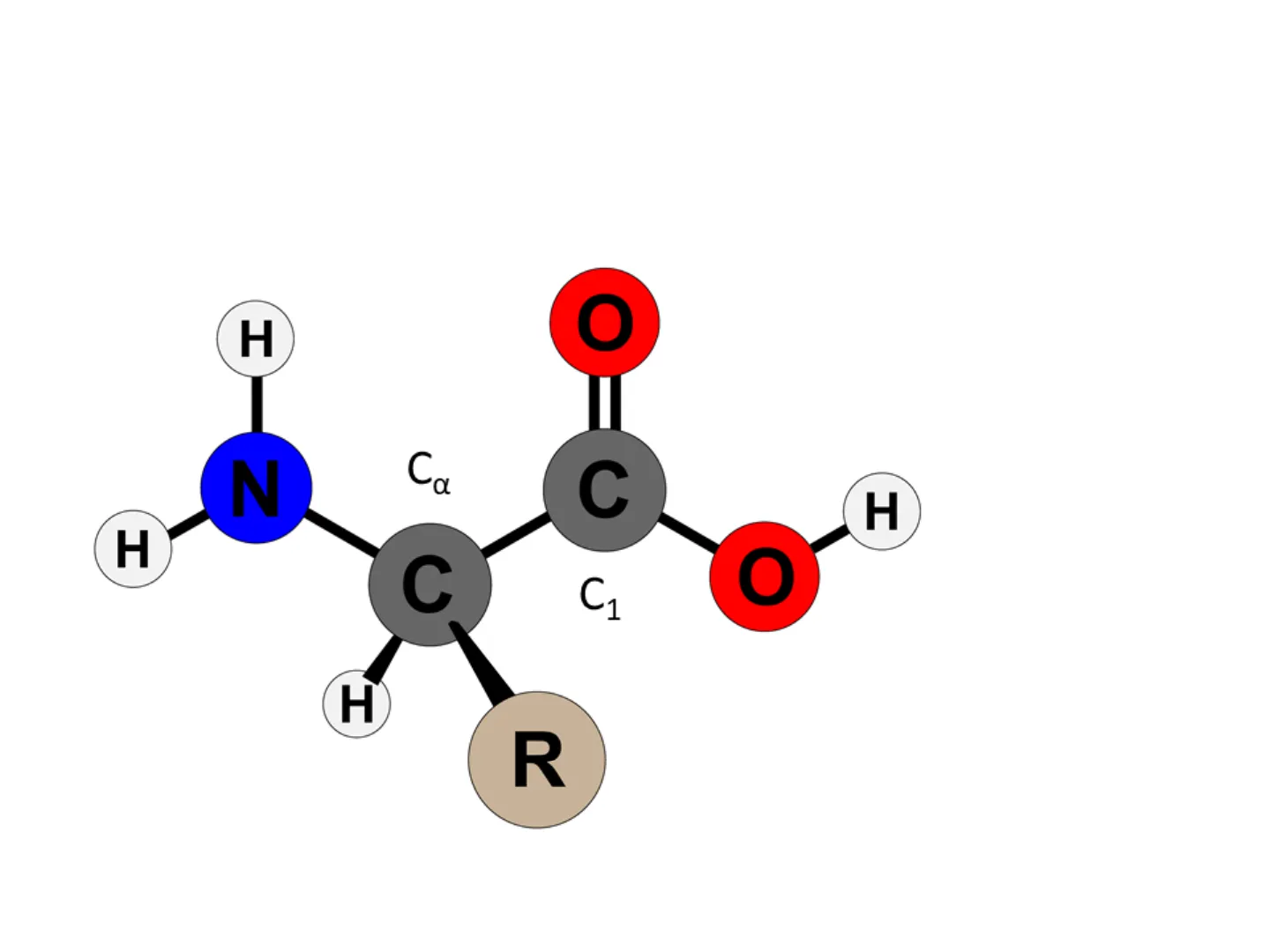
H Ca a N C H H C C1 1 H RH H H H H O H O pK2 H + pK1 + H N c c H N C c N c C H D H O O H R R R catión zwitterión anión Ecuación de Henderson Haselbach : relaciona el pK con el pH
Comportamiento Ácido-Base de los Aminoácidos
OComportamiento ácido-base de los aa - Los aminoácidos se encuentran cargados a PH fisiológico formando iones dipolares. Los aminoácidos poseen dos o tres grupos ionizables, por lo que se pueden comportar como ácidos o como bases (son sustancias anfóteras) - El estado de ionización de los aa varía con el pH. En medio ácido el grupo amino y carboxilo están protonados. En medio básico el grupo amino y carboxilo están desprotonadosEcuación de Henderson-Hasselbach
- Para los ácidos débiles HA H+ + A. pH = pK + log A F AH
- Para las bases débiles B + H +> BH+ B pH = pK + log [ [ BH+ pKa = valor del pH al que un electrolito débil se encuentra disociado en un 50%
Forma Zwitterión y Punto Isoeléctrico
- Forma zwiterion o ión híbrido: forma con carga eléctrica neta cero.
- Punto isoeléctrico, pI: pH para el cual la carga eléctrica neta del aminoácido es 0. (nº de cargas + = nº de cargas -)
- Si el pH < pI, la carga neta es + (más cargas + que cargas -)
- Si el pH > pl, la carga neta es - (más cargas - que cargas +)Aminoácido
Valores de pK y pI de Aminoácidos
pK1 (-COOH] pK2 (-NH2) pKR (cadena lateral) pl (punto isoeléctrico) Gly 2,34 9,6 5,97 Ala 2,34 9,69 6,01 Val 2,32 9,62 5,97 Leu 2,36 9,60 5,98 Ile 2,36 9,68 6,02 aa apolares Met 2,28 9,21 5,74 Cys 1,96 10,28 8,18 5,07 Phe 1,83 9,13 5,48 Trp 2,38 9,39 5,89 Pro 1,99 10,96 6,48 Ser 2,21 9,15 5,68 Thr 2,11 9,62 5,87 aa polares sin carga Asn 2,02 8,80 5,41 Gln 2,17 9,13 5,65 Tyr 2,20 9,11 10,07 5,66 Asp 1,88 9,60 3,65 2,77 Glu 2,19 9,67 4,25 3,22 aa polares con carga Lys 2,18 8,95 10,53 9,74 Arg 2,17 9,04 12,48 10,76 His 1,82 9,17 6 7,59AMINOÁCIDO
Formas Ácida y Básica de Aminoácidos
Forma ácida Forma básica Rango de pKa aproximado Lisina (Lys) -N+H3 IL -NH2 + H+ 7,6-10,6 Amonio Amina Arginina (Arg) -NH-C=N+H2 1 -NH-C=NH + H+ - NH2 11,5-12,5 NH2 Guanidinio Guanidino -C=CH / -C=CH 1 1 Histidina (His) HN N+H HN N + H+ 6,0-7,0 C H C H Imidazolio Imidazol Cisteína (Cys) -SH -S- + H+ 8,0-9,0 Tiol Tiolato Tirosina (Tyr) OH O + H+ 9,5-10,5 Fenol Fenolato Aspártico (Asp) Glutámico (Glu) -COOH -COO + H+ 3,0-5,5 Ácido carboxílico Carboxilato Bioquímica. Conceptos Esenciales Feduchi / Romero / Yáñez / Castiñeyra / Garcia-Hoz. Editorial Médica Panamericana @ 2015
Carga Eléctrica y pH de Aminoácidos
1- Forma zwiterion o ión híbrido: forma con carga eléctrica neta cero. - Punto isoeléctrico, pI: pH para el cual la carga eléctrica neta del aminoácido es 0. (nº de cargas + = nº de cargas -) - Si el pH < pI, la carga neta es + (más cargas + que cargas -) - Si el pH > pl, la carga neta es - (más cargas - que cargas +) COO + H3N-C-H | CH2 CH2 1 PH = 1 PH = 7 CH2 pH = 10 CH2 +NH3 PH = 12 Lisina (Lys,K)Los aminoácidos son estructuras tetraédricas
Estructura Tetraédrica de Aminoácidos
H R Ca NH3 COO Existen isómeros L y D de los aminoácidos (imágenes especulares, enantiómeros) C asimétrico: 4 sustituyentes distintos H R R H Ca Ca + + NH3 COO COO NH3 L isomer Dİsomer Solamente los L-aminoácidos forman parte de las proteínas R (3) H (4) (2) (1) Ca. COO NH3 Propiedades ópticassíntesis de proteínas
Síntesis de Proteínas y Código Genético
. V ADN Transcripción ARN ARN U U A G U G C C C T A G A A A A G A G G G A T C T T C T T C T Traducción: la síntesis de un polipéptido por medio del ARNt proteina Código Genético Aminoácido 3 Aminoácido 4 Aminoácido 1 Aminoácido 2 A U c USegunda base do códon U C A G U U UUU UUC UUA UUG Phe UCU- UCC UCA UCG UAU UAC Tyr UGU UGC Cys C UGA A UGG Trp G U C CUU CUC CUA CUG Leu CCU- CCC CCA CCG CAU CAC CAA CAG His CGU- CGC CGA CGG Arg A G U A AUU AUC AUA Ile ACU ACC ACA ACG Thy AAU AAC AAA AAG Asn Ser C A AGG G U G GUU GUC GUA GUG Val GCU GCC GCA GCG Ala GAU GAC GAA CAG Asp GGU GGC GGA GGG Gly C A G Los 20 aminoácidos estándares viene codificado por un triplete de bases según el código genético
Modificaciones Químicas de Aminoácidos
Modificaciones químicas Aminoácidos derivados o secundarios Primeira base do códon Terceira base do códon Lys AGU AGC AGA Arg AUG Met SER Leu UAA UAG C Pro Gin GluNOMENCLATURA LOS AMINOACIDOS
Nomenclatura y Clasificación de Aminoácidos
Abreviaturas de Aminoácidos
ABLE 3.2 Abbreviations for amino acids Amino acid Three-letter abbreviation One-letter abbreviation Amino acid Three-letter abbreviation One-letter abbreviation Alanine Ala A Methionine Met M Arginine Arg R Phenylalanine Phe F Asparagine Asn N Proline Pro P Aspartic Acid Asp D Serine Ser S Cysteine Cys C Threonine Thr T Glutamine Gln Q Tryptophan Trp W Glutamic Acid Glu E Tyrosine Tyr Y Glycine Gly G Valine Val V Histidine His H Asparagine or Asx B Isoleucine Ile I aspartic acid Leucine Leu L Glutamine or Glx Z Lysine Lys K glutamic acidCLASIFICACIÓN DE LOS AMINOACIDOS
Clasificación Química de Aminoácidos
a) Clasificación química. * Según la naturaleza de la cadena lateral R No polares. Carga positiva Polares. Sin carga Carga negativa
Clasificación Biológica de Aminoácidos
b) Clasificación biológica. * Proteicos * No proteicosNo polares
Aminoácidos No Polares Alifáticos
Alifáticos Nonpolar, aliphatic R groups COO COO COO- 1 + H3N-C-H H COO C + H2N CH 2 1 H2C CH 2 COO COO- COO + H3N-C-H + H3N-C-H 1 CH2 - CH2 + H3N-C-H 1 H-C-CH3 CH2 I CH3 Isoleucina Leucina (Leu,L) Metionina (Met M) (Ile, I ) Prolina (Pro, P) CH2 I CH / CH3 CH3 S I CH3 + H3N-C-H 1 CH3 CH / CH3 CH3 Glicina Gly,G) Alanina (Ala,A) Valina (Val, V) + H3N-C-HProlina SoloStocks ValinaNo polares
Aminoácidos No Polares Aromáticos
Aromáticos COO- + H3N-C-H 1 CH2 COO- H3N-C-H + CH2 C=CH NH Fenilalanina (Phe,F) Triptófano (Trp, W)Polares
Aminoácidos Polares Sin Carga
Sin carga COO- COO- H3N-C-H 1 + COO- + H3N-C-H CH2OH H-C-OH CH2 1 CH3 I SH Serina (Ser,S) Treonina (Thr,T) Cisteína (Cys,C) COO + H3N-C-H CH2 OH Tirosina (Tyr, Y) COO- + H3N-C-H CH2 C H2N O Asparragina (Asn,N) COO- + H3N-C-H CH2 I CH2 C H2N Glutamina(Gln,Q) H3N-C-H +Polares
Aminoácidos Polares Cargados Positivamente
Cargados positivamente COO- COO- COO + H3N-C-H + H3N-C-H 1 CH2 I CH2 I CH2 CH2 I CH2 CH2 NH + C=NH2 I NH2 Arginina (Arg,R) + H3N-C-H CH2 I C-NH CH C-NH+ H CH2 +NH3 Lisina (Lys,K) Histidina (His,H)Polares
Aminoácidos Polares Cargados Negativamente
Cargados negativamente COO- I COO I + H3N-C-H H3N-C-H + CH2 I COO- CH2 2 I CH2 2 COO - Aspartato (Asp,D) Glutamato (Glu,E)Aminoácidos derivados o secundarios
Aminoácidos Derivados o Secundarios
Aminoácidos formados por modificaciones químicas de los aminoácidos estándares
Hidroxilaciones de Aminoácidos
HIDROXILACIONES H HO C CH2 H2C CH-COO- + N H H 4-hidroxiprolina H3N-CH2-CH-CH2-CH2-CH-COO OH I + NH3 5-hidroxilisina Colágeno
Metilaciones de Aminoácidos
METILACIONES CH3)-NH-CH2-CH2-CH2-CH2-CH-COO - +NH3 6-N-metillisina Fibras musculares
Carboxilaciones de Aminoácidos
CARBOXILACIONES COO "OOC-CH-CH2-CH-COO I +NH3 y-carboxiglutamato Activación de factores de coagulación por unión de iones calcioAminoácidos derivados o secundarios
Fosforilaciones y Oxidaciones de Aminoácidos
FOSFORILACIONES OXIDACIONES COO- COO- + 1 + H3N-CH H3N-CH CH2 2H+ + 2e- SH S Cistina SH 1 2H+ + 2e- S CH2 + CH-NH3 + CH-NH3 NH3+ COO- COO- Fosfoserina Intermediario metabólico Formación de puentes disulfuro I 1 CH2 Cisteína C-00- H --- C-CH2-(O-PO3= Cisteína - CH2Otros compuestos derivados de los aminoácidos estándares
Otros Compuestos Derivados de Aminoácidos
HO I I N 00C -CH2 CH2 + H3N -CH2 CH2 HO CH2 HO 0 CH2 N H + H3N-CH2 + H3N-CH2 I I H3N-CH-COO y-Aminobutírico (GABA) listamina Dopamina Tiroxina 1 I + Más de 3000FUNCIONES NO PROTEICAS DE LOS AMINOACIDOS Y DERIVADOS
Funciones No Proteicas de Aminoácidos y Derivados
A) NEUROTRANSMISORES: Gly, Asp, Glu, GABA (ácido g-amino butírico), dopamina. B) HORMONAS: TIROXINA (T4), TRIYODOTIRONINA (T3). C) MEDIADORES DE LA ALERGIA: HISTAMINA D) INTERMEDIARIOS METABÓLICOS: FOSFOSERINA, CITRULINA,AMINOÁCIDOS ESENCIALES
Aminoácidos Esenciales
Aminoácidos que deben de ser incorporados en la dieta
- Valina
- Leucina
- Isoleucina
- Fenilalanina
- Triptófano
- Treonina
- Metionina
- Lisina
Las bacterias y las plantas superiores sintetizan todos los aminoácidos Durante el crecimiento, embarazo y lactancia, además se consideran esenciales Arginina e HistidinaPÉPTIDOS
Péptidos
- Los péptidos y proteínas son polímeros de aminoácidos unidos a traves de enlaces peptídicos (R-CO-NH-R) .
- El enlace peptídico es un enlace covalente tipo amida, formado por la condensación de un grupo a-carboxilo de un aa y un grupo a-amino de otro AA, y la eliminación de una molécula de H2O. Aminoácido 1 H Aminoácido 2 H H H H N c c N c c H O O R R H Enlace peptídico H H N c C H H H O N c c R H D R Dipéptido Agua O O H H O HUn péptido es la unión de un número limitado de aminoácidos, hasta cincuenta
Clasificación de Péptidos por Residuos
H R1 R2 R1 0 H H C O C 0 1 + +H3N C +H3N C +H3N C C - - 0 0 H R2 Enlace peptídico * Oligopéptidos o péptidos: < 50 residuos * Polipéptidos: 50-100 residuos. * Proteínas: >100 residuos. C N C=O + H20 0 HENLACE PEPTÍDICO
Enlace Peptídico
Tras la formación del enlace peptídico el compuesto resultante (peptido y/o proteína) muestra un grupo amino libre en un extremo (extremo-N terminal) y un grupo carboxilo libre (extremo-C terminal). OH CH3 CH3 CH CHOH H H H CH2 H CH3 H CH2 + H3N-C- 1 TT 1 -C-N-C-C-N-C-C-N-C-C-N-C-COO II I II Ö H Ö H Ö H Ö H Amino- terminal end Carboxyl- terminal endEn las proteínas:
Longitud y Características del Enlace Peptídico
- Longitud del enlace C - N es de 1,33 Å: es decir, aproximadamente un 10% más corto que la longitud de un enlace C-N normal (1,49 Å) y un 5% mayor que un enlace C=N (1,27A).
- Longitud del enlace C = O es de 1,23 Å: es decir un 0,02% mayor que la longitud de enlace encontrada en aldehídos y cetonas. Garrett & Grisham: Biochemistry, 2/e Figure 5.2 O 0.123nm H R 121.1° 123.2° 0.152nm C 0.133nm 121.9º 0.145nm Ca 115.6° Ca 1 119.5° 118.2° H R 0.1nm H Saunders College Publishing VI NTeoría de la resonancia
Teoría de la Resonancia del Enlace Peptídico
Las características de enlaces y ángulos mostrados por el estudio de difracción de rayos-X hicieron suponer a Pauling y colaboradores, que la estructura real del enlace peptídico podría ser una estructura en resonancia. 8- O 0 0 C C 8+ Ca 'a C + C N C N C N a a I H H a c b „Ca a a a -ICarácter parcial de doble enlace del enlace peptídico
Carácter de Doble Enlace y Polaridad del Enlace Peptídico
« orbital R H Ca 0 151 0.102 116° H 1115 N 0.1495 C 120.5° C 122º 123.5° 0 124 0 H R (b) Bo C-N C=N H H 60% 40%
- El enlace peptídico es polar
- No se permite el giro alrededor del enlace -C-N-
- Puede presentar isomería cis-trans 1:3 min T3 El enlace peptídico 1.30 MIN.mp4 H Co N C. 0 # orbital