Resumen sobre aminoácidos, proteínas y ácidos nucleicos de Anaya
Documento de Anaya sobre Resumen. Las proteínas y los ácidos nucleicos. El Pdf detalla la estructura y clasificación de aminoácidos y proteínas, incluyendo sus propiedades y funciones biológicas. Es un material de Biología para Bachillerato.
Ver más18 páginas
Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Los aminoácidos
Estructura y clasificación de los aminoácidos
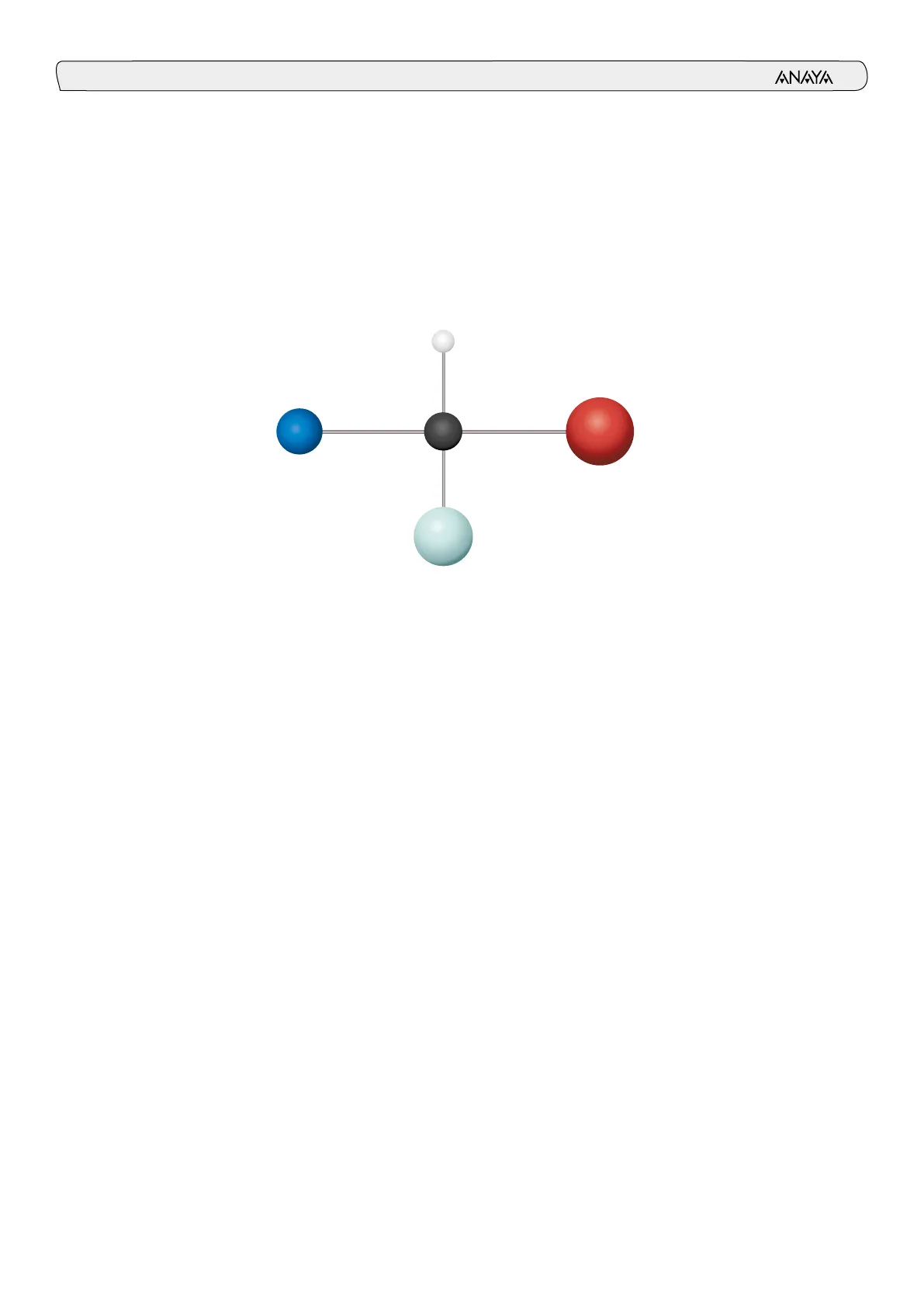
Los aminoácidos son moléculas orgánicas sencillas, que contienen un grupo ami- no (-NH2), un grupo carboxilo (-COOH) y una cadena lateral o grupo R, unidos a un átomo de carbono, denominado carbono a. Son los monómeros cuya unión da lugar a los péptidos y a las proteínas. Existen muchos aminoácidos distintos, pero solo 20 forman las proteínas: aminoá- cidos proteicos. H Grupo amino Grupo carboxilo H2N C COOH Carbono o R Cadena lateral o grupo R La clasificación de los aminoácidos: según la polaridad del grupo R se clasifican en:
- Neutros apolares: R hidrófoba sin carga.
- Neutros polares: R hidrófila sin carga.
- Ácidos: R con un grupo carboxilo cargado negativamente.
- Básicos: R con un grupo amino cargado positivamente.
En los organismos heterótrofos algunos aminoácidos deben ser ingeridos a través de la dieta, por lo que se denominan aminoácidos esenciales. En el ser humano son siete.
Propiedades de los aminoácidos
Solubles en agua, cristalizables y sólidos. Presentan comportamiento anfótero y esteroisomería.
Comportamiento anfótero de los aminoácidos
Pueden comportarse como ácidos o como bases, según el pH de la disolución acuosa en la que se encuentren. Este comportamiento, anfótero, permite amorti- guar los cambios de pH (son un sistema tampón natural) y se debe a la presencia de los grupos amino y carboxilo.
- Si la disolución es neutra: el grupo carboxilo se carga negativamente (-COO-) y el grupo amino se carga positivamente (-NH2+). Así se genera un ion dipolar neutro (zwitterión). Al pH al que un aminoácido forma un ion dipolar se le llama punto isoeléctrico (pI).
- Si la disolución es ácida: (muchos H+) el grupo carboxilo capta un protón (-COOH) por lo que el aminoácido actúa como una base y queda cargado positivamente (-NH3+).
- Si la disolución es básica: (pobre en H+), el grupo amino pierde un protón (-NH2) por lo que el aminoácido actúa como un ácido y queda cargado negativamente (-COO-).
@ Grupo Anaya, S. A. Material imprimible autorizado. 1/18Biología 2.º Bachillerato
Esterioisomería de los aminoácidos
Todos los aminoácidos, excepto la glicina, tienen isomería espacial o estereoiso- mería, debido a que su carbono a es asimétrico. Presentan enantiómeros D (grupo amino a la derecha) y L (grupo amino a la iz- quierda). Los aminoácidos proteicos son L. Los aminoácidos tienen actividad óptica: isómeros ópticos dextrógiros y levógiros.
El enlace peptídico
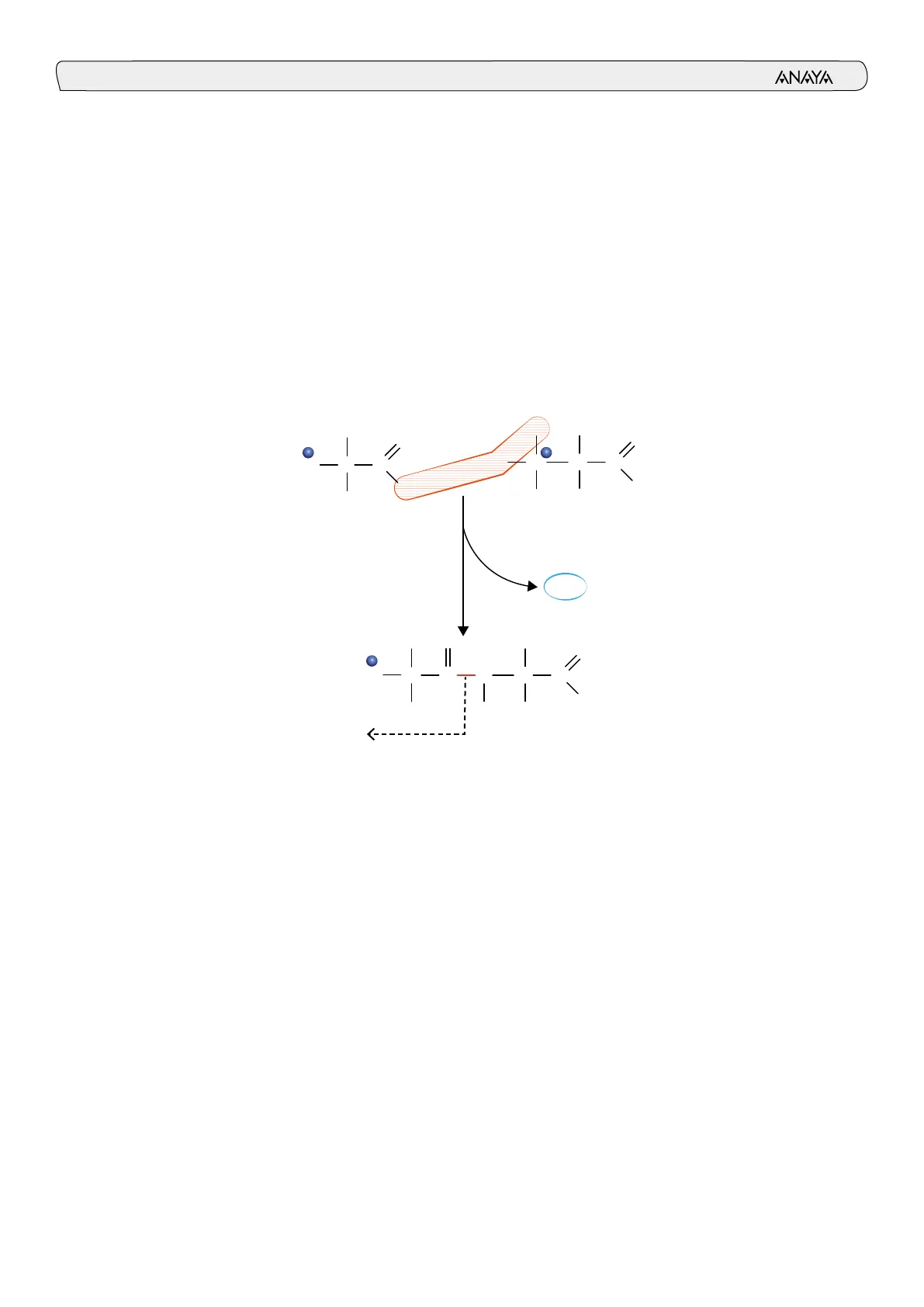
Es la unión entre el grupo carboxilo de un aminoácido y el grupo amino de otro aminoácido (reacción de condensación). Da lugar a una amida y una molécula de agua. Una vez unidos, los aminoácidos se denominan residuos de aminoácidos. R H H O O + H3N =~~ + + HAN -C-C 1 H O- H R2 H2O R O H O + H3N-C-C --- N-C-C C I O- H H R2 Enlace peptídico <- Los péptidos son polímeros formados por aminoácidos unidos por enlaces peptí- dicos.
- Oligopéptidos: 2-10 aminoácidos: dipéptidos, tripéptidos, tetrapéptidos, etc.
- Polipéptidos: 10-60 aminoácidos.
- Proteínas: más de 60 aminoácidos. Formadas por una cadena polipeptídica o por varias.
El enlace peptídico es un enlace covalente y tiene carácter parcial de doble en- lace (tamaño entre doble y simple). Es un enlace rígido, en el que los átomos im- plicados quedan en un solo plano y no pueden rotar.
La estructura de las proteínas
Para que una proteína pueda realizar su función biológica, es necesaria una deter- minada estructura tridimensional (configuración que adopta la secuencia de ami- noácidos en el espacio) que puede tener hasta 4 niveles de organización: la estruc- tura primaria, la estructura secundaria, la estructura terciaria y la estructura cuaternaria.
La estructura primaria
@ Grupo Anaya, S. A. Material imprimible autorizado. 2/18 1 I 0- Resumen. Las proteínas y los ácidos nucleicosBiología 2.º Bachillerato Resumen. Las proteínas y los ácidos nucleicos ANAYA ESTRUCTURA PRIMARIA Aminoácido Extremo C-terminal - +H3N- (Ala-Ser-Leul. Asp Tyr Ard Cys Phê Extremo N-terminal Pro Lys Enlace peptídico C C N C C N O C R R Estructura a-hélice H N C C R R C --. N H O C R R -C-C H R H H C O H R C H C O H O H C N H O C O C R H H R H R N-C-C H C O H C C N N O R C N O C R H R R -C-C H H C O H C C R C N H C O H O R C C H N O C H H Es la secuencia ordenada de los aminoácidos que constituyen la proteína. Es es- pecífica para cada proteína y determina el resto de estructuras (y por tanto, su función). Esta determinada geneticamente. Disposición de los aminoácidos: lineal en zig-zag. La cadena presenta un extremo N-terminal con un grupo amino libre y un extremo C-terminal, con un grupo car- boxilo libre.
La estructura secundaria
Es el plegamiento local de la cadena de aminoácidos en cada sección. Adopta dos configuraciones mayoritarias:
- La estructura a-hélice. La cadena polipeptídica forma una hélice. Se mantiene gracias a enlaces de puente de hidrógeno en el interior de la hélice.
- La estructura ß-láminar u hoja plegada. Se produce cuando dos cadenas poli- peptídicas se disponen paralelas o antiparalelas, en forma de zigzag. Se esta- blecen puentes de hidrógeno entre los esqueletos peptídicos.
@ Grupo Anaya, S. A. Material imprimible autorizado. Estructura ß-laminar N C R C R C R C H O C C R C O= O C C N H N C R-C O H N C C O N EO C R C-R R O=C C C-R 1 R C R-Ć C O N R-C R-C C=OWH-N C H-N N C=O C=OWH-N C O H H N C O Enlace puente de hidrógeno C O C N H O C O N-HwO=C R C O H R- C R-( =OWH-N H N C R R C H H C C R H R N-HwO=C 1 N H H N R C R O R Nº 1 C C C C N N N H H C O R R C H N R H C N H Enlace puente de hidrógeno O H C O C C H O C C N H R ESTRUCTURA SECUNDARIA H R R Thr eu Hys Lys Asn -COO C C C HwO=C N-H C=OWH- N-HwO=C N H H Cadena lateral O C 3/18 C YalBiología 2.º Bachillerato
La estructura terciaria
Es la forma que adopta en el espacio la cadena polipeptídica. Para muchas proteí- nas, este es el nivel máximo de estructura. Así, las proteínas adquieren una forma tridimensional global, denominada conformación que se mantiene gracias a inte- racciones químicas entre grupos de las cadenas laterales (-R) de los aminoácidos. Estas interacciones pueden ser:
- Puentes de hidrógeno.
- Interacciones electroestáticas entre grupos con carga eléctrica opuesta de los -R.
- Interacciones hidrofóbicas.
- Puentes disulfuro entre cisteínas.
Las proteínas pueden adoptar dos tipos de conformación:
- Conformación globular: compacta y aproximadamente esférica. Soluble. Típica de proteínas de función dinámica (Ej: hemoglobina).
- Conformación fibrosa: alargada, que hace a la proteína insoluble. Proteínas de función estructural (Ej: colágeno).
La estructura cuaternaria
Es la unión de varias cadenas polipeptídicas o monómeros (iguales o diferentes), que dan lugar a dímeros, trímeros, tetrámeros, etc. Se presenta solo en algunas proteínas.
La estructura nativa de una proteína
Es la única conformación tridimensional en la que la proteína es biologicamente activa. Depende de la secuencia de aminoácidos de la proteína. Es la estructura energéticamente más estable. Las proteínas la adquieren a medida que se sinteti- zan en los ribosomas. Existen proteínas, las carabinas moleculares, que asisten al correcto plegamiento de muchas proteínas.
Propiedades, características y funciones de las proteínas
Propiedades de las proteínas
Las propiedades de las proteínas dependen sobre todo de la naturaleza de los aminoácidos que las forman. Las principales propiedades son:
- La solubilidad: se debe a la presencia de aminoácidos polares, cuyas cadenas laterales establecen puentes de hidrógeno con el agua (la proteína queda cubier- ta de una capa de moléculas de agua, lo que la mantiene soluble). La mayoría de las proteínas globulares son solubles y las proteínas fibrilares suelen ser insolubles en agua.
- La especificidad: es consecuencia del elevado número de combinaciones en la
secuencia de aminoácidos de la proteína (estructura primaria), que determina a
su vez el resto de estructuras y, por tanto, la función. Las proteínas presentan
especificidad a dos niveles:
- A nivel de función. Dependiendo de la secuencia de aminoácidos, cada proteí- na lleva a cabo una función determinada. Un cambio en la secuencia y, por tanto, en la estructura, puede producir una pérdida o alteración de su función.
- A nivel de especie. A diferencia de lo que ocurre con los glúcidos y lípidos, que son comunes a todos los seres vivos, las proteínas son exclusivas de cada es- pecie, incluso dentro de una misma especie hay diferencias entre distintos in- dividuos. Se denominan proteínas homólogas a aquellas que desarrollan la
@ Grupo Anaya, S. A. Material imprimible autorizado. 4/18Biología 2.º Bachillerato Resumen. Las proteínas y los ácidos nucleicos ANAYA misma función en diferentes especies. La semejanza entre ellas es un indicativo del grado de parentesco entre especies y una herramienta para establecer re- laciones filogenéticas.
- La desnaturalización: consiste en la pérdida de la estructura nativa de la proteí-
na cuando se rompen los enlaces y las interacciones que la mantienen. La proteína
deja de ser activa, coagula y precipita. Mantiene su estructura primaria (los en-
laces peptídicos no se ven afectados). La desnaturalización se puede producir por:
- Un aumento de temperatura: modifica las interacciones entre -R.
- Cambios extremos de pH: alteran la distribución de cargas en la molécula.
- La presencia de determinadas sustancias químicas, como la urea.
La desnaturalización puede ser reversible ya que, al no afectar a los enlaces pep- tídicos, cuando cesa el agente causante y se recuperan las condiciones normales, las proteínas pueden sufrir un proceso de renaturalización y adquirir de nuevo la estructura nativa.
- Capacidad amortiguadora del pH Las proteínas son sustancias anfóteras, que pueden comportarse como un ácido o como una base, y amortiguar así las variaciones de pH del medio.
Características de las proteínas
Las principales características de las proteínas son: la abundancia (en los animales, son las biomoléculas orgánicas más abundantes). La variabilidad (presentan una gran diversidad: son una expresión de la variabilidad genética). La diversidad fun- cional.
Funciones de las proteínas
Su gran diversidad estructural hace que tengan variadísimas funciones.
- La función estructural: las proteínas, sobre todo las fibrosas, se encargan de
proporcionar un soporte mecánico:
- A nivel celular: Glucoproteínas: membranas celulares. Actina y la tubulina: microtúbulos del citoesqueleto, cilios y flagelos. Histonas: forman la cromatina (unidas al ADN).
- A nivel tisular: Queratinas: pelo, uñas ... Elastina: tejidos reticulares. Colágeno: tejidos conectivos (Ej: cartílago).
- La función de transporte:
- A nivel celular. Permeasas: membrana plasmática (regulan el paso de sustancias).
- A nivel de organismo: Hemoglobina/hemocianina: transporte de oxígeno a través de la sangre/hemolinfa. Mioglobina: transporta y almacena oxígeno en los músculos. Lipoproteínas: transportan lípidos.
- La función enzimática: las enzimas se encargan de catalizar o acelerar las reac- ciones químicas metabólicas que tienen lugar en la célula y en el organismo.
- La función hormonal: Hormonas luteinizante (LH) y foliculoestimulante (FSH): regulan el ciclo ovárico. Insulina y glucagón: regulan el metabolismo de la glucosa.
- La función de defensa: Anticuerpos (inmunoglobulinas): defienden al organismo de patógenos y sustancias extrañas. Fibrinogeno y trombina: coagulación san- guínea.
@ Grupo Anaya, S. A. Material imprimible autorizado. 5/18