Unidad de Trabajo 2, Parte II: Extracción y Purificación de Ácidos Nucleicos
Documento de Universidad sobre Unidad de Trabajo 2. Parte II. El Pdf aborda la extracción y purificación de ácidos nucleicos, detallando la estructura de células procariotas y eucariotas, así como el pretratamiento de muestras biológicas. Este material de Biología es útil para estudiantes universitarios, explicando técnicas de homogeneización mecánica y química para preparar muestras.
Ver más27 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Introducción a la Extracción y Purificación de Ácidos Nucleicos
Unidad de trabajo 2. Parte II ÁCIDOS NUCLEICOS. EXTRACCIÓN Y PURIFICACIÓN
Introducción
Los ácidos nucleicos se encuentran confinados en el interior de las células, bien en el núcleo, bien en el citoplasma o bien en orgánulos celulares como las mitocondrias o los cloroplastos.
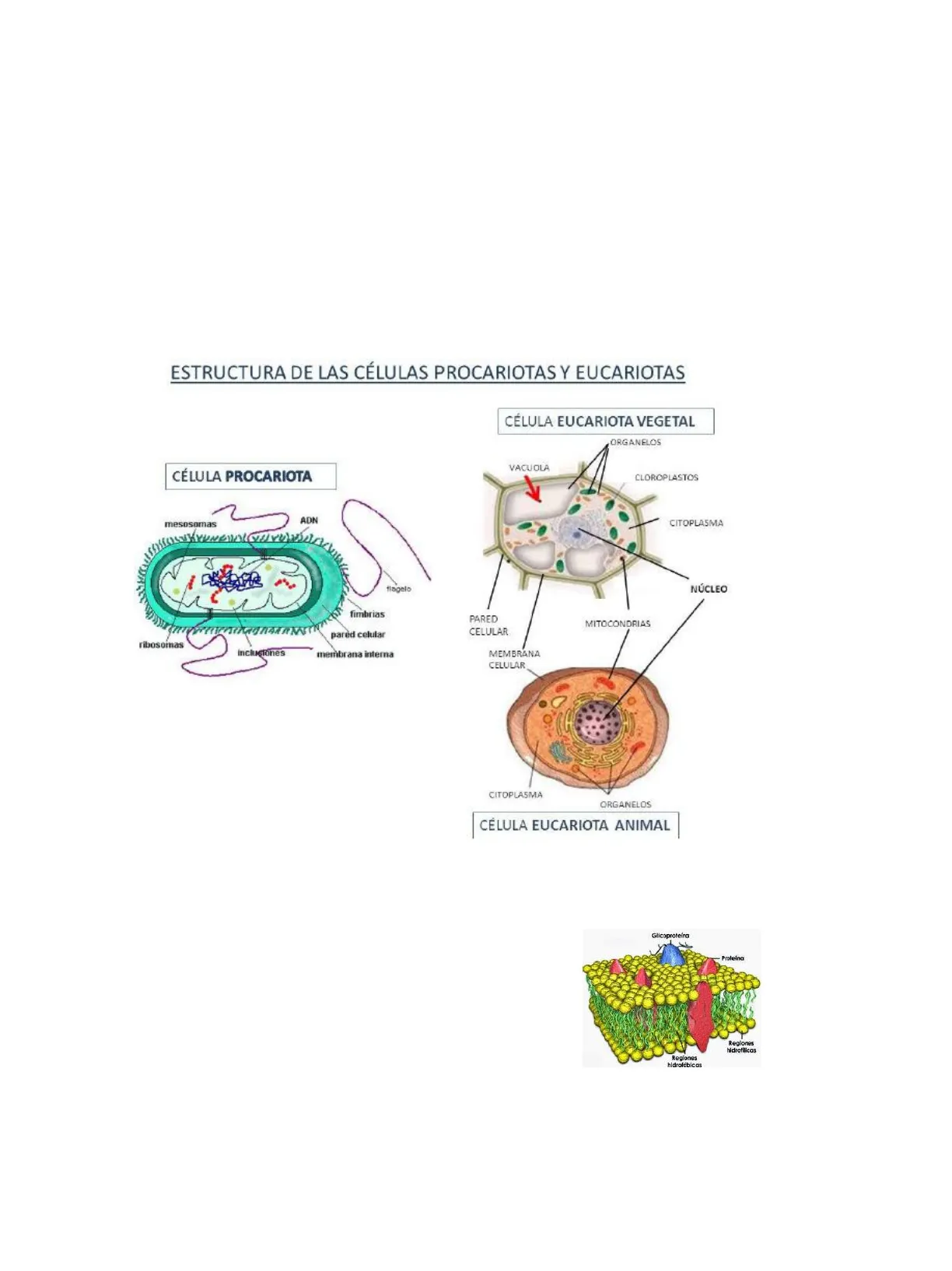
Estructura de las Células Procariotas y Eucariotas
CÉLULA EUCARIOTA VEGETAL ORGANELOS VACUOLA CLOROPLASTOS 2 ADN mesosomas CITOPLASMA NÚCLEO flagelo fimbrias PARED CELULAR MITOCONDRIAS pared celular ribosomas Incluciones membrana interna MEMBRANA CELULAR CITOPLASMA ORGANELOS CÉLULA EUCARIOTA ANIMAL
En cualquier caso, los ácidos nucleicos están bien aislados mediante membranas y paredes celulares.
- Las membranas son estructuras que limitan las células y permiten el intercambio de sustancias con el medio. Químicamente están compuestas por una bicapa lipídica y una gran variedad de proteínas en su seno. Glicoproteína Proteina Regiones hidrofilicas Regiones hidrofóbicas
- La pared celular es una peculiaridad común a bacterias, levaduras, hongos y células vegetales. Es una capa que recubre la membrana celular, proporcionando rigidez y protección. Químicamente su composición es variable según el organismo de que se trate. CÉLULA PROCARIOTA
Las membranas y paredes constituyen barreras que hay que vencer si se quiere acceder a los ácidos nucleicos. Por eso, el análisis y la manipulación de los ácidos nucleicos en biología molecular comporta, en la mayor parte de los casos, una primera etapa de extracción y purificación.
Con la extracción hacemos accesibles los ácidos nucleicos a los reactivos y enzimas que se emplean en las diversas técnicas, con la purificación eliminamos sustancias y elementos que pueden interferir en las técnicas.
La obtención de ácidos nucleicos purificados a partir de una muestra biológica se suele llevar a cabo mediante un único protocolo técnico continuado, que se divide en tres fases:
- I. Pretratamiento de la muestra.
- II. Extracción de los ácidos nucleicos.
- III. Purificación de los ácidos nucleicos.
Pretratamiento de las Muestras Biológicas
PRETRATAMIENTO DE LAS MUESTRAS BIOLÓGICAS
Los ácidos nucleicos se pueden obtener prácticamente de cualquier muestra biológica. Pero dada la gran diversidad y variabilidad del posible material de partida, muchas veces se requiere un pretratamiento específico, que permita obtener material sobre el que realizar la extracción y purificación.
Veremos los pretratamientos más habituales de las muestras con las que se trabaja en biología molecular:
- Sangre.
- Cultivos celulares.
- Tejidos animales o vegetales frescos.
- Tejidos fijados en formol e incluidos en parafina.
- Otras muestras, como esputos, células de la mucosa oral, bacterias y levaduras.
Pretratamiento de Sangre
SANGRE
Se usa habitualmente para estudiar los ácidos nucleicos de un individuo, purificándolos a partir de uno de sus componentes celulares: los leucocitos. Muchos de los componentes sanguíneos interfieren en las técnicas de biología molecular. Por ejemplo, el grupo hemo de la hemoglobina es un potente inhibidor de la PCR, por lo que un objetivo común en los pretratamientos es la eliminación de la hemoglobina por medio de la lisis de los hematíes.
CH3 CH2 H3C- H.C. CH OH OH
Para la obtención de una muestra de ADN a partir de una muestra de sangre lo ideal es partir de sangre total anticoagulada con EDTA, aunque la heparina y el citrato sódico también se pueden usar como anticoagulantes.
Ten en cuenta que la sangre es un tejido formado por:
- Hematíes: Que no tienen núcleo ni mitocondrias, en cuyo interior está la hemoglobina (proteína que contiene hierro). Su principal función es el transporte de los gases implicados en la respiración (O2 y CO2).
- Leucocitos: Células nucleadas que intervienen en procesos de defensa del organismo. Hay diferentes tipos que, según su morfología y función se dividen en: neutrófilos, eosinófilos, basófilos, linfocitos y monocitos.
- Plaquetas: Fragmentos celulares sin núcleo que intervienen en la coagulación sanguínea.
- Plasma: Componente líquido que es una mezcla compleja de múltiples elementos. glóbulos rojos vaso sanguíneo glóbulo blanco plasma plaquetas
La extracción de ácidos nucleicos en una muestra de sangre es conveniente hacerla en las 24 horas siguientes a la obtención de la muestra pero, si no es así, se puede guardar a 4ºC durante 5 días.
Si se van a aplicar técnicas que requieran que el ADN esté intacto la sangre no debería guardarse en nevera más de tres días, porque posteriormente se produce una leve degradación y fragmentación del ADN.
El pretratamiento más habitual en muestras de sangre consiste en:
- La lisis de los hematíes. Consiste en romperlos con una solución tampón de lisis en proporción
1:3 (un volumen de sangre por tres volúmenes de tampón). Hoy en día se trabaja con soluciones
de lisis comerciales, la mayoría basadas en fenómenos osmóticos y/o detergentes suaves:
- Solución de lisis de eritrocitos estándar (ósmosis): cloruro de amonio (NH4CI) 150 mM; Bicarbonato potásico (KHCO3) 10mM; EDTA 1mM.
- Solución de lisis de eritrocitos con detergente: Tris-HCI 10mM pH 8; Triton X-100 1%; Sacarosa 11%.
- Centrifugado de la muestra. Una vez rotos los hematíes se centrifuga la muestra y se obtiene un pellet y un sobrenadante.
- Eliminación del sobrenadante. Consiste en eliminar la fracción líquida del sobrenadante con una pipeta pasteur, para eliminar los componentes del plasma y la hemoglobina, liberada por la rotura de los hematíes.
- Conservación del sedimento. En el sedimento habrán quedado los leucocitos.
Este pretratamiento se puede usar también en muestras de médula ósea.
La sangre se puede usar también como punto de partida para estudiar ácidos nucleicos de algunos retrovirus que infectan linfocitos (como el VIH) o virus linfotrópicos humanos de células T (HTLV).
En este caso interesa aislar las células mononucleadas de sangre periferica o PBMC (Peripheral blood mononuclear cells), o sea: linfocitos y monocitos, antes de extraer los ácidos nucleicos. Esto se hace centrifugando en gradiente de densidad que requiere un medio de separación que es una mezcla de dos componentes:
- Ficoll: polisacárido sintético hidrofílico muy ramificado producido por la copolimerización de sucrosa y epiclorhidrina.
- Diatrizoato sódico.
Este medio tiene una viscosidad baja y una densidad de 1,077 g/ml y una osmolaridad adecuada para mantener la viabilidad celular. En el mercado hay varias marcas comerciales basadas en esta mezcla (Ficoll-paque®, Histopaque®, Lymphoprep® ... ).
Se procede como sigue:
- Se coloca en un tubo el medio de separación y encima la sangre.
- Se centrifuga 20-30 min a 400-800g, dependiendo del reactivo usado. Durante la
centrifugación:
- La polisucrosa causa agregación de los hematíes facilitando se rápida sedimentación.
- Los granulocitos, con una densidad mayor que en medio de separación, sedimentan también en el fondo del tubo.
- Las células mononucleadas, con una densidad menor que el medio de separación, permanecen en la interfase entre este y el plasma.
- Una vez eliminado el plasma sobrenadante, la capa de células mononucleadas se aspira cuidadosamente con una pipeta pasteur, se transfiere a un tubo limpio y se lava con tampón o solución salina para eliminar restos de plasma y plaquetas.
- A partir de las células lavadas se puede continuar con el proceso de extracción de ácidos nucleicos.
Layers before Ficoll spin Layers after Ficoll spin Blood Plasma PBMCs (interphase) Ficoll Ficoll Granulocytes RBCs
Pretratamiento de Cultivos Celulares
CULTIVOS CELULARES
Los cultivos celulares son métodos de obtención de células in vitro mediante siembras controladas en medios adecuados.
Son un buen material para realizar estudios genómicos y de expresión génica en determinadas condiciones y bajo ciertos estímulos.
El pretratamiento de estas muestras consiste en la recolección de las células antes de seguir con la extracción de los ácidos nucleicos.
Se dan principalmente dos situaciones:
- Cultivos en suspensión. Si las células crecen en suspensión en el medio de cultivo lo que se hace es: Recolectar en un tubo, eliminar el medio de cultivo mediante centrifugación y lavar las células con tampón o suero fisiológico antes de iniciar la extracción y purificación de ADN y/o ARN.
- Cultivos en monocapa. Si las células crecen en monocapa adheridas a la pared del frasco de
cultivo hay dos posibilidades:
- Utilizar el propio frasco para continuar el proceso de extracción. Para ello se retira del frasco el medio de cultivo, se lava la monocapa con tampón o solución salina y se inicia in situ, en el propio frasco, el proceso de extracción.
- Pasar la monocapa a un tubo. Para ello se despega la monocapa de células de la pared del frasco, bien de forma mecánica (con raspador) o por medios enzimáticos (tras retirar el medio de cultivo del frasco y lavar la monocapa de células con tampón o solución salina, se incuban las células con una solución de tripsina al 0,05-0,25%). Luego se recolectan las células en un tubo y finalmente se lavan las células antes de continuar con la extracción.
Pretratamiento de Tejidos Animales o Vegetales Frescos
TEJIDOS ANIMALES O VEGETALES FRESCOS
Esto requiere un pretratamiento de homogeneización, en el que por métodos mecánicos o químicos se liberan las células que integran el tejido.
La cantidad de tejido a procesar depende del tipo de tejido que sea, del método de homogeneización empleado y del procedimiento de extracción y purificación de ácidos nucleicos.
Por ejemplo, para tejidos animales cantidades entre 10 y 25 mg suelen bastar para obtener entre 10 y 40 µg de ADN. En el caso de tejidos vegetales se requieren normalmente cantidades un poco mayores de entre 100 mg y 1 g para el mismo rendimiento.
La homogeneización mecánica consiste en someter el tejido a una acción trituradora o abrasiva para desmenuzarlo. Puede ser automatizada usando máquinas o elementos mecánicos.
Primero el tejido se corta en trozos pequeños y luego se homogeneiza por acción mecánica, por adición de agentes abrasivos y agitación, por esferas de vidrio o cerámica que colisionan violentamente contra la muestra mediante movimiento de oscilación y sonicación. Una vez que el tejido está homogeneizado se transfiere a un tubo limpio y se inicia la extracción.
Hay que tener en cuenta que el proceso de rotura mecánica del tejido puede liberar proteasas y enzimas responsables de la degradación de los componentes celulares. Por ello conviene realizar estos procesos en frío y de forma rápida, o bien añadir inhibidores enzimáticos.
La homogeneización mecánica también puede ser manual con mortero, método que minimiza el problema de la degradación. En este procedimiento se colocan los fragmentos en un mortero y se cubren con nitrógeno líquido. Esto hace que el tejido se congele rápidamente y evita la formación de cristales en el interior de las células, que podrían provocar la lisis celular y la liberación de enzimas que degradarían los componentes de la célula. Posteriormente, con la mano del mortero se pulverizan los fragmentos hasta conseguir un polvo fino y, finalmente, se deja evaporar el nitrógeno líquido. Por último, el polvo fino se transfiere a un tubo para iniciar la extracción.
A veces, la homogeneización mecánica se hace directamente en un tampón de lisis, simultaneándola con del primer paso del proceso de extracción.
En cuanto a la homogeneización química, consiste en someter al tejido a la acción de proteasas y detergentes que degradan los componentes del tejido, disgregando las células. Se suele realizar para muestras pequeñas y cortes de tejidos en congelación obtenidos con un criostato.