Fondamenti e didattica della chimica: materia, atomi e reazioni
Documento di Università sulla chimica, la materia e le sue trasformazioni. Il Pdf esplora i fondamenti della chimica, i linguaggi chimici, le formule e la classificazione dei materiali, inclusi i metodi di separazione, con una sezione storica sull'evoluzione del modello atomico, da Rutherford a Bohr, per la materia Chimica.
Mostra di più31 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Fondamenti e didattica della chimica
chimica = scienza che assume come unità fondamentali della natura: gli atomi e le molecole, e utilizza la conoscenza del loro comportamento per spiegare le proprietà della materia che osserviamo (e misuriamo) su scala macroscopica Si tratta dunque di una scienza sperimentale. Una definizione più attuale potrebbe essere: è la scienza che studia:
- la composizione
- la struttura e le proprietà della materia
- le trasformazioni che in essa avvengono (spontaneamente o provocate dall'uomo)
- l'energia (ceduta o assorbita durante queste trasformazioni)
La chimica spiega i perché e i come della vita di tutti i giorni, partendo dagli atomi e dalle molecole usando un suo linguaggio specifico La chimica utilizza due tipi di linguaggio:
- macroscopico = fa riferimento agli oggetti che osserviamo
- simbolico = si basa sulla tavole periodica e sulle formule
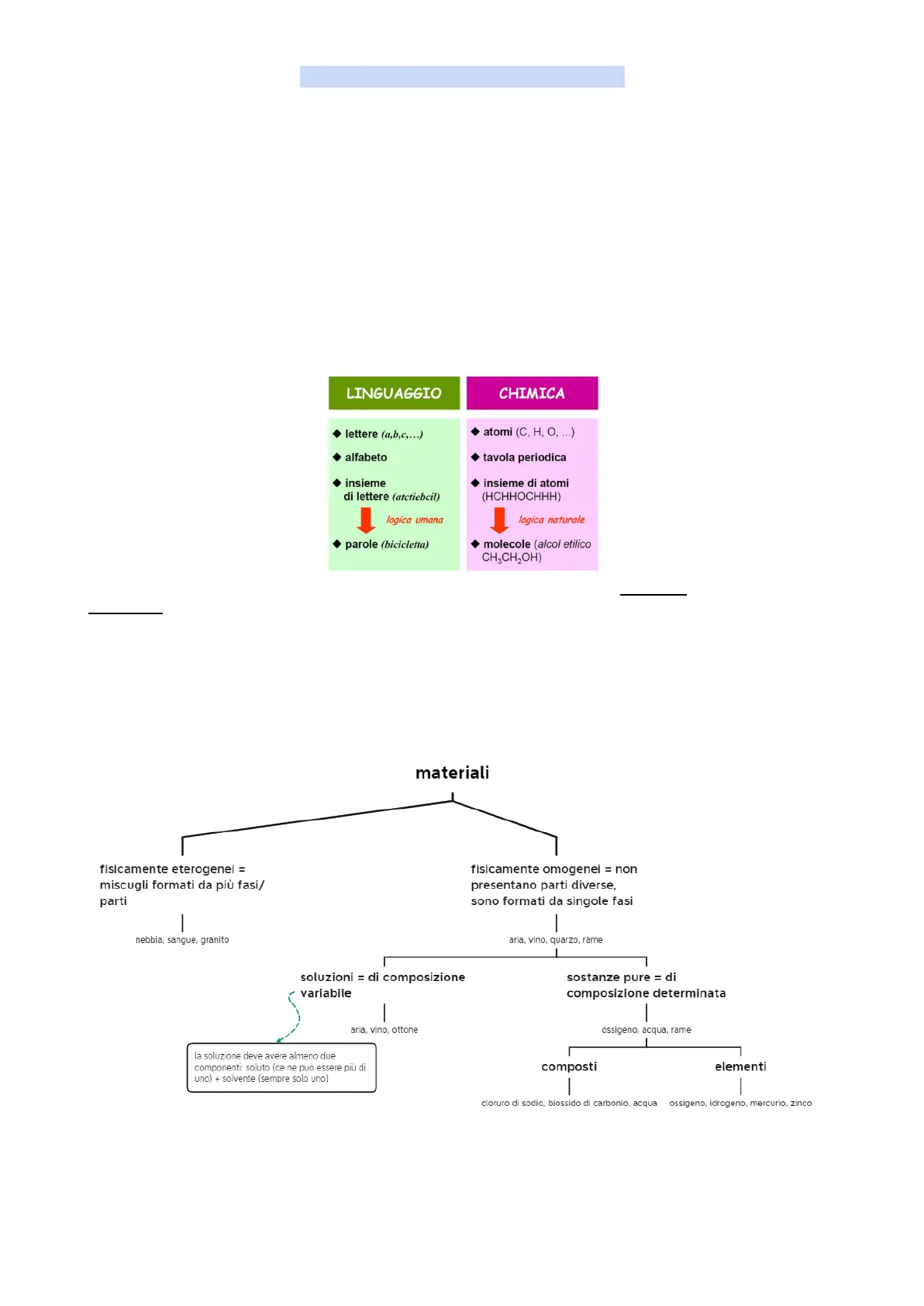
Linguaggio chimico
LINGUAGGIO CHIMICA · lettere (a,b,c, ... ) · atomi (C, H, O, ... ) · alfabeto · tavola periodica insieme di lettere (atctiebcil) · insieme di atomi (HCHHOCHHH) logica umana I logica naturale · parole (bicicletta) · molecole (alcol etilico CH3CH2OH)
Le formule chimiche sono scritture simboliche che contengono tutta l'informazione qualitativa (quali tipi di atomo) e quantitativa (quanti atomi) necessaria a descrivere la composizione atomica della sostanza -> CO2 è una molecola composta da: 1 atomo di carbonio C 2 atomi di ossigeno O
Materia e materiali
La materia e i materiali sono tutte quelle cose con cui possiamo interagire, in funzione del loro stato di aggregazione, e che hanno una massa e occupano un volume
Classificazione macroscopica dei materiali
Classificazione macroscopica dei diversi tipi di materiali: materiali fisicamente eterogenei = miscugli formati da più fasi/ parti fisicamente omogenei = non presentano parti diverse, sono formati da singole fasi I - nebbia, sangue, granito aria, vino, quarzo, rame soluzioni = di composizione variabile sostanze pure = di composizione determinata I aria, vino, ottone 1 ossigeno, acqua, rame la soluzione deve avere almeno due componenti: soluto (ce ne può essere più di uno) + solvente (sempre solo uno) composti elementi - - cloruro di sodio, biossido di carbonio, acqua ossigeno, idrogeno, mercurio, zinco | - - |
Metodiche di separazione
Perturbazioni meccaniche o magnetiche
- decantazione = fenomeno per il quale una sostanza, solida o liquida, dispersa in un liquido di diversa densità, si accumula, sotto azione della gravità, in alto o in basso, lasciando uno strato di liquido assai povero o del tutto prima della fase stessa
- filtrazione = metodo di separazione che viene usato per separare un solido dal liquido in cui è disperso. Consiste nel versare il miscuglio eterogeneo delle due sostanze su un filtro di materiale poroso (in genere carta) sovrapposto a un imbuto. Il liquido passa attraverso il filtro ed è raccolto in un becher, mentre il solido è trattenuto dal filtro stesso, da cui può essere recuperato.
- separazione con calamita = l'azione di un magnete o elettromagnete attrae parti ferromagnetiche deviandone la traiettoria in maniera più o meno marcata, comunque sufficiente a separare in maniera netta il materiale ferromagnetico da tutto il materiale non ferromagnetico
- centrifugazione = metodo di separazione che consente di separare due sostanze di un miscuglio eterogeneo solido-liquido o liquido-liquido per mezzo della centrifuga. La decantazione, quando la densità tra due sostanze è piccola, risulta lente, e per questo si opera tramite centrifugazione
Perturbazioni dello stato di aggregazione
- cristallizzazione -> basa il proprio funzionamento proprio sul fatto che una sostanza cristallina sia stata disciolta nell'acqua, di solito, e si vuole separare il composto. Si può far evaporare naturalmente con la temperatura e pressione atmosferica. Qual è l'effetto? Restituire il soluto solido allontanando il solvente.
- distillazione -> Processo usatissimo nell'industria chimica che permette di separare sostanze con punto di evaporazione diverso: es. vino possiamo separare alcol etilico e acqua.
- fusione
- cromatografia -> tecnica di separazione basata sulla diversa velocità di migrazione con cui più sostanze depositate su un supporto adatto (carta da filtro .. ), vengono trasportate da un fluido detto eluente e si stratificano in posizioni differenti del supporto. Scrivere con i colori: inchiostri presenti all'interno di un pennarello per dimostrare che per esempio scrivo tutto nero ma dentro ci sono altri colori.
Trasformazioni chimiche (reazioni)
- decomposizione = processo o effetto della semplificazione di una singola entità chimica in due o più frammenti.
- elettrolisi = processo che consiste nello svolgimento di trasformazioni chimiche grazie all'apporto di energia elettrica che si converte in energia chimica.
- analisi
Sostanze pure e miscugli
La materia è costituita da sostanze pure e miscugli | Una sostanza pura può essere:
- una sostanza elementare (per esempio un chiodo di ferro) se è costituita di unità formate solo da atomi della stessa specie (es. Hg, S, O2 -> sostanze che si trovano nella tavola periodica)
- un composto se le unità di base sono formate da atomi di due o più specie diverse in un rapporto ben definite (es. NaCl, CO2, H2O)
Milioni di sostanze pure sono nate -> pochissime di queste (un centinaio) sono sostanze elementari o elementi, tutti gli altri sono composti (a composizione costante). Ognuno di essi ha una precisa identità chimica e un nome. Un miscuglio o miscela è una porzione di materia comprendente più sostanze, e si dividono in:
- miscugli omogenei (soluzioni) = presentano proprietà uniformi in ogni regione (aria, acqua marina, ottone); la composizione è variabile. Manifestano proprietà diverse mediante perturbazioni dello stato di aggregazione come la cristallizzazione, o perturbazioni fisiche come cromatografia, estrazione con solvente ecc
- miscugli eterogenei = presentano parti distinte fisicamente distinguibili (roccia, sospensione di acqua e sabbia, ferro e zolfo). Si separano in parti mediante perturbazioni meccaniche come separazione magnetica, decantazione, centrifugazione, filtrazione etc
[fase = parte di un sistema, con proprietà fisiche uniformi, separata da altre parti del sistema da superfici limite fisicamente definite] 2Dunque combinando il punto di vista macroscopico a quello particellare, le sostanze sono caratterizzate da:
- composizione = per le sostanze elementari è data dal tipo di atomo; per i composti dai tipi di atomi e dal loro rapporto numerico
- struttura = modo in cui gli atomi sono legati tra loro nella molecola ↓ determinano: proprietà caratteristiche = ad esempio densità, conducibilità termica o elettrica, temperatura di fusione o ebollizione ... | | possono essere:
- proprietà intensive (come composizione e struttura, densità, conducibilità, punto di fusione e di ebollizione, calore specifico) = dipendono dalla natura delle sostanze, ma non dalla loro quantità Dalle proprietà intensive è possibile individuare la sostanza, dato che esse sono caratteristiche della sostanza in questione.
- proprietà estensive = dipendono invece dalla quantità di una sostanza (come massa e volume) e da esse non si può individuare una sostanza
Gli stati di aggregazione
- stato solido ->le sostanze possiedono forma e volume proprio (volume e forma rientrano nell'aspetto macroscopico, invece quando si parla di particelle si guarda livello microscopico); il solido tende ad avere una certa rigidità. A una data temperatura le particelle sono legate da forze sufficienti perché il moto termico (sempre presente, salvo che allo zero assoluto), non modifichi le mutue posizioni permanentemente Tutte le sostanze solide sono ugualmente rigide? No, quali? polveri -> sono solidi finemente suddivisi. I granelli di sabbia erano in realtà pezzi di roccia, che nel corso dei secoli, a causa degli effetti atmosferici sono stati disgregati dalla roccia di partenza.
- stato liquido -> i legami interparticellari sono allentati, permettendo così una certa mobilità delle particelle, ma non l'allontanamento definitivo; il volume resta perciò praticamente definito, mentre non lo è più la forma, che si adatta al recipiente in cui è inserito
- stato aeriforme -> non ha né forma né volume proprio. - > le particelle, avendo un'energia termica molto superiore all'energia di interazione, tendono ad allontanarsi l'una dall'altra e praticamente non si influenzano tra loro; si ha perciò la massima espansione nello spazio disponibile.
Passaggi di stato
Le sostanze possono cambiare di stato di aggregazione senza subire modificazioni nella loro natura chimica - si parla di passaggi di stato t 0 O 00 t ebollizione vapo t fusione Qimente di fusione solido solido+liquido liquido liquido+aerif. aeri tempo (s) a- Le temperature a cui avvengono i passaggi di stato (temperatura di fusione e di ebollizione) delle sostanze variano al variare della pressione -> abbassando la pressione, si abbassa la temperatura di ebollizione e, in misura minore, la temperatura di fusione. Il contrario avviene aumentando la pressione
| fenomeno | passaggio |
|---|---|
| fusione | solido -> liquido |
| solidificazione | liquido -> solido |
| evaporazione (se è spontanea) / vaporizzazione o ebollizione (se è indotta) | liquido -> aeriforme |
| Sublimazione | |
| Fusione | |
| Evaporazione/ /Ebollizione | |
| SOLIDO | LIQUIDO |
| AERIFORME | |
| A | A |
| Solidificazione | |
| Condensazione | |
| Brinamentocondensazione | liquefazione |
| vapore -> liquido | gas -> liquido |
| sublimazione | solido -> aeriforme (vapore) |
| brinamento / deposizione | vapore -> solido |
reazione chimica = trasformazione di una o più sostanze in altre sostanze, ovvero un processo nel corso del quale le particelle delle sostanze reagenti rompo i legami per aggregarsi con i nuovi legami nei prodotti della reazione
Le soluzioni
Le soluzioni (o miscuglio omogeneo) = sono miscele fisicamente omogenee di due o più sostanze, le cui quantità relative possono variare con continuità entro certi limiti. La definizione principale è quella di miscuglio omogeneo perché mette in evidenza il fatto che non è solo qualcosa allo stato liquido quello che noi chiamiamo comunemente soluzione; esistono diverse soluzioni, anche allo stato aeriforme e allo stato solido. Quali sono gli attori della soluzione?
- solvente (sempre e solo uno) = mezzo disperdente -> componente presente in quantità maggiore. Si può vedere come l'attore attivo che fa sì che la soluzione si sciolga
- soluto (può esserci anche più di un soluto) = componente disperso nel solvente
Esempi di soluzioni
| Esempi di soluzioni | SOLUTO | ||
|---|---|---|---|
| gas | liquido | solido | |
| SOLVENTE | |||
| gas | Ossigeno o altri gas in azoto (a- ria). | Vapore acqueo nei gas che com- pongono l'aria. | Il naftalene nei gas che compon- gono l'aria. |
| liquido | Anidride carbonica o ossigeno in acqua. | Etanolo in acqua. Soluzioni di idrocarburi (greggio). | Saccarosio in acqua. Cloruro di sodio in acqua. Oro in amalgama con mercurio. |
| solido | Idrogeno in dissoluzione nei me- talli (ad esempio platino). | Esano in paraffina. Mercurio in oro. | Acciaio, duralluminio, e altre le- ghe metalliche. |
Le soluzioni da dove prendono il loro modo di comportarsi, da cosa è influenzato? Il comportamento di una soluzione in generale dipende da:
- dalla natura delle particelle del soluto presenti nel solvente
- dalle caratteristiche del mezzo disperdente
- dalle interazioni tra solvente e soluto
Le soluzioni, essendo miscele di più sostanze, non hanno composizione definita (a meno che noi non la prepariamo esattamente come la vogliamo) e le proprietà chimiche e fisiche di una soluzione (reattività, colore, conducibilità elettrica ecc .. ) dipendono, oltre che dal tipo, dalla quantità dei soluti e del solvente. è quindi necessario specificare sempre la composizione di una soluzione, precisando le quantità relative dei componenti (concentrazione)
Concentrazione di una soluzione
SOLVENTE PURO SOLUZIONE molecole di soluto O molecole di solvente La concentrazione di una soluzione = rapporto tra quantità di soluto e la quantità di solvente (rapporto quantitativo) -> quantità di soluto presente in una data quantità di solvente. Le concentrazioni dei soluti in una soluzione definiscono la composizione della soluzione stessa. La concentrazione del componente i-esimo di una soluzione è definita come: | QUANTITA' DEL COMPONENTE I-ESIMO = QUANTITA' DEL COMPONENTE I-ESIMO QUANTITA' DELLA SOLUZIONE QUANTITA' DEL SOLVENTE 4 |