Equilibrio chimico dinamico: reazioni reversibili e fattori di influenza
Slide sull'equilibrio chimico dinamico. Il Pdf, utile per la scuola superiore, tratta le reazioni reversibili, il quoziente di reazione e i fattori che influenzano lo spostamento dell'equilibrio in chimica.
Mostra di più40 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Equilibrio chimico dinamico
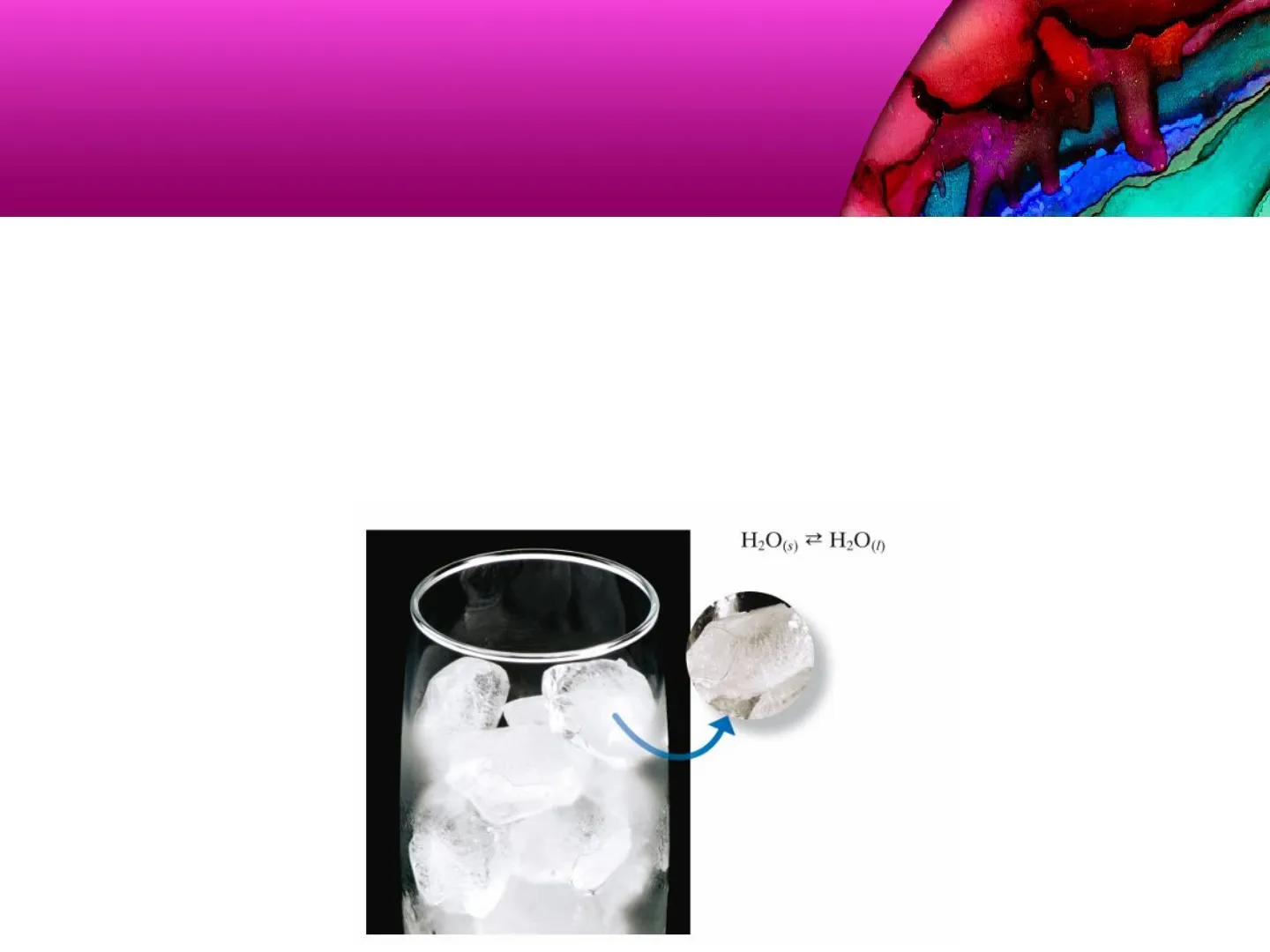
Equilibrio chimico dinamicoREAZIONI REVERSIBILI Quando le reazioni risultano incomplete e, soprattutto, sembrano non andare né avanti né indietro, si è in presenza di una trasformazione reversibile in equilibrio dinamico. H2O(s)=H2O(1)Nelle reazioni reversibili avvengono contemporaneamente la reazione diretta, da sinistra verso destra, e la reazione inversa, da destra verso sinistra. L'equilibrio chimico si raggiunge quando la velocità della reazione diretta (reagenti -> prodotti) è uguale alla velocità della reazione inversa (prodotti -> reagenti) Cioè i reagenti si trasformano nei prodotti alla stessa velocità con cui i prodotti si trasformano in reagenti.
Gliceridi o Acilgliceroli
GLICERIDI o ACILGLICEROLI Una volta raggiunto l'equilibrio, le quantità dei reagenti e dei prodotti restano costanti nel tempo a meno che non cambino le condizioni del sistema (come temperatura, pressione, presenza di altre sostanze disciolte e loro concentrazione). L'equilibrio chimico è evidenziato nelle equazioni dalla doppia freccia. reagenti z prodotti
- Il raggiungimento dello stato di equilibrio può richiedere tempi più o meno lunghi, ma è inevitabile, se e solo se il sistema è chiuso.
- Poiché a livello microscopico le reazioni continuano ad avvenire si parla di equilibrio dinamico.
Come si raggiunge l'equilibrio dinamico
Come si raggiunge l'equilibrio dinamico? In una generica reazione tra A e B che si trasformano in C e D con a, b, c, d coefficienti stechiometrici, la reazione diretta è: aA + bB -> cC + dD All'inizio si ha concentrazione massima di A e di B. Pertanto la velocità di reazione sarà massima. Dall'istante in cui A e B iniziano a reagire, le rispettive concentrazioni diminuiscono nel tempo e altrettanto accade alla velocità di reazione diretta.C e D, invece, sono assenti finché non inizia il processo diretto. Appena cominciano a formarsi C e D, inizia anche la reazione inversa, che procede con velocità crescente man mano che C e D si accumulano. Dopo un certo tempo, le velocità della reazione diretta e inversa diventano uguali. Le concentrazioni di reagenti e prodotti restano costanti a meno che non varino le condizioni di reazione.Il sistema è in equilibrio chimico dinamico: A+B-C+D reazione diretta velocità di reazione A + B = C + D aA + bB = cC + dD equilibrio C +D-A+B reazione inversa tempo
Legge generale dell'equilibrio chimico
In una generica reazione all'equilibrio: aA + bB cC+ dD La velocità (v) di una reazione dipende dalla costante di velocità (k) e dalle concentrazioni molari dei reagenti e dei prodotti indicate tra [ ]. Quindi: V diretta = Kdiretta [A]a . [B]b V inversa = k inversa [C] . [D]d Per le reazioni che avvengono in un solo stadio a, b, c, d sono i coefficienti stechiometrici.All'equilibrio, quando le velocità della reazioni diretta e inversa sono uguali: Vd = Vi ka [A]a · [B]b = k; [C]] . [D]d kg/k = ([C] . [D]d) / ([A]a . [B]b) Il rapporto kd/ki è costante, quindi si può scrivere la legge generale dell'equilibrio chimico o legge di azione di massa: Keg = ([C]] . [D]d) / ([A]a · [B]b)
- Keq è la costante di equilibrio e il suo valore per una data reazione dipende solo dalla temperatura.
- Quindi all'equilibrio il rapporto fra le concentrazioni dei prodotti e le concentrazioni dei reagenti, elevate ai rispettivi coefficienti stechiometrici è costante a temperatura costante.
- La costante di equilibrio K eq viene anche indicata dal simbolo K quando le sostanze non sono volatili, si è in soluzione acquosa e le concentrazioni sono espresse in molarità.
Reazioni omogenee in fase gassosa
Nelle reazioni omogenee in fase gassosa, la costante di equilibrio viene espressa in funzione delle pressioni parziali e si indica con K p. aA (g) (g) + bB (g) CC + dD (g) Pc · Pd C D K = p pª · Pb A BQuando gli equilibri che presentano diverse fasi sono chiamati equilibri eterogenei. Negli equilibri eterogenei l'espressione della costante di equilibrio non tiene conto delle concentrazioni dei solidi (s) e dei liquidi puri (l) presenti, in quanto le loro concentrazioni sono costanti. Nella reazione di decomposizione del carbonato di calcio: 2NaHCO3(s) ≥ Na2CO3(s) + H2O(g) + CO2(g) CaCO 11 CO 3(s) 2(g) + CaO (s) Keq = [H2O] . [CO2] K = [CO2]
Valore della costante di equilibrio
All'equilibrio si può avere: · Keq >> 1 [C] . [D]d >> [A]a . [B]b Keq è molto alta, quindi è favorita la formazione dei prodotti: all'equilibrio prevale la quantità dei prodotti su quella dei reagenti. Si dice che l'equilibrio è spostato verso destra. · Keq << 1 · · Keq è molto bassa, quindi è favorita la formazione dei reagenti: all'equilibrio prevale la quantità dei reagenti su quella dei prodotti. Si dice che l'equilibrio è spostato verso sinistraSe K > 1 l'equilibrio è spostato verso i prodotti. eq Se K = 1 si hanno prodotti e reagenti in uguale quantità. eq Se K < 1 l'equilibrio è spostato verso i reagenti. eq
Esempio di equilibrio chimico
Esempio [C] . [D]d [A]a . [B]5 = Keq Situazione all'equilibrio: reagenti (in blu) e prodotti (in rosso) Posizione dell'equilibrio H2(g) + Cl2(g) ≥ 2HCI(g) Keg = 4 . 1031 Keq molto grande: la concentrazione del prodotto HCI (al numeratore) è molto grande e quella dei reagenti H2 e Cl2 (al denominatore) è molto piccola. Equilibrio molto spostato a destra. Reazione pressoché completa. SO2(g) + NO2(g) => SO3(g) + NO(g) Keq =3 Keq = 1: la concentrazione dei prodotti, SO3 e NO (al numeratore) è molto simile a quella dei reagenti SO2 e NO2 (al denominatore). Reazione con una resa in prodotti del 50% circa. Cl2(g) ₹≥ 2Cl(g) Keq = 1,2 . 10-7 Keq molto piccola: la concentrazione del prodotto CI (al numeratore) è molto piccola e quella del reagente Cl2 (al denominatore) è molto grande. Equilibrio molto spostato a sinistra. La reazione praticamente non avviene.
Quoziente di reazione
QUOZIENTE DI REAZIONE · Quando una reazione non ha ancora raggiunto l'equilibrio, possiamo capirne l'andamento confrontando il quoziente di reazione Qc e la Kc. · Qc è il rapporto fra il prodotto delle concentrazioni molari dei prodotti e il prodotto delle concentrazioni molari dei reagenti, ciascuna elevata al proprio coefficiente stechiometrico, quando la reazione non si trova in condizioni di equilibrio. Q = [C]c . D]ª [A]a . [B]bSe Q < K Il sistema non è all'equilibrio. Per ristabilirlo, parte dei reagenti si trasformerà in prodotti, spostando la reazione verso destra. Se Q > K il sistema non è all'equilibrio. Per riequilibrare il sistema, una parte dei prodotti si convertirà in reagenti, spostando la reazione verso sinistra. Se Q = K il sistema è all'equilibrio.
Tabella del quoziente di reazione
QUOZIENTE DI REAZIONE Prova Concentrazioni iniziali (mol/L) Qc = [H2]/ . [12]/ [HI]2 Confronto Qc e Kc (Kc = 54) Prevale la reazione ... [HI]; [H2]¡ 3 0,50 0,50 0,50 1 Qc < Kc diretta 4 1,0 0,50 0,50 0,25 Qc < Kc diretta 5 0,10 2,0 1,0 200 Qc > Kc inversa
Spostamento dell'equilibrio chimico
L'equilibrio chimico può essere spostato: · variando le concentrazioni dei reagenti o dei prodotti: · variando la pressione esercitata sul sistema, e il numero delle molecole allo stato gassoso dei reagenti è diverso da quello dei prodotti; · variando la temperatura, se la reazione è esotermica o endotermica.
Principio di Le Chatelier
PRINCIPIO DI LE CHATELIER Se in un sistema all'equilibrio si modificano temperatura, pressione o le quantità di reagenti e prodotti, interviene il principio di Le Chatelier (1884): un sistema all'equilibrio, perturbato da un'azione esterna, reagisce in modo da ridurne o annullarne l'effetto, ristabilendo l'equilibrio.
Effetto della variazione di concentrazione
EFFETTO DELLA VARIAZIONE DI CONCENTRAZIONE DEI REAGENTI E DEI PRODOTTI Aggiungendo un reagente a un sistema all'equilibrio, l'equilibrio si sposta nella direzione che consente la scomparsa di una parte del reagente aggiunto e la formazione del prodotto. Viceversa, se si aggiungiamo un prodotto al sistema all'equilibrio, si provoca una reazione opposta. A+B C+D - 1 - T L'aggiunta di un reagente sposta a destra l'equilibrio della reazione La sottrazione di un reagente sposta a sinistra l'equilibrio della reazione L'aggiunta di un prodotto sposta a sinistra l'equilibrio della reazione La sottrazione di un prodotto sposta a destra l'equilibrio della reazione
Aggiunta di reagenti
Aggiunta di reagenti Aggiungendo un reagente, il sistema reagisce minimizzando gli effetti della perturbazione. L'equilibrio si sposta a destra aumentando la quantità dei prodotti e consumando i reagenti. Quando, con i nuovi valori di concentrazione, il rapporto espresso dalla legge d'azione di massa sarà tornato ad avere un valore pari a Keq, sarà ripristinato un nuovo equilibrio.perturbazione Aumentando la concentrazione di un reagente, il sistema perde lo stato di equilibrio iniziale. R R R R R R R equilibrio 1 non equilibrio P P P P P le velocità non sono uguali Il sistema raggiunge un nuovo stato di equilibrio se consuma parte del reagen- te aggiunto trasformandolo in prodotto. R R R equilibrio 2 P P R le velocità diretta e inversa sono uguali le velocità sono di nuovo uguali
Aggiunta di prodotti
Aggiunta di prodotti Se aumenta la concentrazione di un prodotto, come D, l'equilibrio risponde alla perturbazione spostandosi verso sinistra: si consumano i prodotti, mentre i reagenti aumentano. Diminuzione di uno dei reagenti Quando uno dei reagenti viene allontanato sarà favorita la reazione inversa che ripristina A e B e fa diminuire C e D. L'equilibrio si sposta verso sinistra.Diminuzione di uno dei prodotti Quando uno dei prodotti viene allontanato, l'equilibrio si sposta verso destra per ripristinare i prodotti e diminuire le concentrazioni dei reagenti.
Effetto della variazione della pressione o del volume
EFFETTO DELLA VARIAZIONE DELLA PRESSIONE O DEL VOLUME L'aumento di pressione (= diminuzione di volume) di un sistema gassoso all'equilibrio comporta lo spostamento dell'equilibrio nella direzione in cui è presente il numero minore di molecole; viceversa, se aumentiamo il volume a disposizione (diminuzione della pressione), favoriamo lo spostamento dell'equilibrio nella direzione in cui è presente il numero maggiore di molecole.[N2O4] = 8 M [NO2] = 8 M equilibrio: Keq = 6 = 8 P L'aumento di pressione modi- fica l'equilibrio. Aumentando la quantità dei re- agenti, si rista- bilisce il valore di Keq. [N2O4] = 9 M [NO2] = 6 M equilibrio turbato: (2 8)2 2.8 = 16 ± Keq P Kea = = 8 nuovo equilibrio: (2 6)2 2.9
Effetto della variazione di temperatura
EFFETTO DELLA VARIAZIONE DI TEMPERATURA · La variazione di temperatura influenza lo stato di equilibrio in modo diverso a seconda che la reazione sia esotermica o endotermica. · Se si riscalda un sistema all'equilibrio, si favorisce la reazione endotermica; se invece si raffredda, si favorisce la reazione esotermica.