Massa atomica relativa, principio di Avogadro e mole in chimica
Slide sulla massa atomica relativa, il principio di Avogadro e la mole. La Pdf è una presentazione di Chimica per la scuola superiore che introduce i concetti di massa atomica relativa, principio di Avogadro e mole, con formule e calcoli correlati.
Mostra di più17 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Massa Atomica Relativa
massa atomica relativa La massa di un atomo si può determinare soltanto mettendola a confronto con quella di un atomo di riferimento, cioè in modo relativo a
Elementi e Masse Atomiche Storiche
ELEMENTS Hydrogen. Strontian a A:ote 5 Barytes 68 alami Oxygen 7 Z Zinc 56 0 Phosphorus 0 C Copper 56 00 Magnesia 20 S Silver 190 Lime 24 Gold 1.90 amy ala Soda 28 P Platina 190 Potash 42. Mercury 167 Carbon 1 Iron 50 alanı Sulphur 13 L Lead 90
John Dalton compilò una tabella delle masse atomiche degli atomi usando come riferimento la massa dell'atomo di idrogeno, alla quale aveva attribuito il valore 1 La massa atomica relativa di un elemento, quindi, è il valore del rapporto fra la massa dell'atomo di quell'elemento e la massa dell'atomo di idrogeno
Principio di Avogadro
volumi uguali di gas diversi, alla stessa temperatura e pressione, contengono un identico numero di molecole
Calcolo della Massa Molecolare
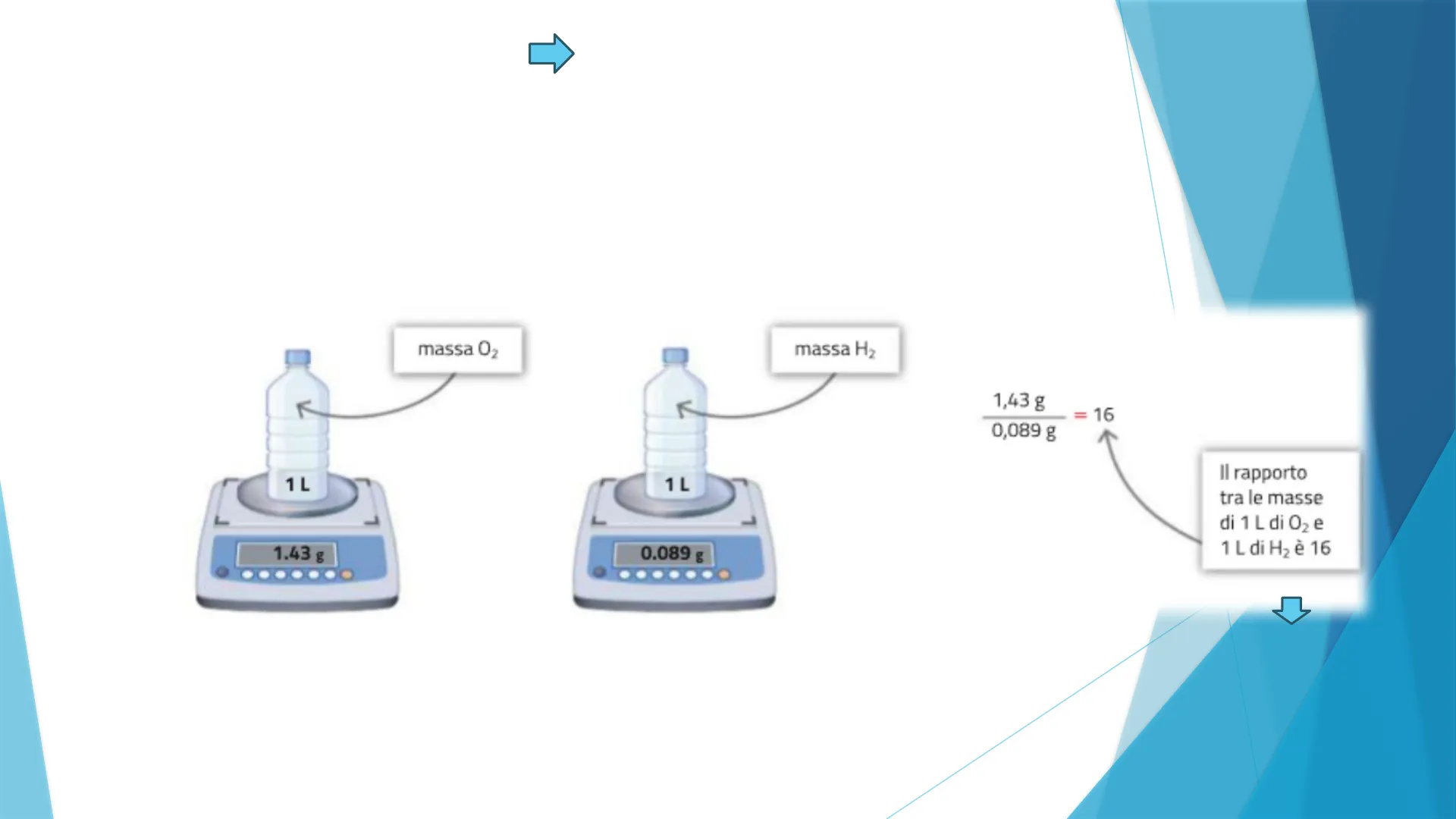
possiamo misurare la massa di una sostanza e dividere la massa per il numero di molecole ottenendo così il valore della massa di una singola molecola. Esempio: A 1 atm e a 0 ℃
massa O2 K 1 L 1 L L 1.43 g 0.089 g . massa H2 1,43 g 16 0,089 g Il rapporto tra le masse di 1 L di O2 e 1 L di H2 è 16
Il rapporto tra le densità di due sostanze aeriformi, alla stessa temperatura e pressione, è uguale al rapporto tra le masse delle loro singole molecole. Le molecole di O2 hanno una massa 16 volte maggiore delle molecole di H2.
Determinazione della Massa Atomica
Per determinare la massa atomica si ricorre alla sua misura relativa, cioè per confronto con quella di un atomo di riferimento. Storicamente sono stati utilizzati, come riferimento, prima l'atomo di idrogeno, poi quello di ossigeno.
Campione di Riferimento: Carbonio-12
Dal 1961 il campione di riferimento per la determinazione della massa atomica relativa è il carbonio-12 (12C), che è la forma più diffusa in natura dell'atomo di carbonio, a cui è stata assegnata una massa atomica uguale a 12. L'unità di massa atomica (dalton), che si indica con u e corrisponde alla dodicesima parte della massa di un atomo di carbonio-12, equivale a 1,661 · 10-24 g.
Isotopi del Carbonio
carbonio - 12 stabile 12℃ 6 protoni 6 neutroni carbonio - 13 stabile 1.1% 1.2 * 10 -12
14 C 6 protoni 8 neutroni Sarveyar e EXL Therene
Oggi, le masse relative dei singoli atomi possono essere determinate con una precisione elevata, mediante la spettrometria di massa
Tecnica sensibile utilizzata per rilevare, identificare e quantificare le molecole in base al loro rapporto massa/carica (m/z). Thenno Thermo
carbonio - 14 radioattivo 98.9% 13 C 6 protoni 7 neutroni
Massa Atomica Relativa (MA)
Massa atomica relativa La massa atomica relativa (MA) di qualsiasi elemento è definita come il rapporto fra la massa di un solo atomo di quell'elemento e l'unità di massa atomica.
massa atomica relativa = MA massa di 1 atomo u massa di 1 atomo in g 1,661 . 10-24 g = numero adimensionale
8 15.999 O Oxigen [He] 2s22pª Nonmetal La sua massa è 16 volte più grande della dodicesima parte della massa del 12C
Calcolo della Massa in Grammi di un Singolo Atomo
Come possiamo calcolare la massa in grammi di 1 singolo atomo ?? Per conoscere la massa reale di un solo atomo di un certo elemento, è sufficiente moltiplicare il numero puro (MA), presente nella tavola periodica, per il valore dell'unità di massa atomica u espresso in grammi (1,661 - 10-24 g). Esempio: L'atomo di ossigeno ha MA = 16,00 perché la sua massa è sedici volte più grande della dodicesima parte della massa di un atomo di carbonio-12. 16,00 X 1,661 . 10-24 g = 2,658 · 10-23 g
Isotopi e Massa Atomica Media
Gli isotopi sono le «varianti» di un atomo con identiche proprietà chimiche ma masse leggermente diverse tra loro. I valori di massa atomica relativa della tavola periodica si riferiscono, in realtà, alle masse atomiche medie, cioè tengono conto di quanti atomi dei vari isotopi di un certo elemento, in percentuale, costituiscono quell'elemento in natura (media ponderata).
Esempio: Cloro
cloro CI 35,45 37 C| 24,47% 75,53% 35Cl L'isotopo cloro-35 contribuisce circa tre volte di più alla massa atomica media rispetto al cloro-37. 35Cl 37 Cl 34,9689 × 75,53 + 36,9659 × 24,47 100 100 = 35,45...
Massa Molecolare Relativa (MM)
Quanto pesa una molecola ??? La massa molecolare relativa (MM) è la somma delle masse atomiche relative degli atomi che compaiono nella formula della molecola.
Calcolo della Massa Molecolare dell'Acido Carbonico
MMH.co; = 2 . MAidrogeno + MA carbonio + 3 - MAossigeno idrogeno H 1.008 carbonio C 12,01 ossigeno 16,00 MMH.co) = 2 × 1,008 + 1 × 12,01 + 3 × 16,00 = 62,03 NB: Il termine più corretto per indicare la massa molecolare relativa per i composti ionici è il peso formula.
La Mole
Quando si ha a che fare con atomi e molecole, è necessario stabilire un collegamento tra il mondo microscopico (che non si vede) e il mondo macroscopico (che si può misurare). La mole è lo «strumento» che permette di stabilire questo collegamento.
Esempi di Mole
Da sinistra a destra una mole di: saccarosio, cloruro di nichel, solfato di rame, permanganato di potassio, trucioli di rame e limatura di ferro. 500 300 -200 250 -125 200 150 100 150ml 75 400ml 150 100 -50 250ml -100 50 25 Science Photo Library La mole è una quantità di sostanza che contiene un numero definito di particelle (atomi, molecole, ioni).
Definizione e Unità di Misura
La mole è l'unità di misura della quantità di sostanza, denominata anche quantità chimica, che contiene un numero di particelle elementari uguale al numero di atomi presenti in 12 g di 12C. La mole (simbolo mol) è una delle sette unità di misura fondamentali.
- mercurio (Hg)
- carbonio (C)
- zolfo (S)
- etanolo (CH3CH2OH)
- 100 acqua (H2O)
- dicromato di potassio (K2Cr207)
- solfato di rame pentaidrato (CuSO4 · 5 H2O)
- 20 zinco (Zn)
- rame (Cu)
A B cloruro di sodio (NaCI) Una mole di alcuni elementi. Una mole di alcuni composti.
Massa Molare (M)
La massa di una mole si chiama massa molare (M) e la sua unità di misura è il grammo/mole (g/mol). La massa molare (M) di un elemento monoatomico (o di una molecola o di un composto ionico) è uguale alla sua massa atomica relativa (o molecolare o peso formula) espressa in grammi/mole.
Calcolo della Massa Molare del Metano
CH4 6 C Carbon 12.01 Molecular Weight 12.01 g/mol + (1.01 g/mol × 4) 1 H Hydrogen 1.01 = 16.05 g/mol
Massa molare (M) La massa molare (M) di un elemento monoatomico (o di una molecola o di un composto ionico) è uguale alla sua massa atomica (o molecolare o peso formula) espressa in grammi/mole.
CH 6 C Carbon 12.01 Molecular Weight + 12.01 g/mol (1.01 g/mol × 4 1 H Hydrogen 1.01 = 16.05 g/mol
Costante di Avogadro (NA)
È possibile ricavare il numero di particelle contenuto in una mole facendo il rapporto tra la massa molare unitaria, 1 g/mol, e l'unità di massa atomica u espressa in grammi, pari a 1,661 · 10-24 g.
1 g . mol-1 NA = 6,022 . 1023 mol-1 = 1,661 · 10-24 g 1 massa molare unitaria costante di Avogadro unità di massa atomica Il valore ottenuto è la costante di Avogadro (NA).
Proprietà della Costante di Avogadro
La costante di Avogadro non è un numero puro, bensì un numero di particelle diviso per una quantità di sostanza; infatti ha una dimensione, mol-1, da intendere come particelle/mole. Attenzione !!! Una mole di qualsiasi sostanza contiene sempre 6,022 - 1023particelle, siano atomi, molecole o ioni.
Esempi di Mole e Particelle Contenute
Una mole di ... .. corrisponde a ... ... e contiene:
- H 1,008 g 6,022 · 1023 atomi di H
- H2 2,016 g 6,022 · 1023 molecole di H2
- Na+ 22,99 g 6,022 · 1023 ioni Na+
- O2 32,00 g 6,022 · 1023 molecole di O2
- C 12,01 g 6,022 · 1023 atomi di C
- H2O 18,02 g 6,022 · 1023 molecole di H2O
La mole (mol) è l'unità di misura della quantità di sostanza e contiene sempre 6,022 - 1023 particelle elementari, siano atomi, molecole o ioni.
Alex Staroseltsev/ Shutterstock MarcelCle mens/Shutterstock Una mole di palle da baseball occupa lo stesso volume della Terra. 12.01 9 Ekkamai Chaikanta/ Shutterstock Andrew Lambert Photography/ Science Photo Library Le mine di grafite di 12 matite corrispondono a una mole di atomi di carbonio.
Calcoli con le Moli
Quantità di Sostanza in Moli (n)
Quantità di sostanza in moli (n) CONVERTIRE IN MOLI LA MASSA IN GRAMMI Possiamo ottenere la quantità di sostanza in moli, n, dividendo la massa del campione, m, per la massa molare, M, di quella sostanza.
massa del campione (g) L n = m M m = n · M quantità di sostanza in moli (mol) massa molare (g/mol) n M =- m n
Numero di Particelle (Np)
Numero di particelle Per calcolare il numero di particelle, No , presenti in un campione, si moltiplica la quantità di sostanza in moli (n) per la costante di Avogadro (6,022 - 1023 mol-1), NA , che rappresenta il numero di particelle contenute in una mole di qualsiasi sostanza.
quantità di sostanza in moli >Np = NA . n K numero di particelle costante di Avogadro n = Np P NA A