Studi di cancerogenesi: valutazione dei cancerogeni e linee guida in vivo
Documento dall'Università sugli studi di cancerogenesi. Il Pdf esplora il processo multi-stadio della cancerogenesi e le tecniche di valutazione dei cancerogeni, distinguendo tra genotossici e non genotossici. Il Pdf di Biologia, utile per l'Università, illustra le linee guida per gli studi in vivo, inclusi i protocolli di somministrazione e la durata del trattamento, con dettagli sulle osservazioni e analisi istopatologiche.
Mostra di più11 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Studi di cancerogenesi
Parallelamente alla tossicità per somministrazione ripetuta, vanno considerati gli studi di cancerogenesi, che vengono eseguiti in vivo sull'animale e sono molto dispendiosi dal punto di vista economico e temporale.
Cancerogenesi: processo e fasi
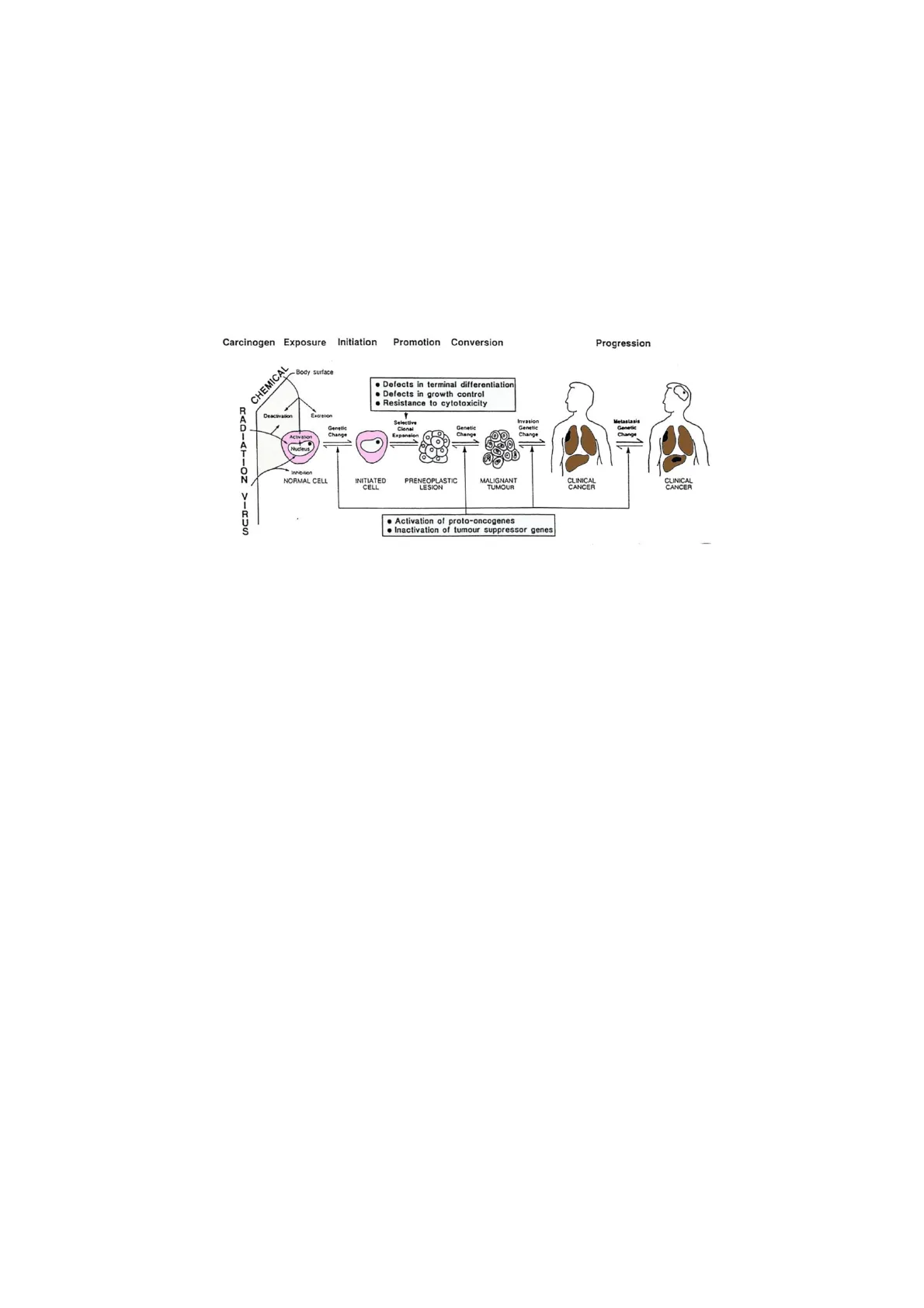
Cancerogenesi Carcinogen Exposure Initiation Promotion Conversion Progression CHEMICAL • Defects in terminal differentiation . Defects in growth control . Resistance to cytotoxicity R Deactivation Excrebon Meta Genetic Change Selective Clonal Expansion Genetic Change Invasion Genetic Change Activation Nucleus Inhibition NORMAL CELL INITIATED CELL PRENEOPLASTIC LESION MALIGNANT TUMOUR CLINICAL CANCER CLINICAL CANCER • Activation of proto-oncogenes . Inactivation of tumour suppressor genes
La cancerogenesi è un processo multi-stadio e probabilistico a cui possono andare incontro tutte le cellule dell'organismo.
Una qualsiasi cellula sana si può trasformare in una cellula tumorale a seguito di una lesione al DNA causata da un errore ereditario o casuale o da un agente mutageno.
Se la lesione non viene riparata, la sequenza del DNA così alterata può far sì che si attivino o disattivino dei geni che interferiscono con l'abituale funzionamento della cellula.
La trasformazione neoplastica avviene quando si accumula un numero di mutazioni sufficiente a modificare l'abilità di una cellula di sopravvivere e moltiplicarsi.
Questa fase, detta iniziazione, è solo la prima del processo di cancerogenesi.
Nella seconda fase, della fase di promozione, un agente promotore favorisce la proliferazione delle cellule con DNA alterato e quindi la crescita del tumore.
Dal punto di vista tossicologico ci si occupa delle fasi di iniziazione e promozione, mentre quella di progressione è di interesse clinico, essendo avvenuto il passaggio da tumore benigno a maligno.
Tecniche di valutazione dei cancerogeni
Per la valutazione delle sostanze cancerogene, si fa in modo di non ricorrere immediatamente ai saggi in vivo, con i quali vengono trattati almeno per 2 anni 50 animali per sesso e specie.
Sicuramente, in primo luogo, è opportuno consultare le diverse classificazioni dei cancerogeni (es, GHS, IARC) e raccogliere dati esistenti.
Solo in seguito, si passa ai saggi in vitro, e, infine, se necessario, ai saggi in vivo.
1 Body surfaceCancerogeno
Definizione di cancerogeno
Un cancerogeno è una sostanza che induce l'insorgenza o l'aumento nell'incidenza o nella malignità di tumori o una diminuzione del loro tempo di latenza.
Classificazione dei cancerogeni
I cancerogeni sono classificati in:
- Cancerogeni genotossici: interagiscono con il genoma cellulare (DNA) sia della linea germinale che somatica. La dose soglia non è determinabile.
- Cancerogeni non genotossici: causano effetti epigenetici (es. modulazione dell'espressione genica, comunicazione intercellulare o di altri fattori coinvolti nel processo di cancerogenesi) e determinano una citotossicità cronica associata alla proliferazione cellulare. La dose soglia è determinabile.
Studi di cancerogenesi: obiettivi e requisiti
Gli studi di cancerogenesi:
- Servono per identificare il potenziale cancerogeno nell'animale da esperimento e per valutare il rischio per l'uomo
- Sono dispendiosi, lunghi e quindi applicabili solo per composti per cui è previsto un trattamento a lunga durata (minimo 6 mesi) o per cui esistono indicazioni da precedenti studi di un potenziale effetto
- Sono richiesti per farmaci per cui è previsto un uso discontinuo ma cronico o ricorrente (es, riniti allergiche, depressione, ansia)
Farmaci con uso frequente o con brevi regimi di trattamento (anestetici, traccianti marcati ... ) non necessitano di questi studi.
2
Classificazione IARC
Le liste compilate dalla IARC (Agenzia Internazionale per la Ricerca sul Cancro) raggruppano le sostanze sulla base della solidità delle prove che dimostrano che una sostanza può provocare il cancro.
In particolare, le sostanze sono classificate nel seguente modo:
Gruppo I: Cancerogeno per l'uomo
- evidenza di cancerogenicità sufficiente per l'uomo
- evidenza di cancerogenicità insufficiente per l'uomo, ma sufficiente nei saggi in vivo e supportata nei soggetti esposti da meccanismi di azione rilevanti per la cancerogenesi
Gruppo 2A: Probabile cancerogeno per l'uomo
- evidenza di cancerogenicità limitata per l'uomo e sufficiente nei saggi in vivo
- evidenza di cancerogenicità inadeguata per l'uomo e sufficiente nei saggi in vivo, supportata da meccanismi di azione rilevanti per l'uomo
Gruppo 2B: Possibile cancerogeno per l'uomo
- evidenza limitata per l'uomo e non sufficiente nei saggi in vivo
- evidenza inadeguata per l'uomo e sufficiente nei saggi in vivo
- evidenza inadeguata per l'uomo e non sufficiente nei saggi in vivo, purché questa sia saldamente supportata da altri dati rilevanti
Gruppo 3: Non classificabile per la cancerogenicità per l'uomo
- evidenza inadeguata per l'uomo e inadeguata o limitata nei saggi in vivo
- agenti con evidenza inadeguata per l'uomo e sufficiente nei saggi in vivo, il cui meccanismo di azione non è rilevante per l'uomo
- agenti che non ricadono in nessun altra categoria
Gruppo 4: Non cancerogeno per l'uomo
- agenti con evidenza di assenza di cancerogenicità sia per l'uomo che per gli animali.
- agenti con evidenza inadeguata per l'uomo ma con provata mancanza di cancerogenicità per gli animali, saldamente supportata da altri dati rilevanti
Classificazione GHS
UE 67/548 Categoria I Categoria 2 Categoria 3 R45/(R49) R45/(R49) R40 x CLP Categoria IA Categoria IB Categoria 2 H350 H350 H351
Le sostanze cancerogene sono classificate anche secondo il sistema GHS, che distingue generalmente le classi in pericoli fisici, pericoli per la salute e pericoli per l'ambiente.
3
Raccolta di dati esistenti
Dati non sperimentali
Si parte dai dati non sperimentali che comprendono:
- Valutazione di somiglianze nella struttura chimica e di analoghi
- Utilizzo di modelli struttura attività (Q)SAR
Dati sperimentali in vitro
Si passa poi ai dati sperimentali in vitro, che includono:
- Studi di genotossicità
- Risultati di test di trasformazione cellulare in vitro
- Studi meccanicistici
- Proliferazione cellulare
- Alterazione comunicazione intercellulare
- Binding al recettore per ormoni o altri modulatori
- Altri meccanismi d'azione, ad esempio attività immunosopressiva, capacità di attivare o inibire l'apoptosi, capacità di stimolare l'angiogenesi o la secrezione di fattori angiogenetici.
Dati sperimentali in vivo
Infine, ci sono i dati sperimentali in vivo:
- Studi di cancerogenesi a lungo termine
- Studi a breve o medio termine
- Modelli di roditore geneticamente modificati (topi transgenici)
- Studi di genotossicità in vivo
- Saggi di tossicità cronica (dose-ripetuta)
- Studi di induzione di proliferazione cellulare
- Studi di attività immunosoppressiva
- Studi di tossicocinetica
4
Studi di cancerogenesi in vivo
Gli studi di cancerogenesi in vivo sono lunghi e dispendiosi, e quando possibile, si accoppiano agli studi di tossicità cronica.
Linea guida TG 451: studi di cancerogenesi
Lo scopo dello studio, secondo la linea guida numero 451, è quello di indentificare lo sviluppo di lesioni neoplastiche durante o dopo l'esposizione alla sostanza in esame attraverso un appropriata via di somministrazione.
C'è una stretta correlazione tra sviluppo di cancerogenesi nell'animale e nell'uomo, con solo alcune eccezioni.
Gli animali trattati sono, per la maggior parte, ratti e topi: se ne utilizzano almeno 50 per ogni sesso per ogni gruppo di trattamento e ogni gruppo di controllo.
Si fanno almeno 3 dosi di trattamento e un controllo.
La somministrazione avviene quotidianamente con la dieta o con l'acqua da bere oppure per via orale, dermica o per via inalatoria.
La durata del trattamento è di 24 mesi nel ratto e di 18 mesi per alcuni ceppi di topo.
Lo studio ha termine quando il numero dei sopravviventi nel gruppo di trattamento alla dose più bassa scende al di sotto del 25%.
Dati sperimentali raccolti
I dati sperimentali raccolti devono riguardare:
- Misure di peso e consumo di cibo
- Osservazioni giornaliere dettagliate
- Esame necroscopico
- Istopatologia
Disegno sperimentale
Molto spesso sono richieste due specie, scartando quelle con un'alta incidenza spontanea di tumori.
Si utilizzano 50 animali per sesso e per dose.
La via di somministrazione è la stessa prevista per l'uomo, quindi quella proposta per l'uso clinico, con somministrazione giornaliera.
5
Livelli di dose
Sono previsti 3 livelli di dose:
- la più alta corrisponde alla massima dose tollerabile, quindi deve produrre un minimo effetto tossico (calo ponderale del 10%)
- la dose più bassa è quella che produce l'effetto farmacologico nell'animale
- la dose intermedia è la media geometrica tra le altre
La durata del trattamento è di 24 mesi per il ratto e di 18 mesi per il topo, essendo necessario ricoprire almeno 2/3 della vita dell'animale.
Linea guida TG 453: studi combinati tossicità cronica/cancerogenesi
Per "risparmiare" il numero di animali sperimentali impiegati, si possono accoppiare gli studi di cancerogenesi con quelli di tossicità cronica, secondo le linee guida numero 453.
Lo scopo dello studio è andare ad indentificare sia lo sviluppo di cancerogenesi che eventuali effetti cronici dovuti alla somministrazione di una sostanza e determinare le relazioni dose- risposta dopo un'esposizione prolungata e ripetuta.
Gli animali trattati sono i ratti: se ne utilizzano almeno 50 per ogni sesso per ogni gruppo di trattamento e ogni gruppo di controllo per lo studio di cancerogenesi.
Almeno 10 animali per ogni sesso per ogni gruppo di trattamento e ogni gruppo di controllo per lo studio di tossicità cronica.
Si fanno almeno 3 dosi di trattamento e un controllo.
La somministrazione avviene quotidianamente con la dieta o con l'acqua da bere oppure per via orale, dermica o per via inalatoria.
La durata del trattamento è di 12 mesi per la tossicità cronica e di 24 mesi per la cancerogenesi.
Dati sperimentali raccolti negli studi combinati
I dati sperimentali raccolti devono riguardare:
- misure di peso e consumo di cibo
- osservazioni giornaliere dettagliate
- esame necroscopico
- istopatologia
Potrebbero essere previsti, in aggiunta a quelli già citati, dei gruppi satellite, composti da almeno 10 animali per sesso e per dose, per eventuali sacrifici intermedi.
6