Approccio di terapia genica per aumentare la sintesi del Gaba e Alzheimer
Documento da Università su approccio di terapia genica per aumentare la sintesi del Gaba. Il Pdf esplora le terapie geniche e cellulari per il Parkinson e l'Alzheimer, trattando diagnosi, fattori di rischio e patogenesi, utile per Biologia a livello universitario.
Mostra di più15 pagine

Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
Approccio di Terapia Genica per il Parkinson
Approccio di Terapia Genica per Aumentare la Sintesi del GABA
Nel morbo di Parkinson il sistema più colpito è quello dopaminergico, poiché i neuroni dopaminergici degenerano progressivamente. La riduzione dell'attività dopaminergica porta a uno squilibrio nei sistemi di altri neurotrasmettitori, tra cui il sistema GABA-ergico, che risulta meno funzionante nei pazienti con Parkinson e presenta una riduzione della disponibilità di GABA. Per compensare questa carenza, l'approccio terapeutico prevede di aumentare la sintesi di GABA mediante un vettore genico che veicola il gene dell'enzima GAD (Acido Glutammico Decarbossilasi). Questo enzima è essenziale per la sintesi del GABA a partire dall'acido glutammico, permettendo quindi di ripristinare i livelli di GABA nel sistema nervoso dei pazienti.
Approccio di Terapia Genica Basata sulle Cause Genetiche
Nelle forme familiari del Parkinson, si riscontra una mutazione nel gene della Parkina. La Parkina è una E3 ubiquitina ligasi, un enzima del sistema ubiquitina-proteasoma che regola la degradazione delle proteine all'interno della cellula. Gli enzimi E3 ligasi coniugano molecole di ubiquitina alle proteine da degradare, segnalandole per la loro successiva degradazione. L'approccio genico prevede quindi di utilizzare vettori che possano ripristinare la funzione normale della Parkina. Questo suggerisce che nel Parkinson possa verificarsi una alterazione della degradazione delle proteine. In effetti, nei pazienti con Parkinson sono presenti corpi di Lewy, aggregati proteici formati principalmente da a-sinucleina, la cui accumulazione potrebbe essere collegata ai difetti nella degradazione proteica causati dalla disfunzione della Parkina.
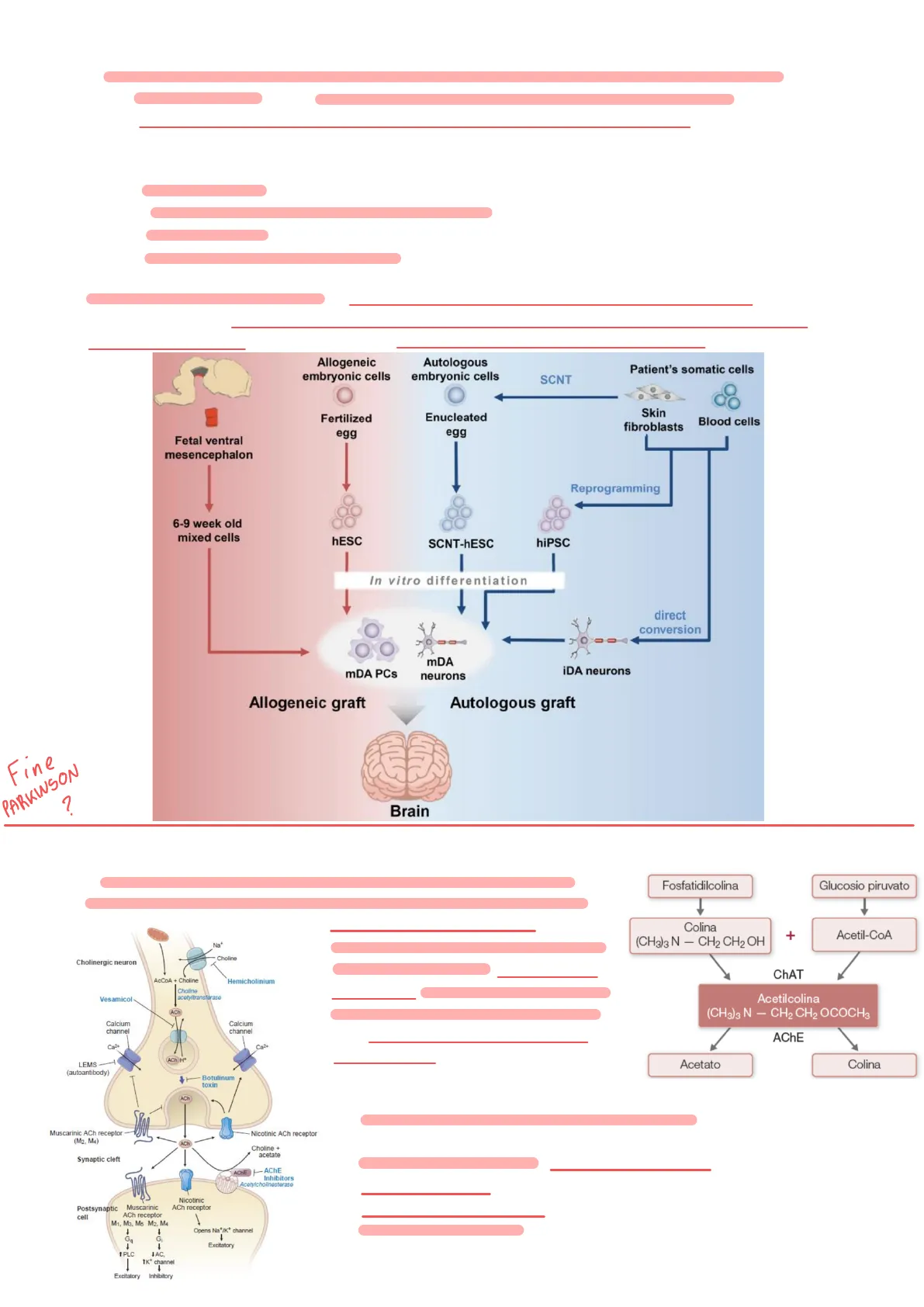
Approccio di Terapia Genica Basata sulle Cellule Staminali
v Cellule del mesencefalo ventrale Studi di circa 20-30 anni fa hanno esplorato l'uso di cellule prelevate dal mesencefalo ventrale di feti abortiti (tra la 6ª e la 9ª settimana di gestazione). Le cellule, comprendenti neuroblasti, progenitori neuronali e neuroni dopaminergici, sono state impiantate nel cervello di pazienti con Parkinson. Risultati: le cellule si sono differenziate, proliferate e integrate nelle aree cerebrali di trapianto, con un miglioramento dei sintomi.
è Obiettivo: sostituire i neuroni dopaminergici degenerati. Problemi di questo approccio:
- Clinici: le cellule sono allogeniche (non derivate dal paziente), quindi riconosciute come estranee dal sistema immunitario. È necessario un trattamento immunosoppressivo cronico, che indebolisce il sistema immunitario e aumenta il rischio di infezioni.
- Pratici: limitata disponibilità di cellule embrionali per tutti i pazienti.
- Etici: questioni irrisolte sull'uso degli embrioni nella ricerca e nella terapia.
Z NESC (Cellule Staminali Embrionali Umane) > Un approccio alternativo prevede l'uso di un ovulo fertilizzato per produrre cellule staminali embrionali umane (hESC). Queste cellule vengono differenziate in progenitori neuronali e neuroni dopaminergici per i trapianti.
- Vantaggio: riduce le problematiche etiche rispetto all'uso diretto di embrioni.
- Limite: allogenicità. Se l'ovulo fertilizzato non proviene dal paziente, è comunque necessario un trattamento immunosoppressivo.
3 SCNT - hESC (Cellule Staminali Embrionali da Trasferimento Nucleare di Cellule Somatiche) Il trasferimento nucleare di cellule somatiche (SCNT) implica l'inserimento del nucleo di una cellula somatica del paziente (ad es. cellula cutanea o del sangue) in un ovulo fertilizzato. Si ottengono così cellule staminali embrionali geneticamente identiche al paziente (autologhe).
-> Vantaggio: nessun rischio di rigetto, dato che le cellule trapiantate sono riconosciute come "self" dal sistema immunitario del paziente. Successivamente, queste cellule possono essere differenziate in neuroni dopaminergici per il trapianto.
4 % iPSC (Cellule Staminali Pluripotenti Indotte)Le cellule somatiche del paziente vengono riprogrammate in vitro per ritornare a uno stato meno differenziato. Le cellule pluripotenti ottenute vengono poi differenziate in progenitori neuronali e neuroni dopaminergici. Questa tecnica utilizza cocktail di fattori di crescita e altre molecole che modulano l'espressione genica. Vantaggi:
-> Personalizzazione: i neuroni dopaminergici sono specifici per ogni paziente. ® Nessun trattamento immunosoppressivo necessario. ® Risorsa illimitata: le cellule somatiche del paziente sono facilmente reperibili. -> Assenza di limitazioni etiche e pratiche. Limiti: rischio di formazione di tumori. Le cellule riprogrammate possono avere attività proliferativa elevata, soprattutto i progenitori neuronali. Studi preclinici hanno però permesso il passaggio alla fase clinica, in cui sono stati trapiantati staminali mesenchimali che hanno mostrato un effetto positivo sui sintomi, con buona tollerabilità e sicurezza.
Allogeneic embryonic cells Autologous embryonic cells Patient's somatic cells SCNT Fertilized egg Enucleated egg Skin fibroblasts Blood cells Fetal ventral mesencephalon Reprogramming 6-9 week old mixed cells hESC SCNT-hESC hiPSC In vitro differentiation direct conversion mDA PCs mDA neurons iDA neurons Allogeneic graft Autologous graft Fine PARKINSON ? Brain
Trasmissione Colinergica dell'Acetilcolina (ACh)
Sintesi e Degradazione dell'ACh
Fosfatidilcolina Glucosio piruvato Colina (CH3)3 N - CH2 CH2 OH + Acetil-CoA ChAT Acetilcolina (CH3)3 N - CH2 CH2 OCOCH3 AChE Acetato Colina FONTI DI COLINA 1. Colina riciclata dalla degradazione dell'ACh rilasciata, riutilizzata dal neurone per nuova sintesi. 2. Fosfatidilcolina dal plasma, trasportata al SNC tramite: -> Diffusione facilitata (bassa affinità) -> Trasporto sodio-dipendente (alta affinità) 3. Fosfolipidi di membrana, in cui la colina è presente come fosforilcolina. Ga G 1 PLC JAC. - 1K+ channel 1 Excitatory Inhibitory L'acetilcolina (ACh) è sintetizzata nel neurone pre-sinaptico tramite la colina acetiltransferasi, che trasferisce un gruppo acetilico dall'acetil-CoA alla colina. La degradazione dell'ACh è mediata Na dall'acetilcolinesterasi (AChE), che scinde Choline l'ACh in acetato e colina. La sintesi di ACh AcCoA + Choline Hemicholinium Choline Vesamicol acetyltransferase dipende dalla disponibilità di colina, che non AC attraversa la barriera emato-encefalica e Calcium channel Calcium channel deve quindi essere trasportata al neurone Ca2 Ca2 ACh H+ sotto altre forme. Cholinergic neuron LEMS (autoantibody) -Botulinum toxin ACh Muscarinic ACh receptor (M2, M4) -Nicotinic ACh receptor ACh Choline + acetate Synaptic cleft ACHE LAChE Inhibitors Acetylcholinesterase Nicotinic ACh receptor Postsynaptic cell Muscarinic ACh receptor M1, M3, M5 M2, M4 1 4 Opens Na+/K+ channel 1 1 Excitatory
Rilascio e Azione dell'ACh
La colina presente nel neurone pre-sinaptico si combina con l'acetil-CoA per formare acetilcolina (ACh), che viene poi immagazzinata nelle vescicole sinaptiche e rilasciata nel terminale pre-sinaptico in risposta a un potenziale d'azione.
-> Agisce su recettori pre-sinaptici e post-sinaptici. Tipi di recettori colinergici recettori dopamina 01-05 02-03-04
- Recettori muscarinici (accoppiati a proteine G): -> Recettori dispari M1, M3, M5: attivatori che facilitano l'attivazione del neurone post-sinaptico. ® Recettori pari M2, M4: inibitori che riducono l'attivazione del neurone.
- Recettori nicotinici (canale ligando-dipendenti): ® Quando l'ACh si lega al recettore nicotinico, il canale cambia conformazione e si apre, permettendo il passaggio di ioni sodio e potassio, influenzando l'attivazione neuronale.
Enzimi di Degradazione dell'ACh
- Acetilcolinesterasi (AChE): Enzima chiave per la degradazione dell'acetilcolina (ACh) nello spazio sinaptico, fondamentale per arrestare la trasmissione del segnale. L'AChE è presente sia a livello extracellulare che intracellulare ed è altamente efficiente, processando circa 400.000 molecole di ACh al minuto per molecola di enzima.
- Butirrilcolinesterasi (BuChE): Un enzima aggiuntivo capace di degradare l'ACh, anche se con un ruolo meno specifico rispetto all'AChE.
ACETYLCHOLINE IS DESTROYED ACHE A4 A D FB 1 AChE
Effetti della Trasmissione Colinergica nel Sistema Nervoso Centrale
- Aumento dell'attenzione
- Modulazione del sonno
- Funzioni cognitive e apprendimento
- Memoria (immagazzinamento e richiamo delle informazioni)
- Modulazione del dolore
- Patologie correlate: o Attivazione cronica della trasmissione colinergica > neuromodulazione alterata, osservata in depressione e schizofrenia. o Mutazioni nei recettori nicotinici colinergici - forme genetiche di epilessia.
Funzioni dell'ACh nel Sistema Nervoso Parasimpatico
L'ACh è il neurotrasmettitore principale del sistema nervoso parasimpatico, che media le risposte di "riposo e digestione". Principali effetti parasimpatici dell'ACh
- Occhio: migliora la visione da vicino.
- Salivazione: aumenta la produzione di saliva.
- Polmoni: provoca broncocostrizione.
- Cuore: abbassa la pressione arteriosa e riduce la frequenza cardiaca.
- Secrezioni: stimola la produzione di secrezioni digestive.
- Intestino: aumenta i movimenti peristaltici. Vescica: riduce il tono degli sfinteri, facilitando la minzione.
Demenza
-> Ogni 3 secondi viene diagnosticato un caso di demenza. -> La malattia di Alzheimer è la causa principale, con un numero di casi in aumento esponenziale:
- 2015: 47 milioni di diagnosi
- 2020: circa 75 milioni di diagnosi previste
- 2050: oltre 130 milioni di casi previsti
-> Oltre la metà dei pazienti risiede in paesi a basso reddito, dove i sistemi sanitari sono spesso carenti e l'accesso a cure è limitato. Total: 6.5 Million 65-74 years: 1.75 million (27.0%) 75-84 years: . 2.41 million (37.2%) 85+ years: 2.31 million (35.7%)
-> La spesa sanitaria per il trattamento della demenza nel 2015 è stata di 818 miliardi di dollari. Se la demenza fosse considerata un'economia autonoma, sarebbe la diciottesima economia mondiale. -> La demenza colpisce prevalentemente le persone anziane.
- Il rischio di sviluppare la demenza aumenta significativamente dai 65 anni in poi, con una prevalenza crescente nelle fasce di età avanzate.
Dementia Umbrella term which defines loss of memory and other thinking abilities severe enough to interfere with daily life 60-80% Alzheimer's disease 20-30% Vascular dementia 10-25% Lewy body dementia Others: Parkinson's disease Huntington's disease Mixed dementia: dementia from more than one cause La demenza è una sindrome caratterizzata da perdita di memoria e funzioni cognitive, che compromette la qualità della vita e l'indipendenza, rendendo necessaria un'assistenza continua. È una malattia neurologica progressiva con un impatto forte soprattutto sulla memoria a breve termine. Il termine "demenza" è un ombrello che racchiude diverse patologie.
Cause e Tipi di Demenza
- Alzheimer: causa principale di demenza, rappresenta il 60-80% dei casi.
- Altre forme: o Demenza vascolare: legata a eventi cerebrovascolari come l'ictus. o Demenza frontotemporale o Malattia di Parkinson e malattia di Huntington
Sintomi e Manifestazioni della Demenza
- Modificazioni della personalità: ES, una persona pacata può diventare improvvisamente aggressiva.
- Depressione: consapevolezza dei propri limiti porta il paziente a uno stato depressivo.
- Paranoie: idee deliranti come il timore che persone care siano state sostituite da impostori.
- Allucinazioni
- Disturbi del sonno Farmaci utilizzati per il controllo dei sintomi:
- Antipsicotici
- Antidepressivi
- Anticonvulsivanti Alcuni casi di demenza possono essere reversibili se la causa è individuata e trattata tempestivamente. Cause di demenza reversibile:
- Carenze vitaminiche: es., vitamina B1 o B12.
- Alterazioni endocrine: ad es., ipotiroidismo grave.
- Infezioni: HIV, sifilide, tubercolosi in forme avanzate possono portare a demenza.
- Farmaci: gli anticolinergici possono causare demenza come effetto collaterale, inibendo il sistema colinergico.
Malattia di Alzheimer
L'Alzheimer è una patologia neurodegenerativa, progressiva e irreversibile caratterizzata dalla morte dei neuroni colinergici. Attualmente non esiste una cura, e i trattamenti farmacologici disponibili sono esclusivamente sintomatici.
Patogenesi della Malattia di Alzheimer
- Placche neuritiche: si osserva un accumulo anomalo della proteina beta-amiloide, che forma aggregati sotto forma di placche extracellulari.
- Grovigli neurofibrillari: presenza di agglomerati intracellulari di neurofibrille formati dalla proteina TAU in forma anomala. Nota: Sia le placche che i grovigli sono riscontrabili anche negli anziani con normale funzione cognitiva, ma in quantità molto minore rispetto ai pazienti con Alzheimer.
- Perdita di neuroni: il cervello di un paziente con Alzheimer appare più piccolo a causa della riduzione delle aree coinvolte nella memoria, linguaggio e altre funzioni cognitive.
Brain Cross-Sections Sulcus Sulcus Gyrus · Gyrus P Ventricle Languag Language Memory Memory Normal Alzheimer's Atrofia delle aree corticali e dell'ippocampo 5-10% Frontotemporal dementia