Proteine: struttura, funzioni e amminoacidi essenziali
Slide di Università su Proteine. La Pdf esplora la struttura e le funzioni delle proteine, con un focus sugli amminoacidi essenziali e semiessenziali. Vengono descritti i processi di maturazione delle proteine, come la formazione dell'insulina, e l'importanza dei legami disolfuro. Si analizzano anche i peptidi segnale e il loro ruolo nella destinazione delle proteine all'interno della cellula.
Ver más63 páginas

Visualiza gratis el PDF completo
Regístrate para acceder al documento completo y transformarlo con la IA.
Vista previa
Proteine: Angoli di Torsione e Conformazioni
GLI ANGOLI DI TORSIONE TRA I GRUPPI PEPTIDICI DESCRIVONO LE CONFORMAZIONI DELLE CATENE POLIPEPTIDICHE Lo scheletro è costituito da gruppi peptidici planari. Gli amminoacidi si legano tra loro mediante legame peptidico
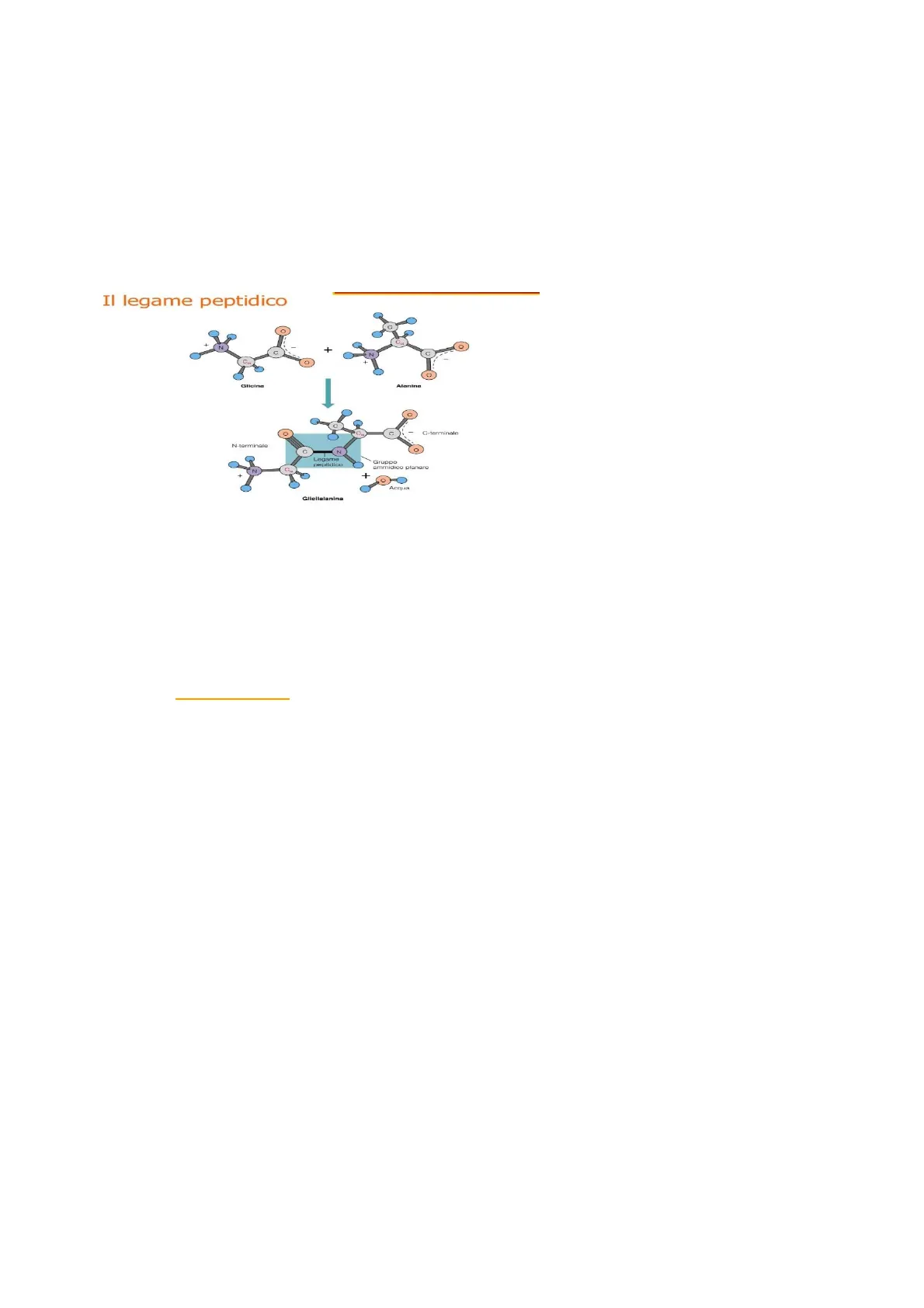
Il Legame Peptidico
O O N + C o Glicina Alanina 1 C. G-terminale N-terminale C N Legame Gruppo peptidico ammidico planare C. ++ Acqua Glicilalanina
Aminoacidi Essenziali e Semiessenziali
Nove dei 22 aminoacidi sono detti essenziali, perché il nostro organismo non è capace di sintetizzarli, cioè fabbricarli partendo da altri composti e deve necessariamente prenderli da alimenti che li contengono. Anche se a livello cellulare tutti i venti aminoacidi devono essere contemporaneamente presenti, solo nove devono essere introdotti preformati con gli alimenti in quanto l'organismo non è in grado di sintetizzarli. Questi nove aminoacidi vengono definiti aminoacidi essenziali (AAE) (valina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano e istidina). Sono poi considerati semiessenziali cisteina e tirosina, in quanto sono in grado di risparmiare rispettivamente metionina e fenilalanina. Tutti gli altri aminoacidi possono prendere origine da una fonte anche molto semplice di azoto.
Precursori di Molecole Biologiche
Gli aminoacidi, oltre a svolgere una funzione come tali e cioè come componenti della molecola proteica, sono anche precursori di molecole con importanti funzioni biologiche:
- ad esempio il triptofano è un precursore della niacina - vitamina PP - e del neurotrasmettitore serotonina;
- gli aminoacidi solforati sono precursori del glutatione, importante per le difese antiossidative cellulari e quando introdotti con la dieta in quantità superiore ai bisogni costituiscono una fonte utilizzabile di energia.
Aminoacidi Condizionatamente Essenziali
Anche se non sono da considerare direttamente come essenziali, ricevono attualmente notevole interesse dal punto di vista nutrizionale anche altri aminoacidi, quali glicina, prolina, arginina, glutammina e taurina (che è un derivato delle cisteina); essi sono definiti "condizionatamente essenziali". Questi aminoacidi ricoprono un ruolo fondamentale nel mantenimento dell'omeostasi e delle funzioni dell'organismo umano in varie condizioni fisiologiche e possono in alcune condizioni fisiopatologiche, non essere sintetizzati a velocità sufficiente. In questo contesto assume particolare interesse l'arginina come precursore dell'ossido nitrico per le molteplici funzioni che questo composto esplica nella comunicazione cellulare, nella trasduzionedei segnali biologici e nella difesa immunitaria. In base alla quantità di aminoacidi presenti, si definisce anche il valore biologico della proteina, cioè la sua importanza per il nostro organismo.
Valore Biologico delle Proteine
Avremo:
- Proteine ad alto valore biologico
- Proteine a basso valore biologico
- Proteine a valore biologico nullo
Classificazione delle Proteine in Base agli Aminoacidi
Sulla base degli AA presenti, le proteine possono essere suddivise in due distinti gruppi:
- Proteine complete
- Proteine incomplete
Le prime, dette anche nobili, contengono tutti gli aminoacidi essenziali nelle giuste proporzioni. Le seconde mancano di uno o piu' aminoacidi essenziali oppure li contengono in quantità inadeguata ed hanno quindi una deficienza assoluta o relativa di questi ultimi. Al primo gruppo appartengono quasi tutte le proteine animali mentre quelle vegetali appartengono per lo più al secondo. Per esempio, le proteine dei cereali hanno deficienza relativa in lisina e triptofano, quelle dei legumi in metionina. L'essenzialità di un aminoacido varia comunque da specie a specie animale ed è in relazione a numerose influenze. Per esempio l'istidina è sintetizzabile in quantità sufficiente solo nell'adulto.
Funzioni delle Proteine
FUNZIONI PROTEINE
- Contribuiscono alla formazione di cellule e tessuti
- Controllano molti processi dell'organismo, sotto forma di enzimi e ormoni
- Difendono l'organismo dagli agenti esterni: la cheratina è la proteina che costituisce unghie, peli, capelli, che proteggono le zone piu' delicate e sensibili.
- Trasmettono l'informazione genetica
- Trasportano nutrienti ed altre sostanze nel sangue: per esempio le lipoproteine trasportano i grassi e l'emoglobina l'ossigeno
- Costituiscono le difese immunitarie: gli anticorpi sono delle proteine preposte alla difesa del nostro organismo
Conformazione Nativa e Folding
Le proteine generalmente assumono una conformazione nativa che si origina mediante un processo di ripiegamento o folding generalmente spontaneo della sua struttura primaria fino alla formazione di una struttura tridimensionale specifica mediata dalla formazione di legami deboli. La conformazione nativa corrisponde al valore minimo di DG tra l'enorme numero di conformazioni che un peptide può assumere.Si verifica un meccanismo di avvolgimento graduale attraverso le conformazioni possibili verso la forma nativa e più stabile in determinate condizioni di forza ionica, pH e temperatura.
Livelli di Organizzazione Strutturale
Alanina · I Glicina 1 Serina 1 Valina I Leucina - 1 Lisina 1 Glicina 1 Valina - Primaria Secondaria Terziaria Quaternaria M. Lieberman Marks Biochimica medica Copyright 2010 C.E.A. Casa Editrice Ambrosiana
Struttura Primaria
E' data dalla sequenza e dal tipo di amminoacido nella sua catena. Le sequenze amminoacidiche delle proteine di un individuo sono depositate in codice, nei geni (tratti del suo DNA). Il legame che unisce i vari amminoacidi è detto peptidico ed avviene fra il gruppo carbossilico di un amminoacido e quello amminico dell'amminoacido successivo.
Struttura Secondaria
E' la struttura tridimensionale singola e ben determinata in cui si trova quella data proteina. In essa sono importanti:
- il modo in cui la proteina è piegata;
- la natura dei legami che stabilizzano la struttura.
Le principali strutture secondarie sono:
- a elica,
- lamina b,
- la ripiegatura b - l'elica del collageno.
Alfa-elica
a-elica: i piani dei legami peptidici sono piegati secondo angoli di 80° e si avvolgono in senso destrogiro attorno ad un asse ideale. L'a elica è stabilizzata da legami H tra l'O del gruppo -CO- di un amminoacido e l'H del gruppo -NHdell'amminoacido sottostante (4 aa più avanti).Alcune proteine fibrose con particolari proprietà meccaniche sono costituite da più a eliche che si attorcigliano insieme a formare una specie di corda molto lunga ove i singoli filamenti sono tenuti insieme da ponti H stabilitisi fra catene parallele (a-cheratina di capelli ed unghie).
Lamina Beta o Struttura a Foglio Pieghettato
Lamina b o struttura a foglio pieghettato: con catene più distese, angoli di legame di 120°. 2 o più catene polipeptidiche o altrettanti tratti di una stessa catena sono di fianco e la stabilizzazione è data da ponti H fra i -CO- di una catena e gli - NHdi quella adiacente. Quando la proteina può invertire di senso piegandosi ad U la stabilizzazione è data da un legame H fra il -CO- di un aa e il gruppo -NH- del terzo successivo.
Elica del Collageno
Elica del collageno Ove ogni spira contiene solo 3 aa di cui uno è sempre la glicina mentre gli altri per lo più prolina ed idrossiprolina. Stabilizzati solo da ponti H intercatene.
Struttura Terziaria
E' un'ulteriore organizzazione tridimensionale compatta della molecola che riguarda soprattutto le proteine globulari (enzimi, ormoni, recettori, ecc.).Non è una struttura ben definita, ma scaturisce dalle reciproche disposizioni spaziali dei tratti ad -elica, a lamina, etc E' stabilizzata da una serie di legami che possono essere: legami covalenti: ponti disolfuro fra cisteine non adiacenti e spesso distanti; legami ionici: tra gruppi carichi negativamente e positivamente degli R; legami ad H sia tra i -CO- e gli -NH- dei legami peptidici che tra i gruppi polari delle catene lineari; legami idrofobi ossia interazioni tra R apolari tendenti a formare zone in cui restano escluse le molecole di acqua.
Struttura Quaternaria
Data dall'associazione mediante legami covalenti di piu' catene polipeptidiche uguali o diverse che presentano già le precedenti strutture. Aumentando la complessità della molecola, aumentano le sue proprietà biologiche. Circa il 25% delle proteine solubili sono composte da a-eliche, unite da anse e da ripiegamenti della catena. Anche molte proteine di membrana sono composte da a- eliche
Interazioni Idrofobiche e Localizzazione delle Catene Laterali
LIVELLI DI ORGANIZZAZIONE DELLE PROTEINE LE INTERAZIONI IDROFOBICHE
- uniscono i residui posti all'interno di una proteina, infatti le catene apolari degli aminoacidi si associano all'interno delle proteine globulari
- anche se individualmente molto deboli, sono presenti in numero talmente elevato da contribuire in maniera fondamentale alla stabilizzazione della struttura della proteina.
Localizzazione delle Catene Laterali in Base alla Polarità
LA LOCALIZZAZIONE DELLE CATENE LATERALI VARIA CON LA POLARITA' IDROFILICI Ser coo" CH2OH CH C -Ter coo- [Glu COO 1 Leu CH2 Ala CH CH3 CH2 H.C IDROFOBICI CH2 CF lle H3 N N-Ter Phe CH CH2 C=NH2 NH CH 3 ZHN 3.1 S-CH 3 CH 2 Met Cys CH 2 Asn ) CONH2 (CH234 1 Lys CHN Le catene laterali polari non cariche di Ser, Thr, Asn, Gln e Tyr si trovano solitamente sulla superficie proteica, ma si ritrovano anche all interno della proteina: formano quasi sempre legami H con altri gruppi.
Distribuzione Invertita degli Aminoacidi nella Porina
DISTRIBUZIONE INVERTITA DEGLI AA NELLA PORINA Proteine che attraversano bilayers:
- Esterno: aa idrofobici
- Parte centrale: aa polari, che circondano un canale contenente acqua, che attraversa la proteina
Val HC CH2 CH2SH Arg I (CH2)3 CH HO Tyr CH2 1 CH3 AspAmbiente esterno in gran parte idrofobico Canale idrofilico riempito d'acqua
Emoglobina e Legame all'Ossigeno
EMOGLOBINA Il legame all'ossigeno altera l'intera struttura del tetramero e di conseguenza le strutture della deossiemoglobina e dell'ossiemoglobina sono considerevolmente diverse. In entrambe le forme le subunita a e ß possiedono un gran numero di contatti suddivisibili in due regioni: quelli presenti nell'interfaccia a1-ß1 (e all'interfaccia equivalente a2-ß2) che coinvolgono 35 residui, e quelli presenti nell'interfaccia a1-2 (e all'equivalente a2-ß1) che coinvolgono 19 residui. Queste associazioni sono prevalentemente idrofobiche, anche se sono presenti legami idrogeno e coppie ioniche.
Deossiemoglobina e Ossiemoglobina
DEOSSIEMOGLOBINA J B OSSIEMOGLOBINAQuando si lega l'ossigeno, i contatti nella regione a-1 B-2 (e nella regione a-2 B-2) si spostano producendo una modificazione della struttura quaternaria. L'ossigeno determina la rotazione di un dimero ab di circa 15° rispetto all'altro dimero, che porta a un avvicinamento delle subunità B restringendo il canale centrale pieno di solvente dell'emoglobina. I contatti a1-a2 o B1-B2 sono pochi e di carattere polare. Queste subunità si guardano l'un l'altra attraverso un canale pieno di solvente del diametro di circa 20 Armstrong. Il canale è coassiale con l'asse di simmetria della molecola. B1 B2
Domini Proteici e Calmodulina
I LIVELLI DI ORGANIZZAZIONE DELLE PROTEINE La struttura terziaria di un polipeptide descrive la disposizione di ciascuno dei suoi atomi nello spazio. Dominio è una unità strutturale globulare compatta dentro una catena polipeptidica con un core idrofobico e una superficie idrofilica che in genere è indipendente da altre unità strutturali nella stessa catena polipeptidica e svolge una funzione specifica
Calmodulina: Proteina Regolatoria
Calmodulina: proteina eucariotica ubiquitaria che lega il calcio, partecipando a numerosi processi cellulari di tipo regolatorio (segnalazione cellulare, contrazione muscolare, fecondazione, metabolismo, morte programmata cellulare, memoria a breve e a lungo termine, crescita cellule nervose, risposta immunitaria e divisione cellulare) Ognuno di questi siti di legame per i due ioni calcio è formato da un motivo strutturale elica-ansa-elica. Struttura calmodulina: una struttura a 7 giri di elica separa 2 domini globulari molto simili tra loro. Il dominio è una regione di struttura terziaria compatta semi-indipedente formata generalmente da 100 - 250 aa caratterizzata da una geometria specifica con un core idrofobico e una superficie polare. Questo dominio si può trovare in proteine che legano NAD+ o riboflavina. Tuttavia, altre proteine che legano NAD+ presentano ripiegamenti differenti (esempio di evoluzione convergente).
Classificazione e Caratteristiche dei Domini
- Possiamo classificare una proteina in base alla presenza di domini specifici formate da diverse strutture secondarie
- Molecole proteiche grandi posso avere più domini deputate a diverse funzioni ed un certo tipo di dominio si può trovare su diversi tipi di proteine
- I domini sono costituiti da motivi di struttura secondaria ripetuti (b/a, b/a/a, b/a/b)