Metabolismo dei singoli amminoacidi: vie e reazioni enzimatiche
Documento dall'Università sul metabolismo dei singoli amminoacidi. Il Pdf esplora le vie metaboliche, le reazioni enzimatiche e le implicazioni cliniche di vari amminoacidi, come aspartato e glutammato, per il corso di Biologia a livello universitario.
Mostra di più17 pagine
Visualizza gratis il Pdf completo
Registrati per accedere all’intero documento e trasformarlo con l’AI.
Anteprima
22 aprile 2024
Metabolismo dei singoli amminoacidi
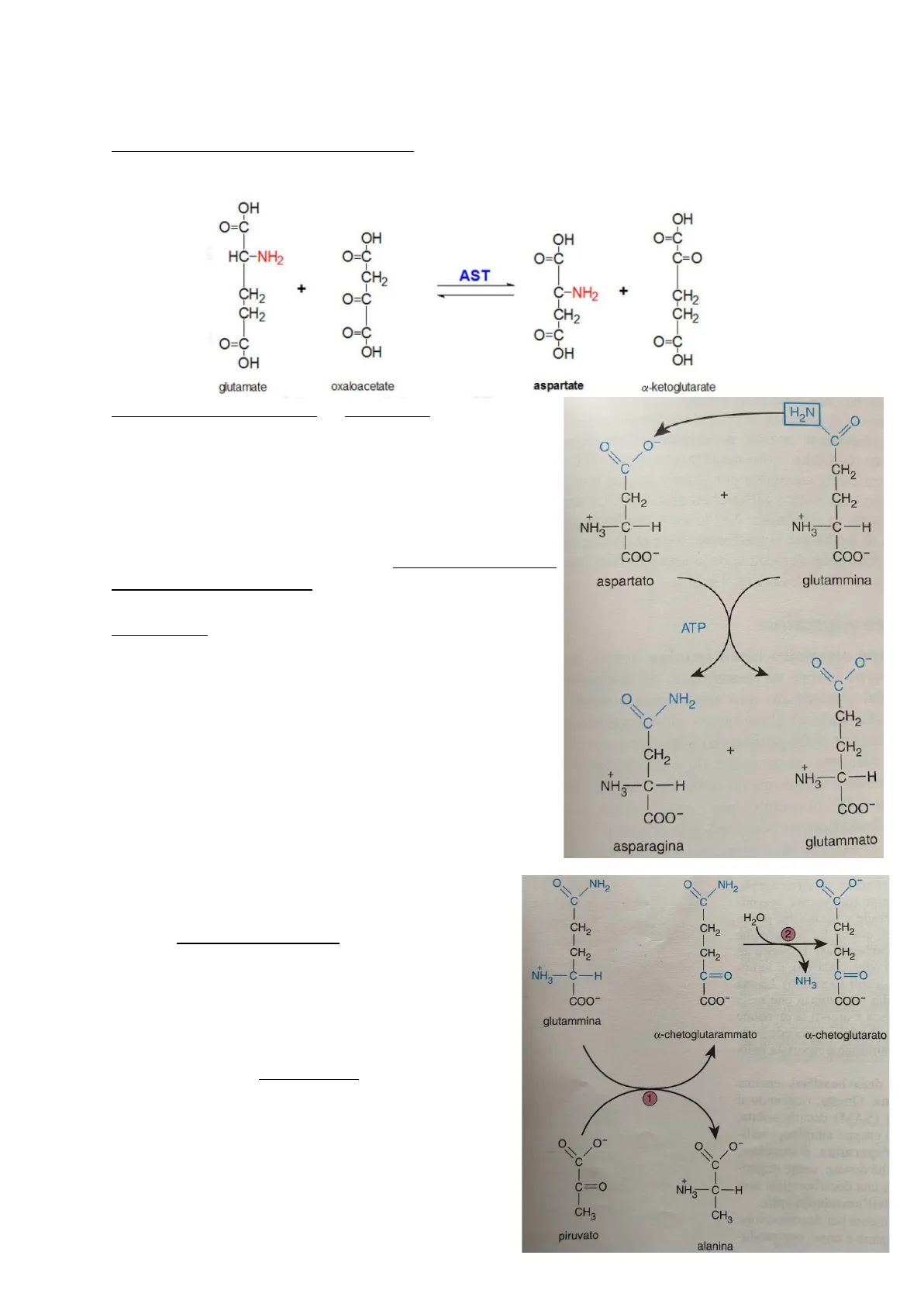
Aspartato e glutammato
Aminoacidi non essenziali e glucogenici - in equilibrio rispettivamente con ossalacetato e a-chetoglutarato - possono formare le rispettive amidi asparagina e glutammina incorporando ammoniaca.
Formazione asparagina
sintetizzata da aspartato e glutammina:
- glutammina cede gruppo ammidico all'aspartato - catalizzato da asparagina sintetasi dipendente da glutammina (richiede E fornita da ATP).
Asparagina può essere riconvertita in aspartato con asparaginasi (enzima idrolitico)
Cellule tumorali non sono in grado di sintetizzare asparagina (necessaria per sintesi proteica) - fornita da cellule normali, che la sintetizzano dall'acido aspartico - possibile controllare crescita di alcuni tumori con asparaginasi: idrolizza asparagina in aspartato e ammoniaca
- sottrae ammide a cellule tumorali bloccandone lo sviluppo
Formazione glutammina
- Per transaminazione, glutammina può cedere gruppo amminico a vari chetoacidi + formare a-chetoglutarammato
- Idrolizzato ad a-chetoglutarato e ammoniaca - con specifica deamminasi
a-chetoglutarammato aumenta fino a 10 volte nel liquido cerebrospinale dei pazienti in coma epatico - riveste notevole interesse nella patogenesi della encefalopatia da intossicazione da ammoniaca.
Glutammina può essere convertita in acido glutammico con glutamminasi (enzima idrolitico abbondante in fegato e reni)
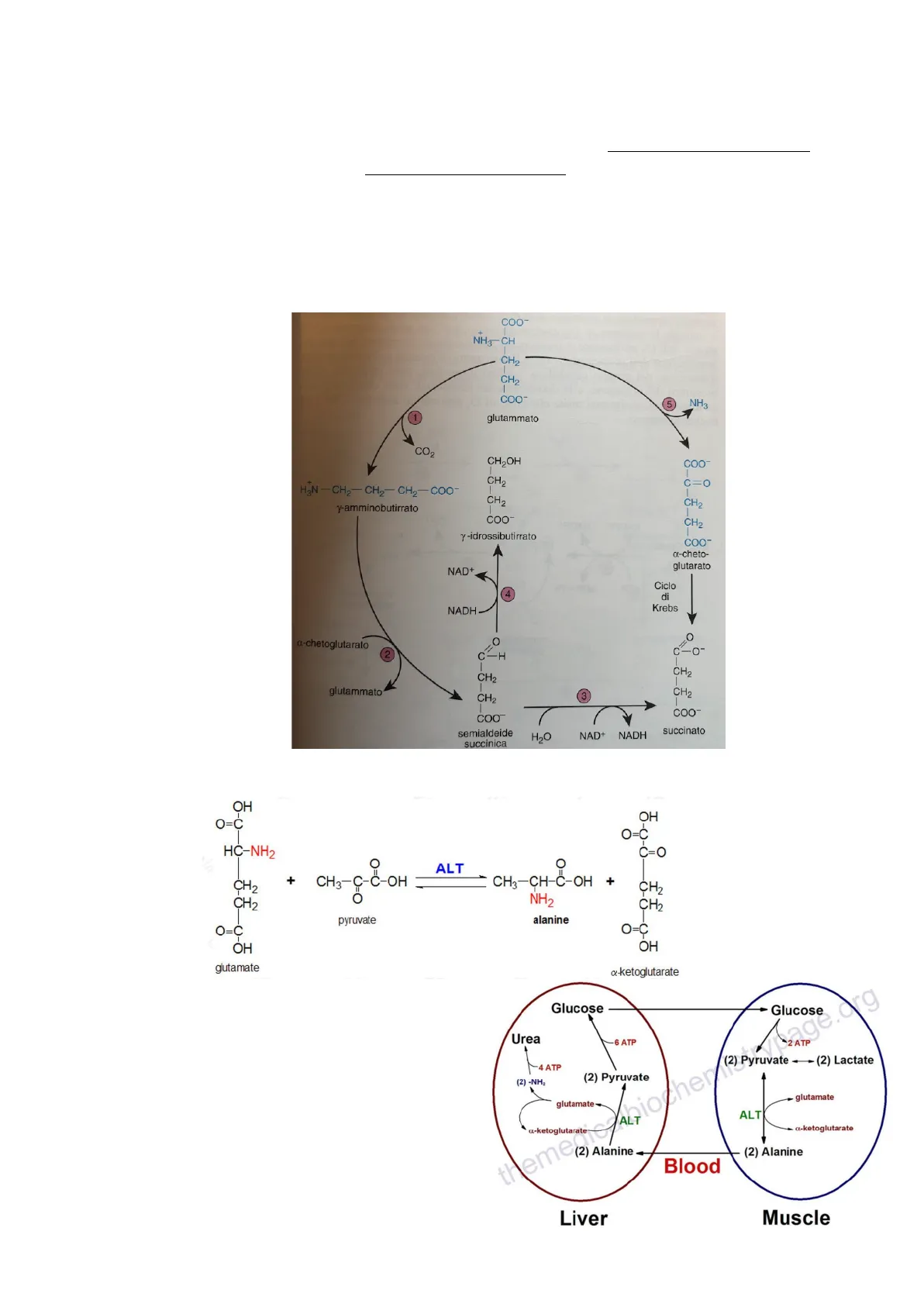
Glutammato (prodotto per azione reversibile a carico della glutammico deidrogenasi [n. 5]):
- nel tessuto nervoso per decarbossilazione catalizzata da glutammato decarbossilasi (PLP dipendente) forma il y-amminobutirrato (GABA), neurotrasmettitore
- GABA trasformato in semialdeide succinica per azione di una transaminasi: trasferimento del gruppo amminico all'a-chetoglutarato
- Semialdeide succinica ossidata in succinato, con semialdeide succinica deidrogenasi [oppure, con lattico deidrogenasi, può essere ridotta in y-idrossibutirrato]
Processo nel tessuto nervoso alternativo al ciclo di Krebs per trasformazione a-chetoglutarato -> succinato
Alanina
È uno degli aminoacidi che si trovano più concentrati nell'organismo - genera forma di scambio biochimico importante tra muscolo e fegato, un po' come ciclo di Cori (attività reverse di isoenzimi della ALT) - ciclo glucosio-alanina che può essere usato dall'organismo durante il digiuno quando proteine muscolari sono degradate per trarre E dagli AA
Allontanamento e gestione dell'N da parte del fegato - sottoforma di urea. Gluconeogenesi = non è reverse della glicolisi perchè piruvico utilizzato nella gluconeogenesi non è glucidico ma deriva da altre sorgenti, come acido lattico.
Cisteina
Ricavata da omocisteina e serina con 2 reazioni catalizzate da cistationina sintetasi e cistationinasi (PLP dipendenti).
Sintesi prevede attivazione della metionina - zolfo sulla cisteina è lo zolfo della metionina, ma la parte residuale della cisteina deriva soprattutto da serina, che differisce per un ossidrile al posto del sulfidrile
- Metionina interagisce con ATP, che lascia gran parte della sua struttura - lascia AMP allo zolfo della metionina per formare SAM = classico importante donatore di gruppi metilici
- Donando gruppo metilico, si trasforma in SAO (S-adenosil-omocisteina), che sgancia adenosina e rimane come omocisteina = a-aminoacido con gruppo sulfidrilico esposto (a differenza di metionina che ha S bloccato da gruppo metilico) - ricorda da vicino cisteina
- Omocisteina non si trasforma in cisteina per eliminazione di 1C, ma deve interagire con serina, per condensazione - generazione cistiationina con cistiatonina sintasi
- Ponte zolfo per generare cisteina, lisi e rilascio gruppo aminico - formazione di a-chetobutirrato - azione della cistationina liasi
Possibilità, con cofattore metilene-THE, di riconvertire omocisteina in metionina, attraverso metionina sintasi - metionina è aminoacido essenziale (perché comunque omocisteina deriva da metionina), ma ne permette recupero. THF ha nella sua via di eventuale riconversione a metil-THF intermedio = 5,10-metilenTHF, intermedio di trasformazione da dUMP a dTMP, essenziale per corretto assetto del DNA.
S-adenosil-metionina = SAM - triplicità di configurazione del gruppo zolfo, che di solito può generare 2 legami: così il gruppo metilico diviene altamente instabile e facilmente rilasciabile. Quando si stacca zolfo, si forma S-adenosil-omocisteina - percorso reversibile.
Correlazione metabolismo del folato e forme intermedie di cofattori, metabolismo di metionina e cisteina, ruolo intermedio dell'omocisteina e contemporaneo equilibrio di mantenimento del DNA.
Importanza del folico come versatile agente cofattore di trasferimenti di unità monocarboniose - azione di alcune sostanze ad attività inibitoria:
- sulfanilamidici come agenti antibatterici;
- metotrexato: inibitore e competitivo del tetraidrofolato - uno dei + efficaci agenti chimici antitumorali tuttora usati, interferendo con corretta attività del tetraidrofolato e quindi con corretta sintesi del DNA
B12 è cofattore essenziale con folico nella conversione della omocisteina, e quindi in una delle vie di recupero dell'omocisteina - un innalzarsi dell'omocisteina è indice precoce di disagio del metabolismo proteico e del DNA - grande attenzione nei dosaggi dell'omocisteina come marker di disagio sistemico e molto interesse riguardo all'esordio di patologie cardiovascolari - omocisteinemia per molti anni grande attenzione nella diagnostica di laboratorio
Anomalie degli enzimi
- Deficienza congenita di cistationina sintetasi produce omocistinuria - omocisteina che si accumula è ossidata a omocisteina - si accumula nel sangue e eliminata con urine - pazienti che presentano elevato contenuto ematico di omocisteina, metionina e omocisteina + grave sintomatologia dovuta ad anomalie del collagene (deformazione di articolazioni e ossa e dislocazione delle lenti dell'occhio), probabilmente dovute a anomalie dei legami crociati -S-S- per sostituzione della omocisteina alla cisteina.
- Anomala conformazione congenita della cistationinasi - implica diminuita affinità per PLP = diminuita attività enzimatica - accumulo di cistationina e cistationinuria
Catabolismo della cisteina
- Ossidazione a piruvato
- Cisteina diossigenasi - cisteina subisce ossidazione in corrispondenza del gruppo SH - cistein-sulfinato
- Transaminato in 3-sulfinil-piruvato con GOT (glutammato ossalacetato transaminasi)
- Demolito in piruvato + solfito [cisteina può essere trasformata in piruvato anche con cisteina desulfidrasi]
- Solfito ossidato a solfato con solfito ossidasi - solfato utilizzato per sintesi dei glicosaminoglicani e solfatidi + nel fegato formazione di esteri solforici di alcoli, fenoli e steroli. Eccesso di solfato escreto con urine
Formazione di esteri solforici costituisce (come glucuronazione e coniugazione con glicina) = processo di detossificazione epatica
Deficienza congenita di solfito ossidasi - gravi alterazioni neurologiche e morte precoce (probabilmente la causa è accumulo di solfito piuttosto che mancanza di solfato)
Sintesi del glutatione (y-glutamil-cisteinil-glicina)
2 reazioni (entrambi gli enzimi richiedono ATP):
- Glutammato + cisteina -> y-glutamil-cisteina - da y-glutamil-cisteina sintetasi
- y-glutamil-cisteina + glicina -> glutatione - da glutatione sintetasi
Glutatione - sintetizzabile a partire da glutammato, cisteina e glicina con intervento dell'ATP, per generare molecola che ha pto di attività specifica nell'esposizione del gruppo sulfidrilico donato da cisteina. Nel meccanismo di azione spesso si può scrivere GSH - glutatione ridotto sfrutta potenzialità ossidoriduttive del gruppo sulfidrilico per generare ponte disolfuro tra 2 molecole di glutatione - possono ossidarsi per generare glutatione nella forma ossidata GS-SG, dimero del glutatione.
- Formazione della taurina = componente degli acidi biliari
Procede dal cistein-sulfinato con vie alternative.